氧化还原反应
图片预览





文档简介
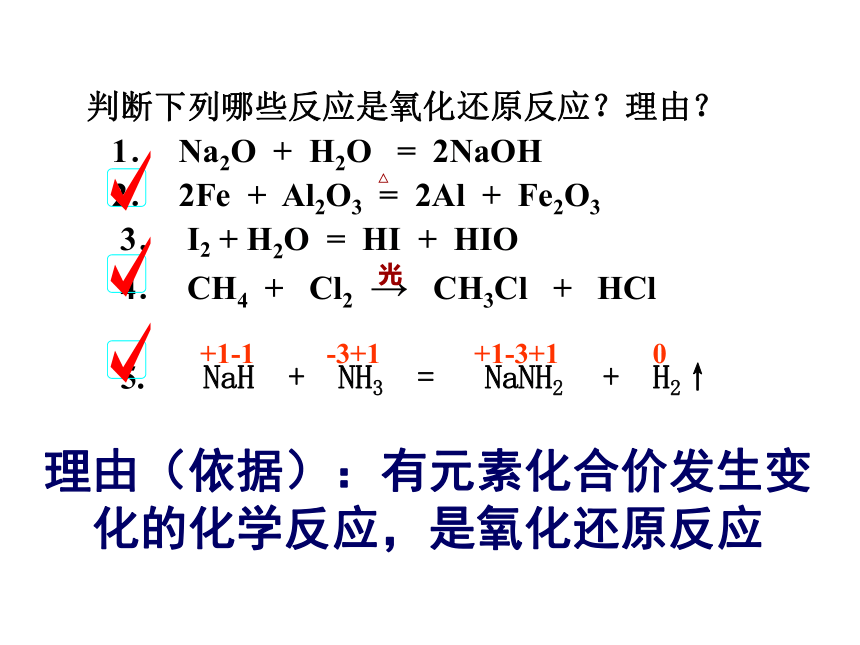
课件20张PPT。氧化还原反应判断下列哪些反应是氧化还原反应?理由?
1.? Na2O + H2O = 2NaOH
2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? I2 + H2O = HI + HIO
4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
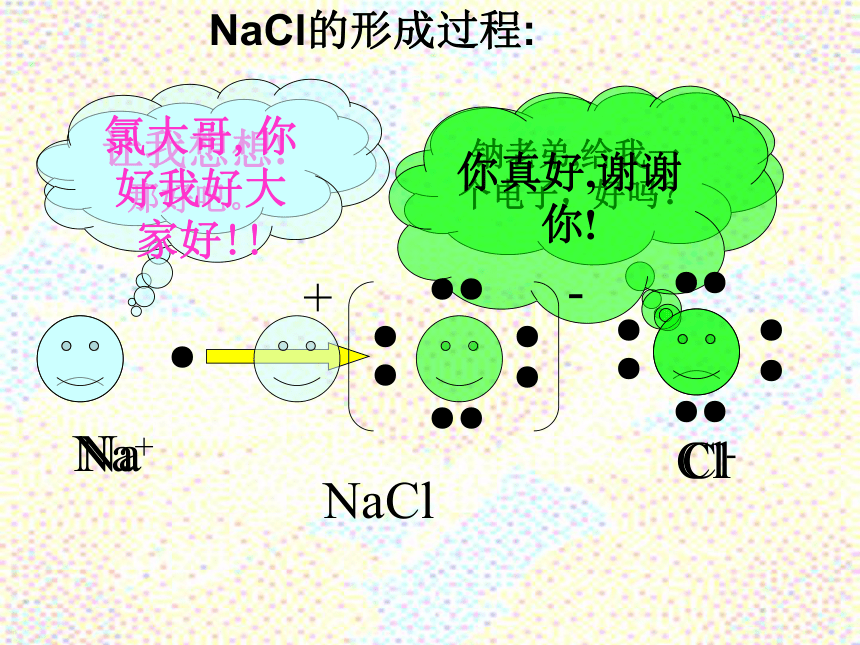
光△ +1-1 -3+1 +1-3+1 0理由(依据):有元素化合价发生变化的化学反应,是氧化还原反应Cl●●Na钠老弟,给我一个电子,好吗?让我想想!那好吧。NaCl的形成过程:你真好,谢谢你!氯大哥,你好我好大家好!!Na+Cl-H2+CuO=Cu+H2O氧化反应:元素化合价升高的反应(失去电子的反应)
还原反应:元素化合价降低的反应(得到电子的反应)
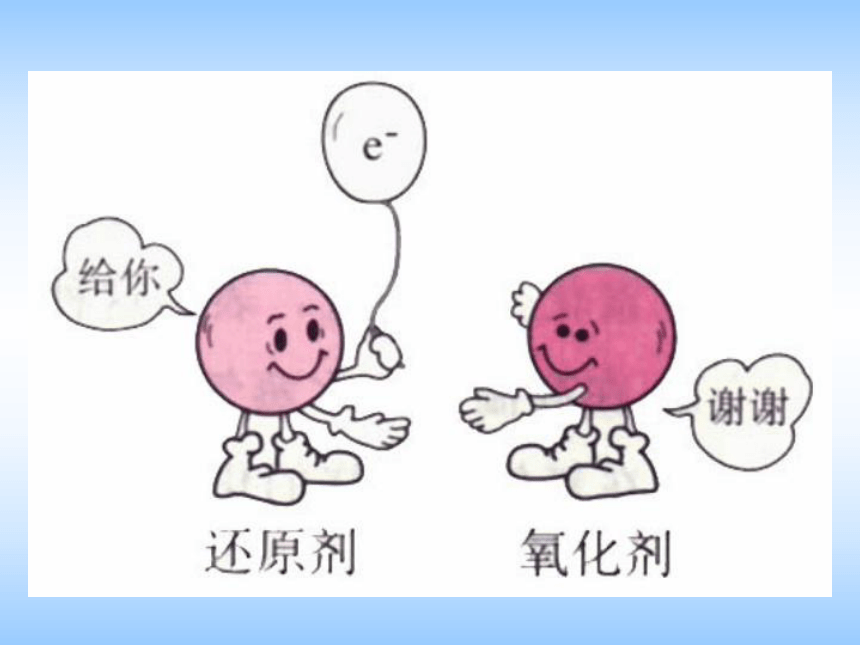
还原剂:所含元素化合价升高的反应物
氧化剂:所含元素化合价降低的反应物
氧化还原反应的几个基本概念:氧化还原反应的几个基本概念: CO + CuO= Cu + CO2还原产物氧化产物氧化剂还原剂还原产物氧化产物失高氧 得降还
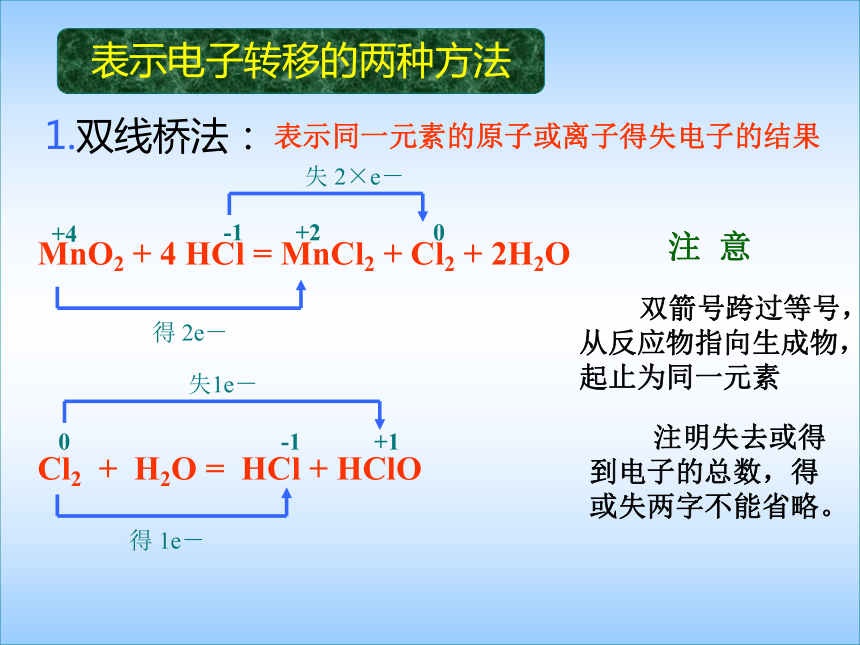
剂相反 性相同氧化还原反应电子转移的表示方法1。双线桥法2。单线桥法表示电子转移的两种方法1.双线桥法:失 2×e-Cl2 + H2O = HCl + HClO失1e-得 1e-表示同一元素的原子或离子得失电子的结果 双箭号跨过等号,从反应物指向生成物,起止为同一元素 注明失去或得到电子的总数,得或失两字不能省略。注 意MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O得 2e-+4+2-100+1-1表示电子转移的两种方法2.单线桥法:Cl2 + H2O = HCl + HClO 表示原子或离子间得失电子的情况 箭号不跨过等号,
起点为失电子元素,终
点为得电子元素。 只标电子转移总
数,不标得与失。注 意2e-MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O+4+2-100+1-11e-Cl- Cl + H2O = HCl + HClO小 结 用双线桥表示同种元素的电子得失。 双箭号从反应物指向生成物且起止为同一元素。注明得与失。用单线桥表示电子转的方向。 箭号起点为失电子元素,终点为得电子元素。不标得与失。 两种方法都应注意:箭头、箭尾一定要对准
物质中的某元素。小结1、氧化反应和还原反应一定同时发生。
2、特征和判断依据为元素化合价变化。
3、本质是电子转移。
4、概念:有电子转移的反应就叫做氧化还原反应5、失 、升 、氧 得 、降 、还失电子价升被氧化发生氧化反应得电子价降被还原发生还原反应作业:P474作 业1.用双线桥表示同种元素的电子得失。2.用单线桥表示不同种元素的电子转移。 Cl2 + 2 KI = 2 KCl + I2Fe +CuSO4 = FeSO4 + Cu四、有关氧化还原反应的基本概念1、弄清几对关系:
还原剂:升、失、氧、氧
氧化剂:降、得、还、还记忆方法:
升失氧氧,降得还还,
若要说剂,正好相反。
失氧(羊)高(羔)还 3H2 + Fe2O3 = 2Fe + 3H2OZn +2HCl = ZnCl2 + H2↑信息提示 与氢气反应生成卤化氢:
H2+F2==2HF (在暗处即可发生爆炸)
H2+Cl2==2HCl (光照即可发生爆炸)
H2+Br2==2HBr (500℃时较慢地进行)
H2+I2==2HI (不断高温加热条件下缓慢地
进行HI不稳定,同时分解) 2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
信息提示 常见的氧化剂和还原剂 1、常见氧化剂:(1)活泼的非金属:F2、Cl2、Br2、O2;
(2)高价的氧化物:CuO、Fe2O3、WO3、CO2
(3)高价的含氧酸及其盐: KMnO4、 K2Cr2O7、 浓H2SO4、HNO3、KClO3;
(4)某些阳离子:Cu2+、Fe3+、H+
(5)过氧化物:如H2O2、Na2O22、常见还原剂 (1)活泼的金属:K , Na , Mg , Fe , Al
(2)某些非金属:H2 , C
(3)变价元素的低价态物质:CO , Fe2+、Cu+
(4)某些阴离子: I-, S2-
(5)某些低价含氧酸根:SO32-
1.? Na2O + H2O = 2NaOH
2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? I2 + H2O = HI + HIO
4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
光△ +1-1 -3+1 +1-3+1 0理由(依据):有元素化合价发生变化的化学反应,是氧化还原反应Cl●●Na钠老弟,给我一个电子,好吗?让我想想!那好吧。NaCl的形成过程:你真好,谢谢你!氯大哥,你好我好大家好!!Na+Cl-H2+CuO=Cu+H2O氧化反应:元素化合价升高的反应(失去电子的反应)
还原反应:元素化合价降低的反应(得到电子的反应)
还原剂:所含元素化合价升高的反应物
氧化剂:所含元素化合价降低的反应物
氧化还原反应的几个基本概念:氧化还原反应的几个基本概念: CO + CuO= Cu + CO2还原产物氧化产物氧化剂还原剂还原产物氧化产物失高氧 得降还
剂相反 性相同氧化还原反应电子转移的表示方法1。双线桥法2。单线桥法表示电子转移的两种方法1.双线桥法:失 2×e-Cl2 + H2O = HCl + HClO失1e-得 1e-表示同一元素的原子或离子得失电子的结果 双箭号跨过等号,从反应物指向生成物,起止为同一元素 注明失去或得到电子的总数,得或失两字不能省略。注 意MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O得 2e-+4+2-100+1-1表示电子转移的两种方法2.单线桥法:Cl2 + H2O = HCl + HClO 表示原子或离子间得失电子的情况 箭号不跨过等号,
起点为失电子元素,终
点为得电子元素。 只标电子转移总
数,不标得与失。注 意2e-MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O+4+2-100+1-11e-Cl- Cl + H2O = HCl + HClO小 结 用双线桥表示同种元素的电子得失。 双箭号从反应物指向生成物且起止为同一元素。注明得与失。用单线桥表示电子转的方向。 箭号起点为失电子元素,终点为得电子元素。不标得与失。 两种方法都应注意:箭头、箭尾一定要对准
物质中的某元素。小结1、氧化反应和还原反应一定同时发生。
2、特征和判断依据为元素化合价变化。
3、本质是电子转移。
4、概念:有电子转移的反应就叫做氧化还原反应5、失 、升 、氧 得 、降 、还失电子价升被氧化发生氧化反应得电子价降被还原发生还原反应作业:P474作 业1.用双线桥表示同种元素的电子得失。2.用单线桥表示不同种元素的电子转移。 Cl2 + 2 KI = 2 KCl + I2Fe +CuSO4 = FeSO4 + Cu四、有关氧化还原反应的基本概念1、弄清几对关系:
还原剂:升、失、氧、氧
氧化剂:降、得、还、还记忆方法:
升失氧氧,降得还还,
若要说剂,正好相反。
失氧(羊)高(羔)还 3H2 + Fe2O3 = 2Fe + 3H2OZn +2HCl = ZnCl2 + H2↑信息提示 与氢气反应生成卤化氢:
H2+F2==2HF (在暗处即可发生爆炸)
H2+Cl2==2HCl (光照即可发生爆炸)
H2+Br2==2HBr (500℃时较慢地进行)
H2+I2==2HI (不断高温加热条件下缓慢地
进行HI不稳定,同时分解) 2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
信息提示 常见的氧化剂和还原剂 1、常见氧化剂:(1)活泼的非金属:F2、Cl2、Br2、O2;
(2)高价的氧化物:CuO、Fe2O3、WO3、CO2
(3)高价的含氧酸及其盐: KMnO4、 K2Cr2O7、 浓H2SO4、HNO3、KClO3;
(4)某些阳离子:Cu2+、Fe3+、H+
(5)过氧化物:如H2O2、Na2O22、常见还原剂 (1)活泼的金属:K , Na , Mg , Fe , Al
(2)某些非金属:H2 , C
(3)变价元素的低价态物质:CO , Fe2+、Cu+
(4)某些阴离子: I-, S2-
(5)某些低价含氧酸根:SO32-
