7.2物质溶解的量同步练习---2021-2022学年九年级化学科粤版(2012)下册(word版含答案)
文档属性
| 名称 | 7.2物质溶解的量同步练习---2021-2022学年九年级化学科粤版(2012)下册(word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 346.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 11:23:08 | ||
图片预览


文档简介
科粤版九年级化学下册 7.2 物质溶解的量
一、单选题
1.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
2.关于饱和溶液的叙述正确的是( )
A.饱和溶液一定是浓溶液
B.增加溶质可使不饱和溶液变为饱和溶液
C.饱和溶液就是不能再溶解任何物质的溶液
D.同一物质的饱和溶液一定比不饱和溶液的浓度大
3.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
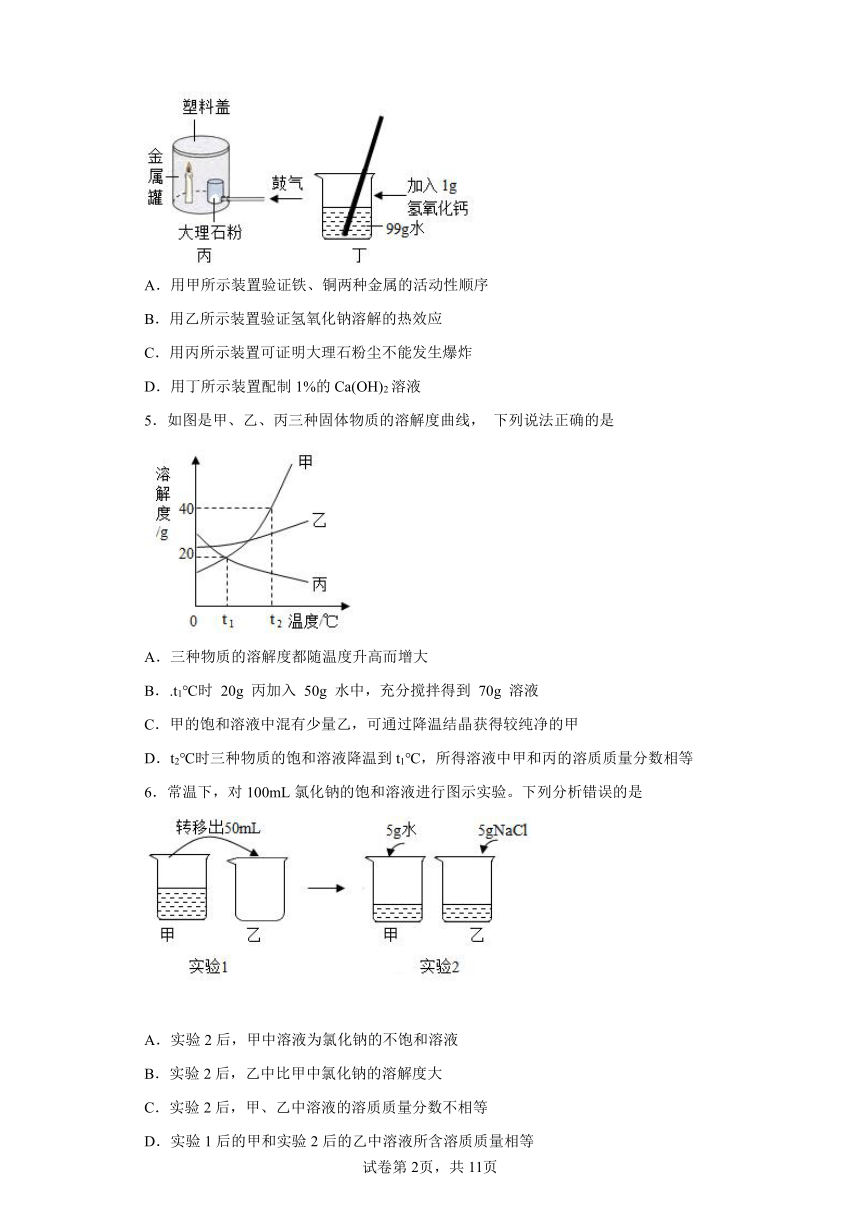
4.某兴趣小组同学用下列实验装置进行相应实验,不能达到实验目的的是
A.用甲所示装置验证铁、铜两种金属的活动性顺序
B.用乙所示装置验证氢氧化钠溶解的热效应
C.用丙所示装置可证明大理石粉尘不能发生爆炸
D.用丁所示装置配制1%的Ca(OH)2溶液
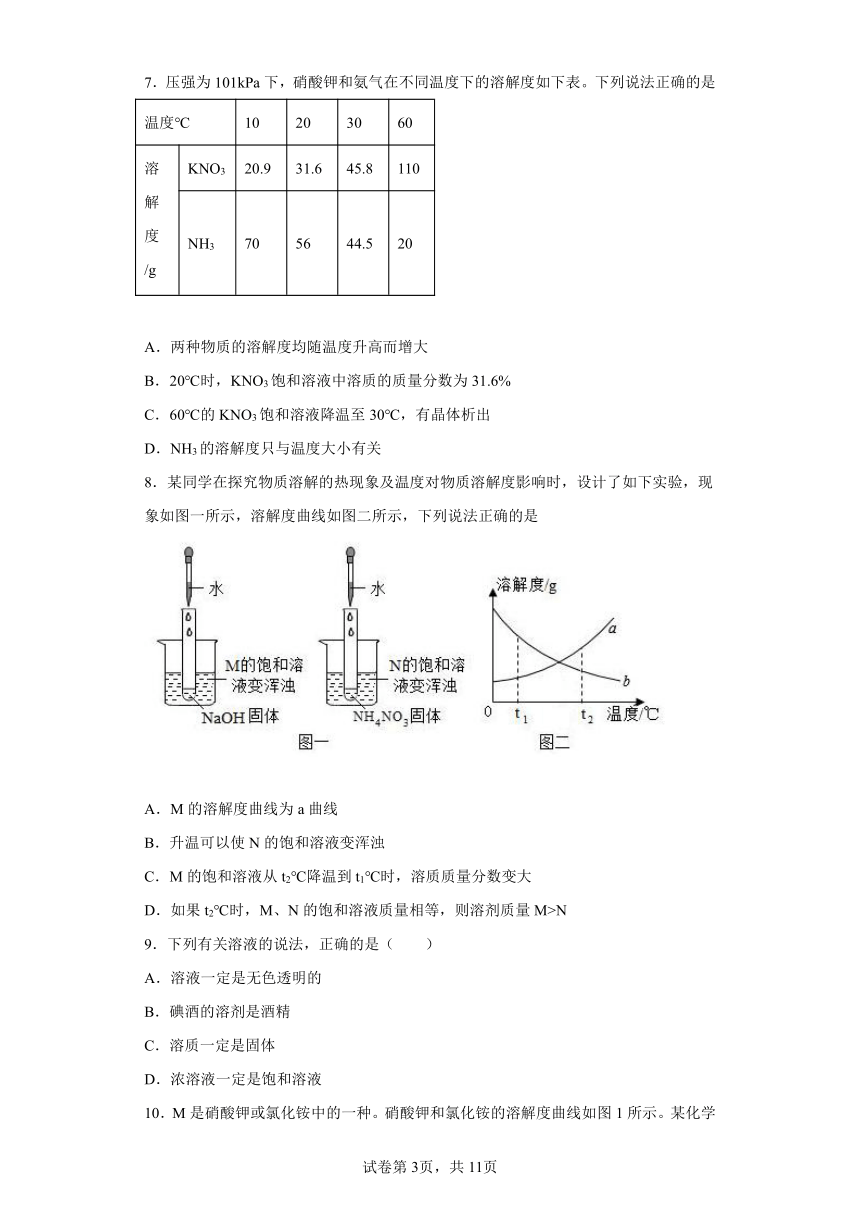
5.如图是甲、乙、丙三种固体物质的溶解度曲线, 下列说法正确的是
A.三种物质的溶解度都随温度升高而增大
B..t1℃时 20g 丙加入 50g 水中,充分搅拌得到 70g 溶液
C.甲的饱和溶液中混有少量乙,可通过降温结晶获得较纯净的甲
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中甲和丙的溶质质量分数相等
6.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
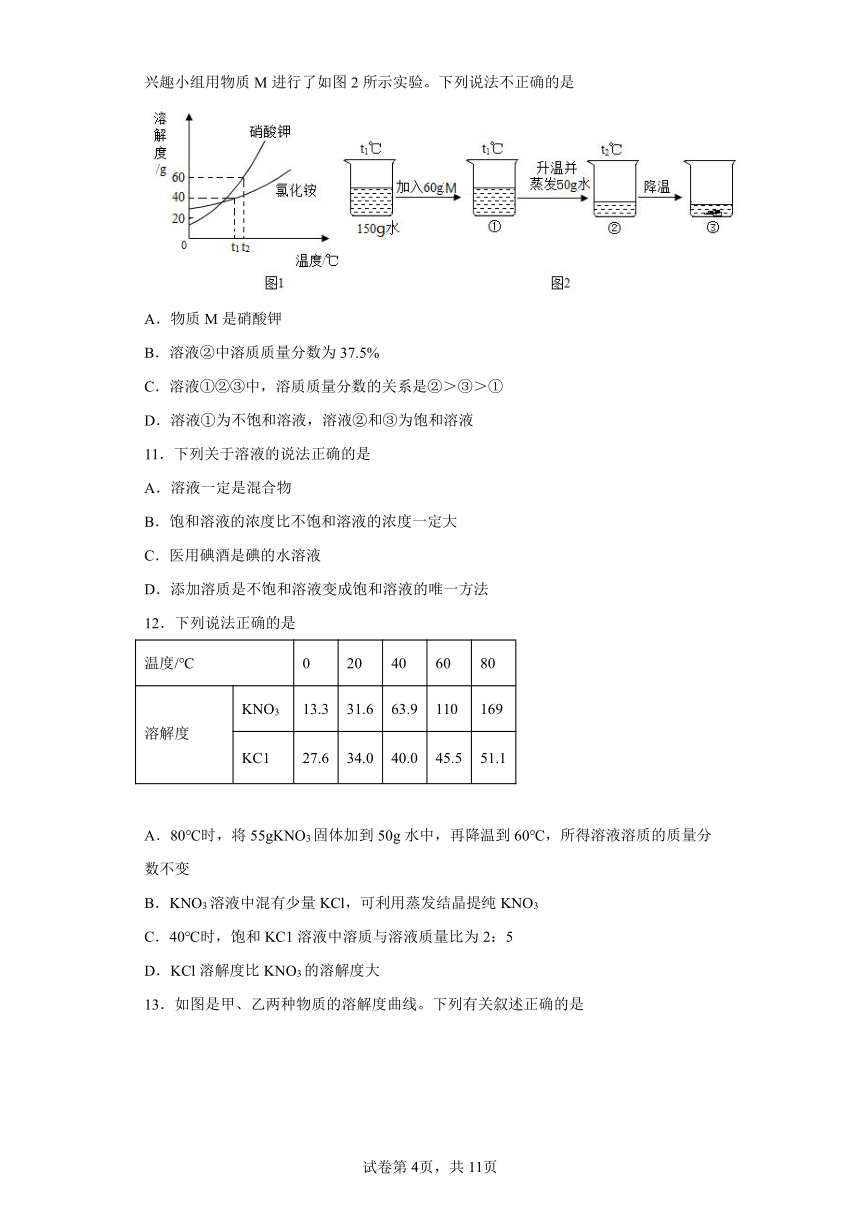
7.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度只与温度大小有关
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.下列有关溶液的说法,正确的是( )
A.溶液一定是无色透明的
B.碘酒的溶剂是酒精
C.溶质一定是固体
D.浓溶液一定是饱和溶液
10.M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是
A.物质M是硝酸钾
B.溶液②中溶质质量分数为37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
11.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
12.下列说法正确的是
温度/℃ 0 20 40 60 80
溶解度 KNO3 13.3 31.6 63.9 110 169
KC1 27.6 34.0 40.0 45.5 51.1
A.80℃时,将55gKNO3固体加到50g水中,再降温到60℃,所得溶液溶质的质量分数不变
B.KNO3溶液中混有少量KCl,可利用蒸发结晶提纯KNO3
C.40℃时,饱和KC1溶液中溶质与溶液质量比为2:5
D.KCl溶解度比KNO3的溶解度大
13.如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是
A.20℃时,100g甲、乙两种物质的溶液中含有相同质量的溶质
B.40℃时,甲比乙的溶解度、溶质的质量分数都大
C.甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲>乙
D.将100g溶质的质量分数为20%的甲溶液从40℃降温至20℃,其溶质的质量分数仍然为20%
14.现对某物质的不饱和溶液进行恒温蒸发,若蒸发水析出固体,若蒸发水析出固体,若蒸发水析出固体,则下列关系正确的是
A. B.
C. D.
15.下面关于饱和溶液的说法中,正确的是( )
A.含有溶质很多的溶液
B.还能继续溶解某种溶质的溶液
C.不能继续溶解某种溶质的溶液
D.在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液
16.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
二、综合应用题
17.溶液是生产生活中常见的物质,依据相关信息回答问题。资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如下表所示:
温度/℃ 10 20 30 40 50 60 70
溶解度/g 21 32 46 64 86 110 138
(1)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。
①(填字母序号) ______ 中盛的一定是饱和溶液。
②使B烧杯的溶液升温至50℃时,溶液的质量为 _________ g。
③采用一种方法使A中的固体恰好溶解。对于最终四个烧杯中的溶液,下列说法正确的是 _____ (填字母序号)。
a.溶剂质量可能相等
b.溶质质量可能相等
c.溶质质量分数可能有相等的
d.烧杯A中的溶液质量分数可能最大
(2)某校化学课外小组用硫酸亚铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体,主要的操作流程如图:
请回答下列问题:
①上述操作过程中用到的玻璃仪器有:①烧杯;②玻璃棒;③酒精灯;④温度计;⑤ ______ ;
②流程中生成气体B的反应的化学方程式是: __________ 。
18.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
19.20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两物质的溶解度曲线如图3.请结合图示回答下列问题:
(1)p点表示30℃时甲、乙两物质的溶解度____________。
(2)图3中N表示的是 ______物质的溶解度曲线。
(3)图1中甲一定是__________溶液,乙__________是不饱和溶液。
20.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在t2℃_____(填“饱和”或“不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至_____℃。
(3)t2℃时,若M点所示溶液的质量为a g,将该溶液降温到t1℃,析出晶体的质量为_____g(用分数表示,假设此过程水不蒸发,析出晶体不含结晶水)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A M、N点均不动B M、N点均垂直上移
C M点沿曲线下移;N点垂直上移至曲线D M点不动,N点垂直上移至曲线
(5)物质的溶解性也常应用于化工生厂。某化工厂用废硫酸制备K2SO4的流程如下:
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
①反应Ⅲ发生复分解反应,写出化学方程式_____。
②洗涤反应Ⅲ所得晶体最好用下列的_____(填序号)。
a、BaCl2溶液b、饱和NH4Cl溶液c、冷水d、饱和K2SO4溶液
21.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
22.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.D
4.D
5.C
6.B
7.C
8.D
9.B
10.C
11.A
12.A
13.D
14.B
15.D
16.C
17. ABC 186 acd 漏斗 Fe+H2SO4=FeSO4+H2↑
18. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
19. 相等 乙 饱和 不一定
20. 饱和 t3 a/7 D 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl d
21.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
22. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
2.关于饱和溶液的叙述正确的是( )
A.饱和溶液一定是浓溶液
B.增加溶质可使不饱和溶液变为饱和溶液
C.饱和溶液就是不能再溶解任何物质的溶液
D.同一物质的饱和溶液一定比不饱和溶液的浓度大
3.夏季,鱼虾养殖塘内常放一些水泵,把水喷向空中(如图),从化学角度分析,喷水的目的是
A.增加观赏性 B.降低塘内水温
C.杀灭水中细菌 D.便于溶解氧气
4.某兴趣小组同学用下列实验装置进行相应实验,不能达到实验目的的是
A.用甲所示装置验证铁、铜两种金属的活动性顺序
B.用乙所示装置验证氢氧化钠溶解的热效应
C.用丙所示装置可证明大理石粉尘不能发生爆炸
D.用丁所示装置配制1%的Ca(OH)2溶液
5.如图是甲、乙、丙三种固体物质的溶解度曲线, 下列说法正确的是
A.三种物质的溶解度都随温度升高而增大
B..t1℃时 20g 丙加入 50g 水中,充分搅拌得到 70g 溶液
C.甲的饱和溶液中混有少量乙,可通过降温结晶获得较纯净的甲
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中甲和丙的溶质质量分数相等
6.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
7.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度只与温度大小有关
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.下列有关溶液的说法,正确的是( )
A.溶液一定是无色透明的
B.碘酒的溶剂是酒精
C.溶质一定是固体
D.浓溶液一定是饱和溶液
10.M是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是
A.物质M是硝酸钾
B.溶液②中溶质质量分数为37.5%
C.溶液①②③中,溶质质量分数的关系是②>③>①
D.溶液①为不饱和溶液,溶液②和③为饱和溶液
11.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
12.下列说法正确的是
温度/℃ 0 20 40 60 80
溶解度 KNO3 13.3 31.6 63.9 110 169
KC1 27.6 34.0 40.0 45.5 51.1
A.80℃时,将55gKNO3固体加到50g水中,再降温到60℃,所得溶液溶质的质量分数不变
B.KNO3溶液中混有少量KCl,可利用蒸发结晶提纯KNO3
C.40℃时,饱和KC1溶液中溶质与溶液质量比为2:5
D.KCl溶解度比KNO3的溶解度大
13.如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是
A.20℃时,100g甲、乙两种物质的溶液中含有相同质量的溶质
B.40℃时,甲比乙的溶解度、溶质的质量分数都大
C.甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲>乙
D.将100g溶质的质量分数为20%的甲溶液从40℃降温至20℃,其溶质的质量分数仍然为20%
14.现对某物质的不饱和溶液进行恒温蒸发,若蒸发水析出固体,若蒸发水析出固体,若蒸发水析出固体,则下列关系正确的是
A. B.
C. D.
15.下面关于饱和溶液的说法中,正确的是( )
A.含有溶质很多的溶液
B.还能继续溶解某种溶质的溶液
C.不能继续溶解某种溶质的溶液
D.在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液
16.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
二、综合应用题
17.溶液是生产生活中常见的物质,依据相关信息回答问题。资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如下表所示:
温度/℃ 10 20 30 40 50 60 70
溶解度/g 21 32 46 64 86 110 138
(1)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。
①(填字母序号) ______ 中盛的一定是饱和溶液。
②使B烧杯的溶液升温至50℃时,溶液的质量为 _________ g。
③采用一种方法使A中的固体恰好溶解。对于最终四个烧杯中的溶液,下列说法正确的是 _____ (填字母序号)。
a.溶剂质量可能相等
b.溶质质量可能相等
c.溶质质量分数可能有相等的
d.烧杯A中的溶液质量分数可能最大
(2)某校化学课外小组用硫酸亚铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体,主要的操作流程如图:
请回答下列问题:
①上述操作过程中用到的玻璃仪器有:①烧杯;②玻璃棒;③酒精灯;④温度计;⑤ ______ ;
②流程中生成气体B的反应的化学方程式是: __________ 。
18.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
19.20℃时,将等质量的甲、乙两种固体分别放入盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两物质的溶解度曲线如图3.请结合图示回答下列问题:
(1)p点表示30℃时甲、乙两物质的溶解度____________。
(2)图3中N表示的是 ______物质的溶解度曲线。
(3)图1中甲一定是__________溶液,乙__________是不饱和溶液。
20.某固体物质(不含结晶水)的溶解度曲线如图,M、N两点分别表示该物质在不同温度下的两种溶液,当条件改变时,溶液的状态在图中对应的点的位置可能随之变化,回答下列问题:
(1)M点表示该物质在t2℃_____(填“饱和”或“不饱和”)溶液。
(2)将M点所示的溶液变到N点所示的溶液,可以将M点的溶液降温至t1℃,过滤除去析出的晶体后,再将溶液升温至_____℃。
(3)t2℃时,若M点所示溶液的质量为a g,将该溶液降温到t1℃,析出晶体的质量为_____g(用分数表示,假设此过程水不蒸发,析出晶体不含结晶水)。
(4)当恒温蒸发溶剂时,M、N两点的位置变化正确的是_____(填字母)
A M、N点均不动B M、N点均垂直上移
C M点沿曲线下移;N点垂直上移至曲线D M点不动,N点垂直上移至曲线
(5)物质的溶解性也常应用于化工生厂。某化工厂用废硫酸制备K2SO4的流程如下:
物质 KCl K2SO4 NH4Cl (NH4)2SO4
溶解度/g(20℃) 34.2 11.1 37.2 75.4
①反应Ⅲ发生复分解反应,写出化学方程式_____。
②洗涤反应Ⅲ所得晶体最好用下列的_____(填序号)。
a、BaCl2溶液b、饱和NH4Cl溶液c、冷水d、饱和K2SO4溶液
21.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
22.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.D
4.D
5.C
6.B
7.C
8.D
9.B
10.C
11.A
12.A
13.D
14.B
15.D
16.C
17. ABC 186 acd 漏斗 Fe+H2SO4=FeSO4+H2↑
18. 酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
19. 相等 乙 饱和 不一定
20. 饱和 t3 a/7 D 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl d
21.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
22. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
答案第1页,共2页
答案第1页,共2页
