人教版化学九下8.2金属的化学性质一课一练(word版 含答案)
文档属性
| 名称 | 人教版化学九下8.2金属的化学性质一课一练(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 91.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 16:01:37 | ||
图片预览



文档简介
人教版化学九下 8.2 金属的化学性质 一课一练
一、单选题
1.将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列叙述正确的是
①滤渣中一定含有锌
②滤渣中一定含有铜,可能含有锌
③向滤渣中加入稀盐酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
A.①④⑤ B.②③④⑤ C.②③④ D.②④
2.有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是
A.甲>丙>乙 B.丙>乙>甲 C.甲>乙>丙 D.丙>甲>乙
3.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 杂质 所用试剂和操作方法
A H2O NaCl 向水中加入活性炭吸附
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入足量的铁粉,充分搅拌后过滤
D CuO 木炭 隔绝空气加热至固体质量不再发生变化
A.A B.B C.C D.D
4.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
5.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
6.将金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A.R>Cu B.R>Fe C.Zn>R D.R>Ag
7.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
8.下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
9.收藏家收藏清末的铝器,至今保存完好,该艺术品不易锈损的主要原因是
A.铝不易发生化学反应 B.铝的氧化物易发生还原反应
C.铝不易氧化 D.铝易氧化,但铝表面的氧化铝具有保护内部的作用
10.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
11.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是( )
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作汽车、飞机和火箭的材料
D.铅锑合金的熔点较低、电阻率较大,常用于制成发热体
12.用置换反应验证铁的金属活动性比铜强,下列各组药品能达到目的的是
A.Ag、FeSO4、CuSO4 B.Fe、Cu、H2SO4
C.Fe、Cu、ZnSO4 D.Fe、Cu、KOH
13.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
14.将X、Z两种金属分别放入Y(NO3)2的溶液中,仅X的表面有Y单质析出,则X、Y、Z三种金属的活动性顺序是
A.Z>X>Y B.Y>Z>X C.X>Y>Z D.Y>X>Z
15.下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的是
选项 金属 盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
A.A B.B C.C D.D
16.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
二、综合应用题
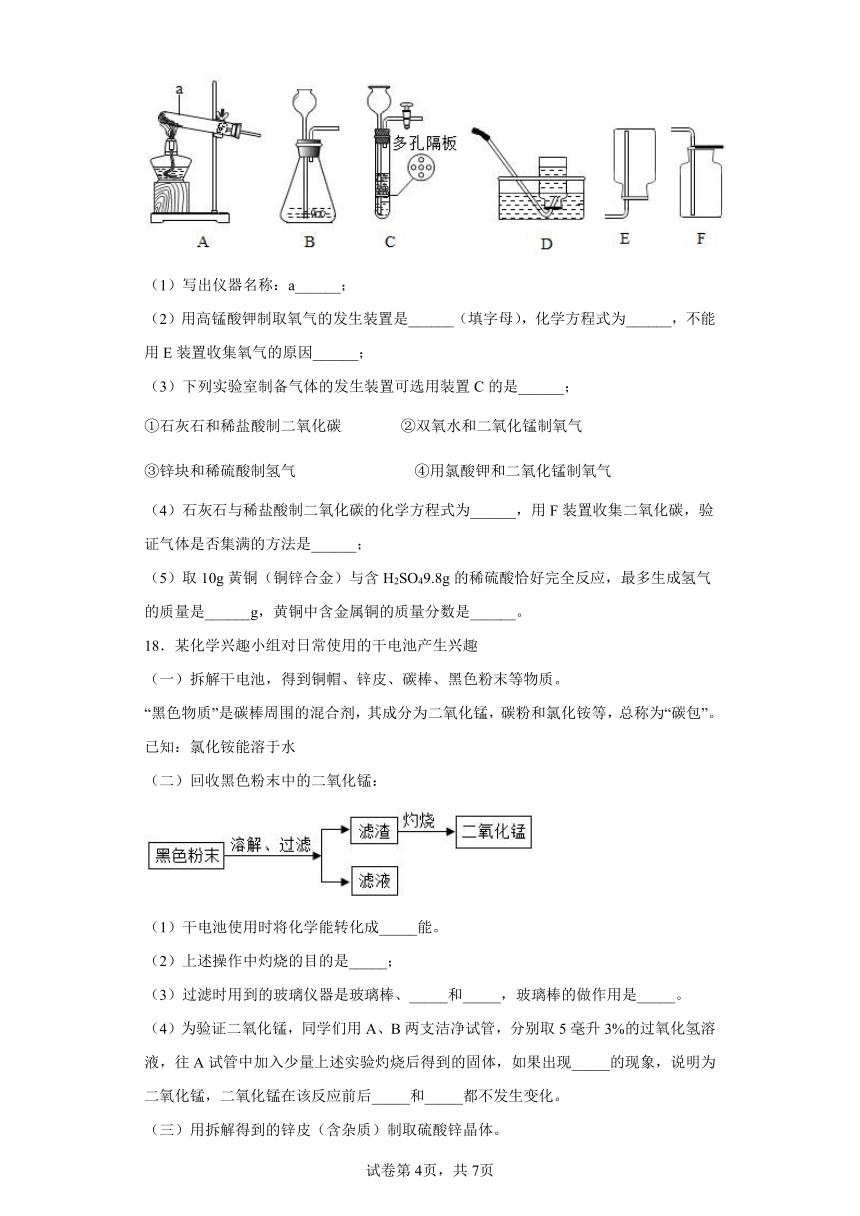
17.实验室利用如图1所示装置进行相关实验,根据要求回答问。
(1)写出仪器名称:a______;
(2)用高锰酸钾制取氧气的发生装置是______(填字母),化学方程式为______,不能用E装置收集氧气的原因______;
(3)下列实验室制备气体的发生装置可选用装置C的是______;
①石灰石和稀盐酸制二氧化碳 ②双氧水和二氧化锰制氧气
③锌块和稀硫酸制氢气 ④用氯酸钾和二氧化锰制氧气
(4)石灰石与稀盐酸制二氧化碳的化学方程式为______,用F装置收集二氧化碳,验证气体是否集满的方法是______;
(5)取10g黃铜(铜锌合金)与含H2SO49.8g的稀硫酸恰好完全反应,最多生成氢气的质量是______g,黄铜中含金属铜的质量分数是______。
18.某化学兴趣小组对日常使用的干电池产生兴趣
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
“黑色物质”是碳棒周围的混合剂,其成分为二氧化锰,碳粉和氯化铵等,总称为“碳包”。
已知:氯化铵能溶于水
(二)回收黑色粉末中的二氧化锰:
(1)干电池使用时将化学能转化成_____能。
(2)上述操作中灼烧的目的是_____;
(3)过滤时用到的玻璃仪器是玻璃棒、_____和_____,玻璃棒的做作用是_____。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现_____的现象,说明为二氧化锰,二氧化锰在该反应前后_____和_____都不发生变化。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。最终得到ZnSO4﹒7H2O晶体。
(5)步骤①中反应方程式为_____,将锌皮剪碎的目的是_____。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器內50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为273毫升。已知实验条件下氢气的密度为0.09g/L。
(6)计算该锌皮中锌的质量分数_____。(写出计算过程)
(7)上述方法测得的锌的质量分数偏大,不可能的原因是_____。
A 没等装置冷却就读数
B 锌皮中含有少量铁
C 试管中有气体没有排出
D 将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
19.金属用途广泛,其结构和性质都是化学的重要研究内容。
(1)生铁和钢都是铁的合金,但是性能上有很大的差异,这是因为___________,钢铁制品在生活中用途广泛,但却易生锈,写出一种防止铁锅生锈的做法___________。
(2)氢气作燃料的优点是___________。
(3)为了探究X、Y、Z三种固体金属的活动性,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化,将X和Z浸入硝酸银溶液中X表面有银析出而Z无变化。根据以上事实回答:
①X、Y、Z三种金属的活动性由强到弱的顺序为___________。(填序号)
A.X、Y、Z B.Y、X、Z C.Z、X、Y D.X、Z、Y
②具体确定一种X后,写出X和AgNO3溶液反应的化学方程式:___________。
(4)钠元素在元素周期表中位于第三周期的___________(填“最左边”、“中间”或“最右边”)。如右图是钠的原子结构示意图。下列说法不正确的是___________。
A 钠属于金属元素 B.钠原子的质子数为11
C.钠离子的符号为Na1+ D.钠在化学反应中失去电子
(5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温条件下用铝将金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?___________【化学方程式为: 】
20.化学在日常生产、生活中具有广泛的用途。
(1)水是宝贵的自然资源。
①图1是电解水的实验装置示意图:_______(填“a”或“b”)中的气体能使燃着的木条燃烧更旺。
②将静置后的河水采用图2装置进行过滤,请问:图中还缺少的一种仪器是_______。
③为除去水中的异味和色素,可以利用_______(填“物质名称”)的吸附作用而达到目的;工业上降低水的硬度,并得到纯水的方法是_______。
(2)金属材料用途广泛。请回答:
①嫦娥五号的返回舱被贴满了“暖宝宝”,“暖宝宝”中的发热剂(主要成分是铁粉、锌粉等)需接触到空气才会发热,原因是铁与 _______物质共同作用才会生锈。
②要验证铁、铜、银的金属活动性顺序,除铁丝、银丝外还需要用到的一种试剂是 _______。
③将锌粉放入含Ca(NO3)2、Cu(NO3)2的混合溶液中,搅拌,充分反应后,过滤。
i若滤液呈蓝色,则滤液中的金属阳离子是_______;
ii若锌粉过量,将滤渣洗涤、干燥、称量,得到20g固体混合物,与足量的稀硫酸反应,可制得氢气0.4g,则此混合物中铜的质量分数是_______。
21.实验室通常用锌粒与稀硫酸(溶质为H2SO4)反应制取氢气,同时生成硫酸锌(ZnSO4),如图是某同学在实验室做的一个趣味实验,锥形瓶内有溶质质量分数为10%的稀硫酸98g,气球内盛有足量锌粒,将锌粒倒入稀硫酸中,至不反应为止。回答下列问题:
(1)实验过程中看到的现象为______________________________(答一条即可)
(2)该装置反应前后的总质量___________(填“改变”或“不变”之一)
(3)若产生的氢气全部逸出,该反应是否遵循质量守恒定律_______(填“是”或“否”)。
(4)求产生氢气的质量___________(写出必要的计算过程)
22.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.A
5.B
6.B
7.D
8.A
9.D
10.A
11.D
12.B
13.D
14.C
15.C
16.C
17. 试管 A 氧气的密度比空气小,会聚集在空气的下方,用E装置收集氧气,氧气易从瓶口逸出 ①③ 将燃着的木条放在集气瓶口,若木条熄灭,则证明二氧化碳已收集满 0.2 35%
18. 电 除去滤渣中的碳粉 烧杯 漏斗 引流 冒气泡 质量 化学性质 增大接触面积,加快反应速率 解:装置中排出水的体积就是生成气体和注入稀硫酸体积的和,故生成氢气体积为273毫升-50毫升=223毫升=0.223升;生成氢气质量为0.09g/L×0.223L=0.02007g
设需要锌的质量为x
答:锌皮中锌的质量分数为0.6523%。 CD
19.(1) 含碳量不同 洁净干燥(合理即可)
(2)燃烧热值高,产物无污染
(3) B
(4) 最左边 C
(5)10.8kg
20.(1) b 玻璃棒 活性炭 蒸馏
(2) 氧气和水蒸气 硫酸铜溶液 Ca2+、Zn2+、Cu2+ 35%
21.(1)产生气泡(气体)或锌粒减少或气球变大等(2)不变(3)是(4)0.2g
22. Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将一定量的锌粉加入到硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则下列叙述正确的是
①滤渣中一定含有锌
②滤渣中一定含有铜,可能含有锌
③向滤渣中加入稀盐酸,最后溶液一定变成浅绿色
④滤液中溶质一定含有硫酸锌和硫酸镁
⑤滤液的颜色不可能为浅绿色
A.①④⑤ B.②③④⑤ C.②③④ D.②④
2.有甲、乙、丙三种金属,如果将甲、乙、丙分别投入到CuSO4溶液中,一段时间后,甲、丙表面出现红色物质,乙没有明显现象;再将大小相同的甲、丙分别放到相同的盐酸中,甲、丙均产生气泡,但甲产生气泡的速度明显快于丙,则甲、乙、丙三种金属的活动性顺序是
A.甲>丙>乙 B.丙>乙>甲 C.甲>乙>丙 D.丙>甲>乙
3.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 杂质 所用试剂和操作方法
A H2O NaCl 向水中加入活性炭吸附
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入足量的铁粉,充分搅拌后过滤
D CuO 木炭 隔绝空气加热至固体质量不再发生变化
A.A B.B C.C D.D
4.有X、Y、Z三种金属,把Y投入X(NO3)2溶液中,Y表面有X析出,溶液质量增大:把X投入Z(NO3)2溶液中,得到X(NO3)2,溶液质量减小。下列判断错误的是( )
A.X、Y、Z可能依次是:Cu、Fe、Ag
B.元素的相对原子质量可能是:Z>Y>X
C.金属活动性顺序是:Y>X>Z
D.X、Y、Z可能依次是:Fe、Zn、Hg
5.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
6.将金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A.R>Cu B.R>Fe C.Zn>R D.R>Ag
7.学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu。为验证这一结论,下面实验设计合理的是
A.将Zn、Cu两金属片分别放入稀盐酸中
B.将Fe、Cu两金属片分别放入稀盐酸中
C.将Zn、Fe两金属片分别放入CuCl2溶液中
D.将Zn、Cu两金属片分别放入FeCl2溶液中
8.下列金属不能跟稀盐酸反应产生氢气的是( )
A.银 B.锡 C.铝 D.镁
9.收藏家收藏清末的铝器,至今保存完好,该艺术品不易锈损的主要原因是
A.铝不易发生化学反应 B.铝的氧化物易发生还原反应
C.铝不易氧化 D.铝易氧化,但铝表面的氧化铝具有保护内部的作用
10.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
11.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是( )
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作汽车、飞机和火箭的材料
D.铅锑合金的熔点较低、电阻率较大,常用于制成发热体
12.用置换反应验证铁的金属活动性比铜强,下列各组药品能达到目的的是
A.Ag、FeSO4、CuSO4 B.Fe、Cu、H2SO4
C.Fe、Cu、ZnSO4 D.Fe、Cu、KOH
13.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
14.将X、Z两种金属分别放入Y(NO3)2的溶液中,仅X的表面有Y单质析出,则X、Y、Z三种金属的活动性顺序是
A.Z>X>Y B.Y>Z>X C.X>Y>Z D.Y>X>Z
15.下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的是
选项 金属 盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
A.A B.B C.C D.D
16.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
二、综合应用题
17.实验室利用如图1所示装置进行相关实验,根据要求回答问。
(1)写出仪器名称:a______;
(2)用高锰酸钾制取氧气的发生装置是______(填字母),化学方程式为______,不能用E装置收集氧气的原因______;
(3)下列实验室制备气体的发生装置可选用装置C的是______;
①石灰石和稀盐酸制二氧化碳 ②双氧水和二氧化锰制氧气
③锌块和稀硫酸制氢气 ④用氯酸钾和二氧化锰制氧气
(4)石灰石与稀盐酸制二氧化碳的化学方程式为______,用F装置收集二氧化碳,验证气体是否集满的方法是______;
(5)取10g黃铜(铜锌合金)与含H2SO49.8g的稀硫酸恰好完全反应,最多生成氢气的质量是______g,黄铜中含金属铜的质量分数是______。
18.某化学兴趣小组对日常使用的干电池产生兴趣
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
“黑色物质”是碳棒周围的混合剂,其成分为二氧化锰,碳粉和氯化铵等,总称为“碳包”。
已知:氯化铵能溶于水
(二)回收黑色粉末中的二氧化锰:
(1)干电池使用时将化学能转化成_____能。
(2)上述操作中灼烧的目的是_____;
(3)过滤时用到的玻璃仪器是玻璃棒、_____和_____,玻璃棒的做作用是_____。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现_____的现象,说明为二氧化锰,二氧化锰在该反应前后_____和_____都不发生变化。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。最终得到ZnSO4﹒7H2O晶体。
(5)步骤①中反应方程式为_____,将锌皮剪碎的目的是_____。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器內50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为273毫升。已知实验条件下氢气的密度为0.09g/L。
(6)计算该锌皮中锌的质量分数_____。(写出计算过程)
(7)上述方法测得的锌的质量分数偏大,不可能的原因是_____。
A 没等装置冷却就读数
B 锌皮中含有少量铁
C 试管中有气体没有排出
D 将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
19.金属用途广泛,其结构和性质都是化学的重要研究内容。
(1)生铁和钢都是铁的合金,但是性能上有很大的差异,这是因为___________,钢铁制品在生活中用途广泛,但却易生锈,写出一种防止铁锅生锈的做法___________。
(2)氢气作燃料的优点是___________。
(3)为了探究X、Y、Z三种固体金属的活动性,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化,将X和Z浸入硝酸银溶液中X表面有银析出而Z无变化。根据以上事实回答:
①X、Y、Z三种金属的活动性由强到弱的顺序为___________。(填序号)
A.X、Y、Z B.Y、X、Z C.Z、X、Y D.X、Z、Y
②具体确定一种X后,写出X和AgNO3溶液反应的化学方程式:___________。
(4)钠元素在元素周期表中位于第三周期的___________(填“最左边”、“中间”或“最右边”)。如右图是钠的原子结构示意图。下列说法不正确的是___________。
A 钠属于金属元素 B.钠原子的质子数为11
C.钠离子的符号为Na1+ D.钠在化学反应中失去电子
(5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温条件下用铝将金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?___________【化学方程式为: 】
20.化学在日常生产、生活中具有广泛的用途。
(1)水是宝贵的自然资源。
①图1是电解水的实验装置示意图:_______(填“a”或“b”)中的气体能使燃着的木条燃烧更旺。
②将静置后的河水采用图2装置进行过滤,请问:图中还缺少的一种仪器是_______。
③为除去水中的异味和色素,可以利用_______(填“物质名称”)的吸附作用而达到目的;工业上降低水的硬度,并得到纯水的方法是_______。
(2)金属材料用途广泛。请回答:
①嫦娥五号的返回舱被贴满了“暖宝宝”,“暖宝宝”中的发热剂(主要成分是铁粉、锌粉等)需接触到空气才会发热,原因是铁与 _______物质共同作用才会生锈。
②要验证铁、铜、银的金属活动性顺序,除铁丝、银丝外还需要用到的一种试剂是 _______。
③将锌粉放入含Ca(NO3)2、Cu(NO3)2的混合溶液中,搅拌,充分反应后,过滤。
i若滤液呈蓝色,则滤液中的金属阳离子是_______;
ii若锌粉过量,将滤渣洗涤、干燥、称量,得到20g固体混合物,与足量的稀硫酸反应,可制得氢气0.4g,则此混合物中铜的质量分数是_______。
21.实验室通常用锌粒与稀硫酸(溶质为H2SO4)反应制取氢气,同时生成硫酸锌(ZnSO4),如图是某同学在实验室做的一个趣味实验,锥形瓶内有溶质质量分数为10%的稀硫酸98g,气球内盛有足量锌粒,将锌粒倒入稀硫酸中,至不反应为止。回答下列问题:
(1)实验过程中看到的现象为______________________________(答一条即可)
(2)该装置反应前后的总质量___________(填“改变”或“不变”之一)
(3)若产生的氢气全部逸出,该反应是否遵循质量守恒定律_______(填“是”或“否”)。
(4)求产生氢气的质量___________(写出必要的计算过程)
22.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.A
5.B
6.B
7.D
8.A
9.D
10.A
11.D
12.B
13.D
14.C
15.C
16.C
17. 试管 A 氧气的密度比空气小,会聚集在空气的下方,用E装置收集氧气,氧气易从瓶口逸出 ①③ 将燃着的木条放在集气瓶口,若木条熄灭,则证明二氧化碳已收集满 0.2 35%
18. 电 除去滤渣中的碳粉 烧杯 漏斗 引流 冒气泡 质量 化学性质 增大接触面积,加快反应速率 解:装置中排出水的体积就是生成气体和注入稀硫酸体积的和,故生成氢气体积为273毫升-50毫升=223毫升=0.223升;生成氢气质量为0.09g/L×0.223L=0.02007g
设需要锌的质量为x
答:锌皮中锌的质量分数为0.6523%。 CD
19.(1) 含碳量不同 洁净干燥(合理即可)
(2)燃烧热值高,产物无污染
(3) B
(4) 最左边 C
(5)10.8kg
20.(1) b 玻璃棒 活性炭 蒸馏
(2) 氧气和水蒸气 硫酸铜溶液 Ca2+、Zn2+、Cu2+ 35%
21.(1)产生气泡(气体)或锌粒减少或气球变大等(2)不变(3)是(4)0.2g
22. Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
答案第1页,共2页
答案第1页,共2页
同课章节目录
