第12章 盐 练习题(含答案)---2021-2022学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第12章 盐 练习题(含答案)---2021-2022学年九年级化学京改版(2013)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 128.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览



文档简介
第12章盐练习题2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列有关物质的化学式、名称、俗名不完全对应的是
A.NaOH 氢氧化钠 烧碱 B.CaO 氢氧化钙 生石灰
C.Na2CO3 碳酸钠 纯碱 D.NaCl 氯化钠 食盐
2.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
3.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
4.星期天,小明同学回家发现自家田里的小麦出现大面积倒伏现象,就向其父母提出了一条合理化建议:明年应在小麦生长期增施抗倒伏的化肥,你认为增施的化肥是
A.NH4NO3 B.KCl C.Ca(H2PO4)2 D.CO(NH2)2
5.物质的性质决定物质的用途。下列物质的性质与应用对应关系不正确的
A.常温下N2化学性质稳定,可用于人工固氮和制作霓虹灯
B.镁燃烧发出耀眼的白光,可用于制照明弹
C.小苏打能与酸反应,可用作治疗胃酸过多的试剂
D.生石灰具有吸水性,可用作“旺旺雪饼”中的干燥剂
6.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.硝酸钾和氯化铁
B.氢氧化钾和盐酸
C.硫酸铜和氢氧化钠
D.硫酸钠和氯化钡
7.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
8.在氯化钡溶液中滴入某种液体,生成白色沉淀。有关说法错误的是
A.滴入的可能是硝酸银溶液
B.反应后溶液可能呈酸性
C.白色沉淀可能溶于盐酸
D.该反应可能是中和反应
9.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
10.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
11.下列关于碳酸钙的说法错误的是
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
12.下列各组离子在pH=1的溶液中能大量共存,并形成无色透明溶液的是
A.Fe3+、NO3﹣、OH﹣ B.K+、NO3﹣、CO32﹣
C.Ba2+、MnO4﹣、SO42﹣ D.NH4+、Cl﹣、SO42﹣
二、简答题
13.碘化钾(KI)是白色固体,保存不当会被氧化为碘单质(I2)而泛黄变质。取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
(1)澄清石灰水变浑浊的化学方程式是_____。
(2)碘化钾变质的化学方程式是_____。
14.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
15.现有两瓶失去标签的溶液,溶质分别可能是硝酸钠、硝酸铜、硝酸、硫酸钠、硫酸、碳酸钾中的一种,检验步骤如下:
(1)分别取少量溶液混合,无明显现象,溶液无色透明,经测定混合溶液显酸性。由此可推断这两瓶溶液中的溶质一定不是________________________(填化学式,多填、少填、错填均不得分,下同);
(2)向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀。则这两瓶溶液中的溶质至少是_______________________中的一种。
试推断这两瓶溶液的溶质可能的组合有_________(填数字)种,请写出其中含阳离子种类最少的一种组合:____________________。
三、推断题
16.某工厂排出的废水中可能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba的金属活动性比Fe强。
(1)一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,沉淀的化学式为_______;过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,反应的化学方程式为_______;另一份滤液中加入过量氢氧化钠溶液,产生蓝色沉淀,由此步现象推出该溶液中不含_______(填化学式)。
(2)废水中一定含有的物质是_______(填序号)。
A 氯化物 B 硫酸盐 C 硝酸盐 D 碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下
①固体A中一定含有的物质为(写化学式)_______。步骤Ⅱ的操作是_______。
②B溶液中的溶质一定含有_______和_______(填序号)。
A K2CO3 B Fe(NO3)2 C MgCl2 D Ba(NO3)2 E Fe(NO3)3
17.现有一包固体粉末,可能是由NaOH、Na2SO4、Na2CO3、BaCl2中的一种或几种组成。为探究其成分,某化学小组设计并进行了如图所示的实验。(已知:BaCO3不溶于水,BaSO4不溶于水也不溶于酸)。
(1)固体粉末中一定含有的是______。
(2)为确定固体粉末中可能含有的物质,还需对溶液甲做进一步探究,请设计简单实验方案。(写出实验操作、现象及结论)______。
四、实验题
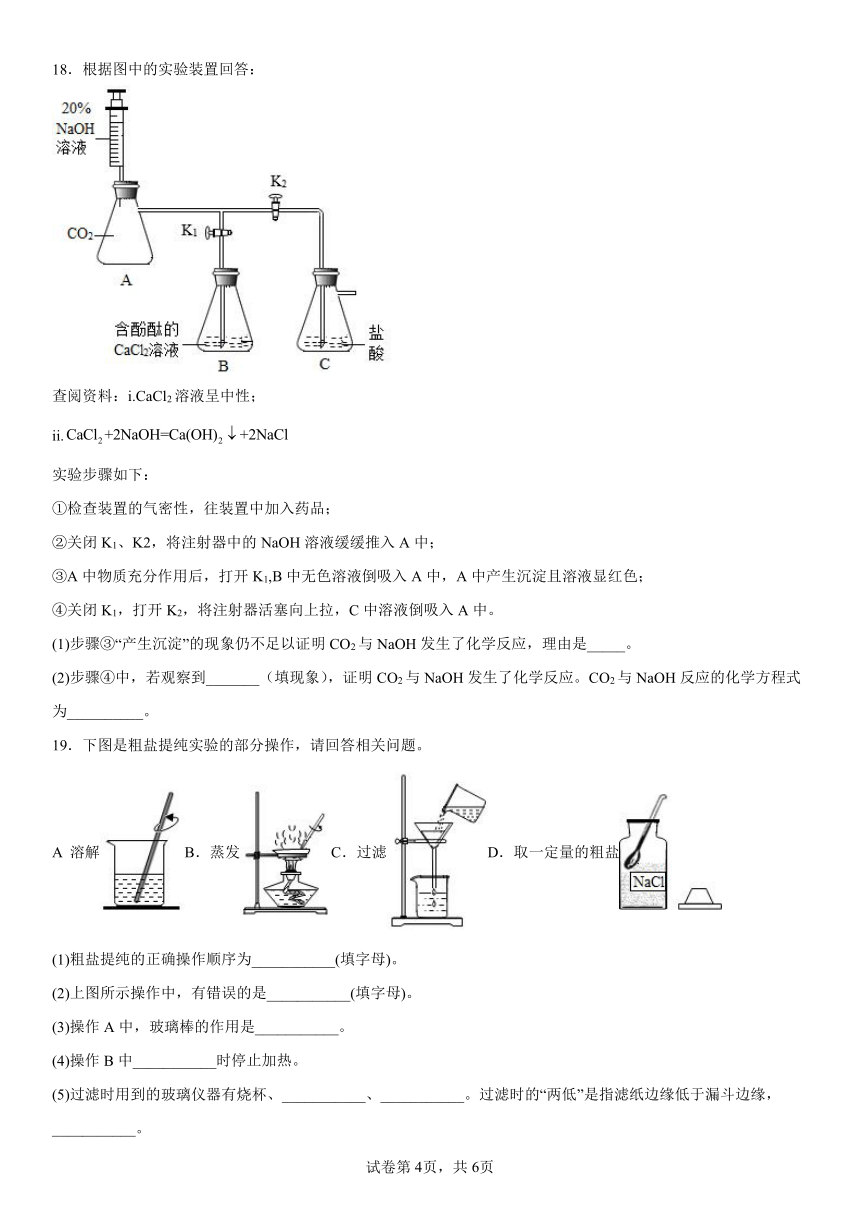
18.根据图中的实验装置回答:
查阅资料:i.CaCl2溶液呈中性;
ii.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(1)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是_____。
(2)步骤④中,若观察到_______(填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为__________。
19.下图是粗盐提纯实验的部分操作,请回答相关问题。
A 溶解B.蒸发C.过滤D.取一定量的粗盐
(1)粗盐提纯的正确操作顺序为___________(填字母)。
(2)上图所示操作中,有错误的是___________(填字母)。
(3)操作A中,玻璃棒的作用是___________。
(4)操作B中___________时停止加热。
(5)过滤时用到的玻璃仪器有烧杯、___________、___________。过滤时的“两低”是指滤纸边缘低于漏斗边缘,___________。
20.某兴趣小组用下列常用装置,完成氯酸钾和二氧化锰制取氧气的反应,并将反应后剩余的固体,通过实验回收提纯其中的氯化钾。请回答下列问题:
(1)仪器a名称________。
(2)②中玻璃棒的作用是_______。
(3)对反应后剩余固体中的氯化钾,选用合适的装置回收提纯,正确的顺序是_______。(填序号)
(4)用装置⑤收集氧气,验满的方法是_______。
五、计算题
21.化学与生产、生活息息相关。某农业产业基地的某无土栽培营养液中含有7.08%的KNO3。
(1)KNO3属于_______(填“氮肥”或“磷肥”或“钾肥”或“复合肥”);
(2)KNO3氮、氧元素的质量比为_______;
(3)KNO3中氮元素质量分数_______;
(4)_______kg的NH4NO3与202kgKNO3含有等量的氮元素。
22.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2Hac=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是___________。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是___________(选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数___________。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明___________。
23.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.B
5.A
6.B
7.C
8.D
9.B
10.D
11.B
12.D
13. Ca(OH)2+ CO2 =CaCO3↓ + H2O 4KI+2CO2+O2=2K2CO3+2I2
14. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
15. Cu(NO3)2、K2CO3 Na2SO4、H2SO4 4 H2SO4、HNO3
16. AgCl Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 FeCl2、Na2SO4 C Fe、Ag和Cu 过滤 B D
17. Na2CO3、BaCl2 取样品,加足量的CaCl2溶液(或Ca(NO3)2溶液等),充分反应后,取上层清液,滴加无色酚酞溶液,若溶液变红,证明含有NaOH;若溶液不变红,证明不含有NaOH。
18.(1)氢氧化钠与氯化钙反应也能生成沉淀
(2) 产生气泡
19.(1)DACB
(2)C
(3)加速溶解
(4)大量固体
(5) 漏斗(或玻璃棒) 玻璃棒(或漏斗) 液面低于滤纸边缘
20.(1)漏斗
(2)引流
(3)③②④
(4)把带火星的木条伸到b端管口,木条复燃则已满
21.(1)复合肥
(2)7:24
(3)13.9%
(4)80
22. 吸收二氧化碳携带的水蒸气,防止实验结果不准确 变小 生成二氧化碳的质量为:820g﹣819.89=0.11g
解:设鱼骨中碳酸钙的质量分数为x
x=1.25%
答:鱼骨中碳酸钙的质量分数为1.25% 要使鱼骨中的碳酸钙完全反应需要的时间太长
23.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关物质的化学式、名称、俗名不完全对应的是
A.NaOH 氢氧化钠 烧碱 B.CaO 氢氧化钙 生石灰
C.Na2CO3 碳酸钠 纯碱 D.NaCl 氯化钠 食盐
2.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
3.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
4.星期天,小明同学回家发现自家田里的小麦出现大面积倒伏现象,就向其父母提出了一条合理化建议:明年应在小麦生长期增施抗倒伏的化肥,你认为增施的化肥是
A.NH4NO3 B.KCl C.Ca(H2PO4)2 D.CO(NH2)2
5.物质的性质决定物质的用途。下列物质的性质与应用对应关系不正确的
A.常温下N2化学性质稳定,可用于人工固氮和制作霓虹灯
B.镁燃烧发出耀眼的白光,可用于制照明弹
C.小苏打能与酸反应,可用作治疗胃酸过多的试剂
D.生石灰具有吸水性,可用作“旺旺雪饼”中的干燥剂
6.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.硝酸钾和氯化铁
B.氢氧化钾和盐酸
C.硫酸铜和氢氧化钠
D.硫酸钠和氯化钡
7.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
8.在氯化钡溶液中滴入某种液体,生成白色沉淀。有关说法错误的是
A.滴入的可能是硝酸银溶液
B.反应后溶液可能呈酸性
C.白色沉淀可能溶于盐酸
D.该反应可能是中和反应
9.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
10.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式是La2O3,La(OH)3是不溶于水的碱,LaCl3、La(NO3)3都可溶于水。由此推断下列几组物质组合,不能直接反应制取LaCl3的是
A.La和稀盐酸 B.La2O3和稀盐酸
C.La(OH)3和稀盐酸 D.La(OH)3和氯化钾溶液
11.下列关于碳酸钙的说法错误的是
A.大理石的主要成分是碳酸钙
B.实验室常用碳酸钙与稀硫酸反应制取CO2
C.碳酸钙可用作补钙剂
D.石灰浆粉刷墙壁,“出汗”后变成碳酸钙
12.下列各组离子在pH=1的溶液中能大量共存,并形成无色透明溶液的是
A.Fe3+、NO3﹣、OH﹣ B.K+、NO3﹣、CO32﹣
C.Ba2+、MnO4﹣、SO42﹣ D.NH4+、Cl﹣、SO42﹣
二、简答题
13.碘化钾(KI)是白色固体,保存不当会被氧化为碘单质(I2)而泛黄变质。取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊。
(1)澄清石灰水变浑浊的化学方程式是_____。
(2)碘化钾变质的化学方程式是_____。
14.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
15.现有两瓶失去标签的溶液,溶质分别可能是硝酸钠、硝酸铜、硝酸、硫酸钠、硫酸、碳酸钾中的一种,检验步骤如下:
(1)分别取少量溶液混合,无明显现象,溶液无色透明,经测定混合溶液显酸性。由此可推断这两瓶溶液中的溶质一定不是________________________(填化学式,多填、少填、错填均不得分,下同);
(2)向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀。则这两瓶溶液中的溶质至少是_______________________中的一种。
试推断这两瓶溶液的溶质可能的组合有_________(填数字)种,请写出其中含阳离子种类最少的一种组合:____________________。
三、推断题
16.某工厂排出的废水中可能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba的金属活动性比Fe强。
(1)一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,沉淀的化学式为_______;过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,反应的化学方程式为_______;另一份滤液中加入过量氢氧化钠溶液,产生蓝色沉淀,由此步现象推出该溶液中不含_______(填化学式)。
(2)废水中一定含有的物质是_______(填序号)。
A 氯化物 B 硫酸盐 C 硝酸盐 D 碳酸盐
(3)该同学设计了一个从废水中除去重金属离子的实验方案如下
①固体A中一定含有的物质为(写化学式)_______。步骤Ⅱ的操作是_______。
②B溶液中的溶质一定含有_______和_______(填序号)。
A K2CO3 B Fe(NO3)2 C MgCl2 D Ba(NO3)2 E Fe(NO3)3
17.现有一包固体粉末,可能是由NaOH、Na2SO4、Na2CO3、BaCl2中的一种或几种组成。为探究其成分,某化学小组设计并进行了如图所示的实验。(已知:BaCO3不溶于水,BaSO4不溶于水也不溶于酸)。
(1)固体粉末中一定含有的是______。
(2)为确定固体粉末中可能含有的物质,还需对溶液甲做进一步探究,请设计简单实验方案。(写出实验操作、现象及结论)______。
四、实验题
18.根据图中的实验装置回答:
查阅资料:i.CaCl2溶液呈中性;
ii.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(1)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是_____。
(2)步骤④中,若观察到_______(填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为__________。
19.下图是粗盐提纯实验的部分操作,请回答相关问题。
A 溶解B.蒸发C.过滤D.取一定量的粗盐
(1)粗盐提纯的正确操作顺序为___________(填字母)。
(2)上图所示操作中,有错误的是___________(填字母)。
(3)操作A中,玻璃棒的作用是___________。
(4)操作B中___________时停止加热。
(5)过滤时用到的玻璃仪器有烧杯、___________、___________。过滤时的“两低”是指滤纸边缘低于漏斗边缘,___________。
20.某兴趣小组用下列常用装置,完成氯酸钾和二氧化锰制取氧气的反应,并将反应后剩余的固体,通过实验回收提纯其中的氯化钾。请回答下列问题:
(1)仪器a名称________。
(2)②中玻璃棒的作用是_______。
(3)对反应后剩余固体中的氯化钾,选用合适的装置回收提纯,正确的顺序是_______。(填序号)
(4)用装置⑤收集氧气,验满的方法是_______。
五、计算题
21.化学与生产、生活息息相关。某农业产业基地的某无土栽培营养液中含有7.08%的KNO3。
(1)KNO3属于_______(填“氮肥”或“磷肥”或“钾肥”或“复合肥”);
(2)KNO3氮、氧元素的质量比为_______;
(3)KNO3中氮元素质量分数_______;
(4)_______kg的NH4NO3与202kgKNO3含有等量的氮元素。
22.钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。
提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2Hac=CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是___________。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是___________(选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数___________。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明___________。
23.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.B
5.A
6.B
7.C
8.D
9.B
10.D
11.B
12.D
13. Ca(OH)2+ CO2 =CaCO3↓ + H2O 4KI+2CO2+O2=2K2CO3+2I2
14. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
15. Cu(NO3)2、K2CO3 Na2SO4、H2SO4 4 H2SO4、HNO3
16. AgCl Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 FeCl2、Na2SO4 C Fe、Ag和Cu 过滤 B D
17. Na2CO3、BaCl2 取样品,加足量的CaCl2溶液(或Ca(NO3)2溶液等),充分反应后,取上层清液,滴加无色酚酞溶液,若溶液变红,证明含有NaOH;若溶液不变红,证明不含有NaOH。
18.(1)氢氧化钠与氯化钙反应也能生成沉淀
(2) 产生气泡
19.(1)DACB
(2)C
(3)加速溶解
(4)大量固体
(5) 漏斗(或玻璃棒) 玻璃棒(或漏斗) 液面低于滤纸边缘
20.(1)漏斗
(2)引流
(3)③②④
(4)把带火星的木条伸到b端管口,木条复燃则已满
21.(1)复合肥
(2)7:24
(3)13.9%
(4)80
22. 吸收二氧化碳携带的水蒸气,防止实验结果不准确 变小 生成二氧化碳的质量为:820g﹣819.89=0.11g
解:设鱼骨中碳酸钙的质量分数为x
x=1.25%
答:鱼骨中碳酸钙的质量分数为1.25% 要使鱼骨中的碳酸钙完全反应需要的时间太长
23.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
答案第1页,共2页
答案第1页,共2页
