实验活动六酸、碱的化学性质课件-2021-2022学年九年级化学人教版下册(共28张PPT)
文档属性
| 名称 | 实验活动六酸、碱的化学性质课件-2021-2022学年九年级化学人教版下册(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 21:37:06 | ||
图片预览






文档简介
(共28张PPT)
酸、碱的化学性质
实验活动六
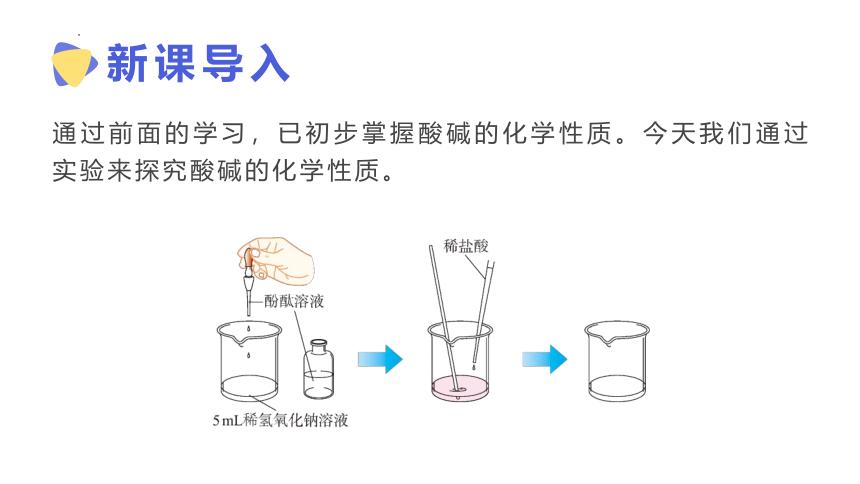
新课导入
通过前面的学习,已初步掌握酸碱的化学性质。今天我们通过实验来探究酸碱的化学性质。
1
加深对酸和碱的主要性质的认识
2
通过实验解释生活中的一些现象
实验仪器
试管
酒精灯
蒸发皿
玻璃棒
铁架台
坩埚钳
药匙
胶头滴管
火柴
实验药品
稀盐酸
稀硫酸
氢氧化钠
氢氧化钙
实验过程中酸、碱的浓度不宜过大。酸和碱有腐蚀性,实验时应注意安全!
注意
实验药品
氢氧化钙
硫酸铜
紫色石蕊溶液
酚酞溶液
pH试纸
生锈的铁钉
注意
滴加指示剂的量不要过太多,一般1~2滴即可
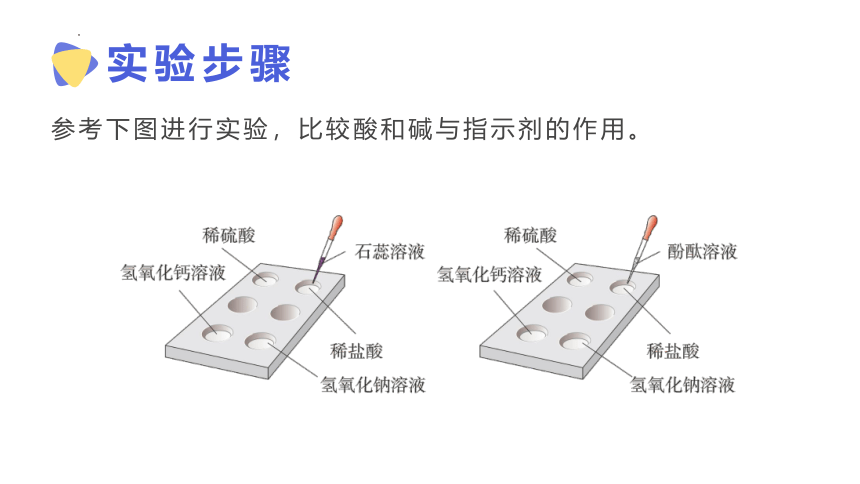
酸、碱与指示剂的作用
1
实验步骤
参考下图进行实验,比较酸和碱与指示剂的作用。
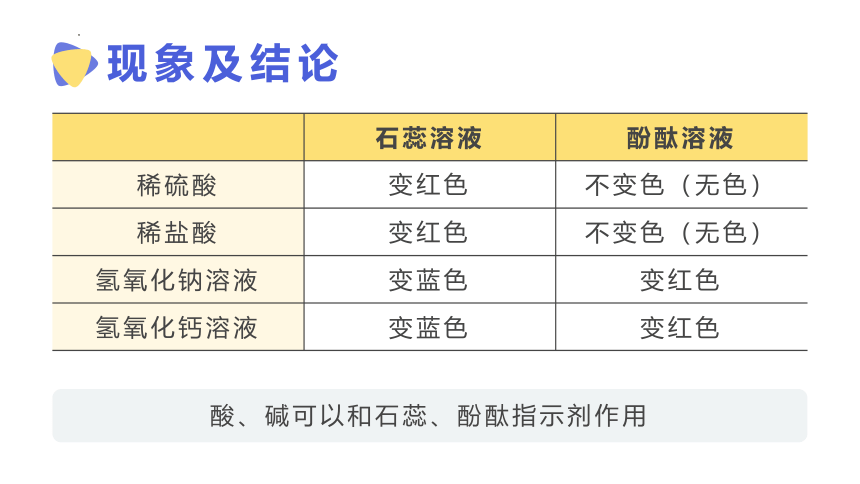
现象及结论
石蕊溶液 酚酞溶液
稀硫酸
稀盐酸
氢氧化钠溶液
氢氧化钙溶液
变红色
不变色(无色)
变红色
不变色(无色)
变蓝色
变红色
变蓝色
变红色
酸、碱可以和石蕊、酚酞指示剂作用
铁锈、铁钉和稀盐酸的反应
2
实验步骤
比较两支试管中铁钉,实验现象有什么不同?
现象及结论
铁锈、铁钉和稀盐酸的反应
实验现象
解释
第一支试管中铁锈消失,溶液由无色变成黄色。第二支试管中有气泡产生
酸能与金属氧化物、活泼金属发生反应
思考
1
2
3
将铁钉放入试管时应如何操作?
“一斜”“二送”“三直立”
硫酸铜和氢氧化钠的反应
3
实验步骤
滴加氢氧化钠后观察现象,再滴加稀盐酸再次观察现象。
现象及结论
向盛有CuSO4 溶液的试管中加入几滴NaOH 溶液 铁锈、铁钉和稀盐酸的反应
实验现象
结论
再向上述试管中加入稀盐酸 铁锈、铁钉和稀盐酸的反应
实验现象
结论
有蓝色沉淀生成
蓝色沉淀溶解,得到蓝色溶液
氢氧化钠和稀盐酸的反应
4
实验步骤
参考下图进行实验,仔细观察现象。
现象及结论
氢氧化钠和稀盐酸的反应 铁锈、铁钉和稀盐酸的反应
实验现象
解释
溶液由无色变成红色,滴加稀盐酸后再由红色变成无色,混合溶液在蒸发皿蒸发后,出现白色固体
酸能与碱发生反应,生成盐和水
氢氧化钙的性质探究
5
实验步骤
参考下图进行实验,仔细观察现象。
实验步骤
参考下图进行实验,仔细观察现象。
现象及结论
氢氧化钙的性质探究 铁锈、铁钉和稀盐酸的反应
实验现象
解释
固体部分溶解,滴加酚酞溶液后,溶液由无色变为红色。加入盐酸后,固体全部溶解,溶液由红色变为无色。
酸能与碱发生反应,生成盐和水
问题与交流
化学实验室中有两瓶失去标签的无色溶液,已知其中一瓶是盐酸,另一瓶是氢氧化钠溶液,你能用哪些化学方法把它们鉴别开来?
根据盐酸与氢氧化钠化学性质的不同点设计出实验方案。例如:①用酸碱指示剂 ②用pH 试纸 ③盐酸能与碳酸钙反应产生二氧化碳气体,氢氧化钠能与硫酸铜溶液反应产生蓝色沉淀
1.酸和碱都能与酸碱指示剂反应
2.酸能与多种活泼金属反应,生成盐和氢气
3.酸能与某些金属氧化物反应,生成盐和水
4.碱能与某些非金属氧化物反应,生成盐和水
5.酸与碱能发生中和反应,生成盐和水
1.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之处。
(1)它们水溶液的pH都 (填“>”“<”或“=”)7。
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式: 。
<
1.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之处。
(3)它们都能与碱反应生成盐和水,该类反应是 反应。
(4)打开分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是 。
中和
浓盐酸
酸、碱的化学性质
实验活动六
新课导入
通过前面的学习,已初步掌握酸碱的化学性质。今天我们通过实验来探究酸碱的化学性质。
1
加深对酸和碱的主要性质的认识
2
通过实验解释生活中的一些现象
实验仪器
试管
酒精灯
蒸发皿
玻璃棒
铁架台
坩埚钳
药匙
胶头滴管
火柴
实验药品
稀盐酸
稀硫酸
氢氧化钠
氢氧化钙
实验过程中酸、碱的浓度不宜过大。酸和碱有腐蚀性,实验时应注意安全!
注意
实验药品
氢氧化钙
硫酸铜
紫色石蕊溶液
酚酞溶液
pH试纸
生锈的铁钉
注意
滴加指示剂的量不要过太多,一般1~2滴即可
酸、碱与指示剂的作用
1
实验步骤
参考下图进行实验,比较酸和碱与指示剂的作用。
现象及结论
石蕊溶液 酚酞溶液
稀硫酸
稀盐酸
氢氧化钠溶液
氢氧化钙溶液
变红色
不变色(无色)
变红色
不变色(无色)
变蓝色
变红色
变蓝色
变红色
酸、碱可以和石蕊、酚酞指示剂作用
铁锈、铁钉和稀盐酸的反应
2
实验步骤
比较两支试管中铁钉,实验现象有什么不同?
现象及结论
铁锈、铁钉和稀盐酸的反应
实验现象
解释
第一支试管中铁锈消失,溶液由无色变成黄色。第二支试管中有气泡产生
酸能与金属氧化物、活泼金属发生反应
思考
1
2
3
将铁钉放入试管时应如何操作?
“一斜”“二送”“三直立”
硫酸铜和氢氧化钠的反应
3
实验步骤
滴加氢氧化钠后观察现象,再滴加稀盐酸再次观察现象。
现象及结论
向盛有CuSO4 溶液的试管中加入几滴NaOH 溶液 铁锈、铁钉和稀盐酸的反应
实验现象
结论
再向上述试管中加入稀盐酸 铁锈、铁钉和稀盐酸的反应
实验现象
结论
有蓝色沉淀生成
蓝色沉淀溶解,得到蓝色溶液
氢氧化钠和稀盐酸的反应
4
实验步骤
参考下图进行实验,仔细观察现象。
现象及结论
氢氧化钠和稀盐酸的反应 铁锈、铁钉和稀盐酸的反应
实验现象
解释
溶液由无色变成红色,滴加稀盐酸后再由红色变成无色,混合溶液在蒸发皿蒸发后,出现白色固体
酸能与碱发生反应,生成盐和水
氢氧化钙的性质探究
5
实验步骤
参考下图进行实验,仔细观察现象。
实验步骤
参考下图进行实验,仔细观察现象。
现象及结论
氢氧化钙的性质探究 铁锈、铁钉和稀盐酸的反应
实验现象
解释
固体部分溶解,滴加酚酞溶液后,溶液由无色变为红色。加入盐酸后,固体全部溶解,溶液由红色变为无色。
酸能与碱发生反应,生成盐和水
问题与交流
化学实验室中有两瓶失去标签的无色溶液,已知其中一瓶是盐酸,另一瓶是氢氧化钠溶液,你能用哪些化学方法把它们鉴别开来?
根据盐酸与氢氧化钠化学性质的不同点设计出实验方案。例如:①用酸碱指示剂 ②用pH 试纸 ③盐酸能与碳酸钙反应产生二氧化碳气体,氢氧化钠能与硫酸铜溶液反应产生蓝色沉淀
1.酸和碱都能与酸碱指示剂反应
2.酸能与多种活泼金属反应,生成盐和氢气
3.酸能与某些金属氧化物反应,生成盐和水
4.碱能与某些非金属氧化物反应,生成盐和水
5.酸与碱能发生中和反应,生成盐和水
1.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之处。
(1)它们水溶液的pH都 (填“>”“<”或“=”)7。
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式: 。
<
1.硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之处。
(3)它们都能与碱反应生成盐和水,该类反应是 反应。
(4)打开分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是 。
中和
浓盐酸
同课章节目录
