第1章 第3节 第1课时 认识同周期元素性质的递变规律课件2021-2022学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章 第3节 第1课时 认识同周期元素性质的递变规律课件2021-2022学年下学期高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 00:00:00 | ||
图片预览










文档简介
(共45张PPT)
第3节 元素周期表的应用
第1课时 认识同周期元素性质的递变规律
课前自主学习
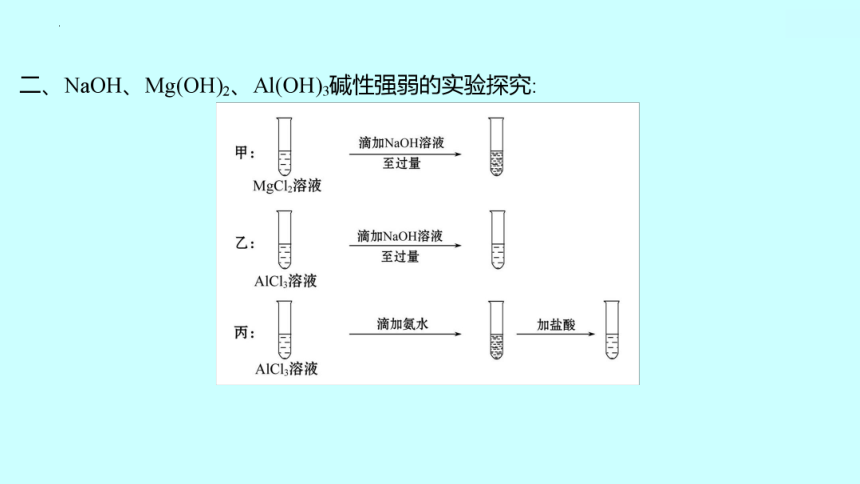
学习任务一 同周期金属元素失电子能力的比较
任务驱动:
钠、镁和铝都在第3周期,但是它们失电子能力是不同的,判断和评价金属
元素失电子能力强弱有哪些依据和标准?
1.元素原子失电子能力强弱的判断方法
(1)单质与水或酸_________________。越容易置换出氢,元素原子的失电子能力
越强。
(2)元素最高价氧化物对应水化物的_________。碱性越强,元素原子的失电子能
力越强。
置换氢的难易程度
碱性强弱
2.钠、镁、铝失电子能力强弱比较
Na Mg Al
单质与水或酸反应情况 与冷水___ _______ 难与_____反应,与_____缓慢反应 与水很难反应
与酸反应:Mg比Al容易 最高价氧化物对应水化物的碱性 _____ 中强碱 _____________
结论 失电子能力:___>___>___; 同周期元素,从左到右,单质与水或酸反应越来越___,最高价 氧化物对应水化物的碱性越来越___,失电子能力越来越___ 剧
烈反应
冷水
热水
强碱
两性氢氧化物
Na
Mg
Al
难
弱
弱
【想一想】结合同周期的Na、Mg、Al的性质递变规律,预测钾和钙的失电子能力强弱?单质的还原性强弱关系和最高价氧化物对应水化物的碱性强弱关系如何?
提示:K、Ca位于同一周期,从左往右,原子半径逐渐减小,失电子的能力逐渐减弱,还原性逐渐减弱,阳离子的氧化性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱,KOH>Ca(OH)2。
学习任务二 同周期非金属元素得
电子能力的比较
任务驱动:
磷、硫和氯都位于第3周期,它们得电子的能力不同,判断和评价非金属元
素得电子能力强弱有哪些依据和标准?
1.元素原子得电子能力的判断方法
(1)单质_____________________以及气态氢化物的稳定性。
(2)最高价氧化物对应的水化物___________。
与氢气化合的难易程度
酸性的强弱
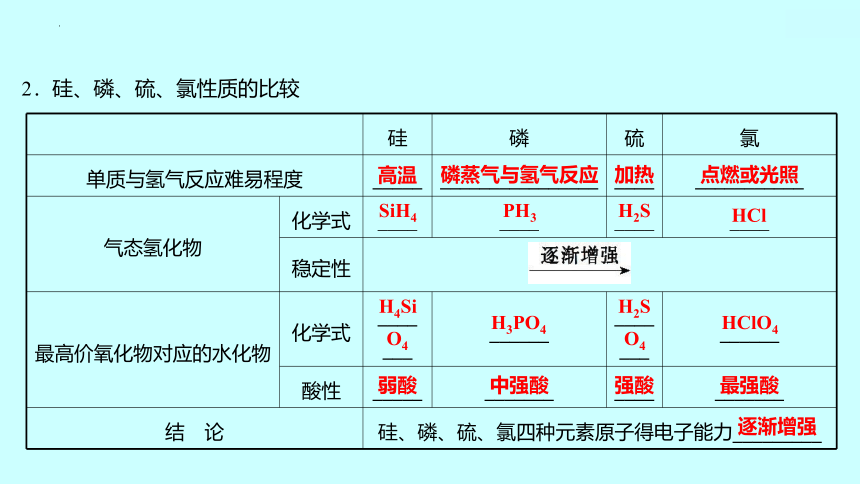
2.硅、磷、硫、氯性质的比较
硅 磷 硫 氯
单质与氢气反应难易程度 _____ ________________ ____ ___________
气态氢化物 化学式 ____ ____ ____ ____
稳定性 最高价氧化物对应的水化物 化学式 ____ ___ ______ ____ ___ ______
酸性 _____ _______ ____ _______
结 论 硅、磷、硫、氯四种元素原子得电子能力_________ 高温
磷蒸气与氢气反应
加热
点燃或光照
H4Si
O4
H3PO4
H2S
O4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
SiH4
PH3
H2S
HCl
【做一做】在原子序数1~18号元素中:
(1)与水反应最剧烈的金属是_______;
(2)与水反应最剧烈的非金属单质是______;
(3)在室温下有颜色的气体单质是___________;
(4)在空气中容易自燃的单质名称是_________;
(5)除稀有气体外,原子半径最大的元素是_______,它的原子结构示意图是_________;
(6)原子半径最小的元素是______;
(7)气态氢化物水溶液呈碱性的元素是______;
(8)气态氢化物最稳定的物质的化学式是______;
(9)最高价氧化物对应水化物的酸性最强的元素是_______。
Na
F2
Cl2,F2
白磷
Na
H
N
HF
Cl
课堂合作探究
项 目 同周期(从左到右,稀有气体除外)
最外层电子数 由1递增至7(第1周期除外)
主要化合价 最高正价:+1→+7(O、F除外)
负价:-4→-1
原子半径 逐渐减小
得失电子能力 失电子能力减弱,得电子能力增强
单质的氧化性、还原性 还原性减弱,氧化性增强
最高价氧化物对应水化物的酸碱性 碱性减弱,酸性增强
非金属的氢化物 形成由难到易,稳定性由弱到强
金属单质与水、酸反应 越来越难
同周期,从左到右,金属性逐渐减弱,非金属性逐渐增强 课堂素养达标
第3节 元素周期表的应用
第1课时 认识同周期元素性质的递变规律
课前自主学习
学习任务一 同周期金属元素失电子能力的比较
任务驱动:
钠、镁和铝都在第3周期,但是它们失电子能力是不同的,判断和评价金属
元素失电子能力强弱有哪些依据和标准?
1.元素原子失电子能力强弱的判断方法
(1)单质与水或酸_________________。越容易置换出氢,元素原子的失电子能力
越强。
(2)元素最高价氧化物对应水化物的_________。碱性越强,元素原子的失电子能
力越强。
置换氢的难易程度
碱性强弱
2.钠、镁、铝失电子能力强弱比较
Na Mg Al
单质与水或酸反应情况 与冷水___ _______ 难与_____反应,与_____缓慢反应 与水很难反应
与酸反应:Mg比Al容易 最高价氧化物对应水化物的碱性 _____ 中强碱 _____________
结论 失电子能力:___>___>___; 同周期元素,从左到右,单质与水或酸反应越来越___,最高价 氧化物对应水化物的碱性越来越___,失电子能力越来越___ 剧
烈反应
冷水
热水
强碱
两性氢氧化物
Na
Mg
Al
难
弱
弱
【想一想】结合同周期的Na、Mg、Al的性质递变规律,预测钾和钙的失电子能力强弱?单质的还原性强弱关系和最高价氧化物对应水化物的碱性强弱关系如何?
提示:K、Ca位于同一周期,从左往右,原子半径逐渐减小,失电子的能力逐渐减弱,还原性逐渐减弱,阳离子的氧化性逐渐增强,最高价氧化物对应水化物的碱性逐渐减弱,KOH>Ca(OH)2。
学习任务二 同周期非金属元素得
电子能力的比较
任务驱动:
磷、硫和氯都位于第3周期,它们得电子的能力不同,判断和评价非金属元
素得电子能力强弱有哪些依据和标准?
1.元素原子得电子能力的判断方法
(1)单质_____________________以及气态氢化物的稳定性。
(2)最高价氧化物对应的水化物___________。
与氢气化合的难易程度
酸性的强弱
2.硅、磷、硫、氯性质的比较
硅 磷 硫 氯
单质与氢气反应难易程度 _____ ________________ ____ ___________
气态氢化物 化学式 ____ ____ ____ ____
稳定性 最高价氧化物对应的水化物 化学式 ____ ___ ______ ____ ___ ______
酸性 _____ _______ ____ _______
结 论 硅、磷、硫、氯四种元素原子得电子能力_________ 高温
磷蒸气与氢气反应
加热
点燃或光照
H4Si
O4
H3PO4
H2S
O4
HClO4
弱酸
中强酸
强酸
最强酸
逐渐增强
SiH4
PH3
H2S
HCl
【做一做】在原子序数1~18号元素中:
(1)与水反应最剧烈的金属是_______;
(2)与水反应最剧烈的非金属单质是______;
(3)在室温下有颜色的气体单质是___________;
(4)在空气中容易自燃的单质名称是_________;
(5)除稀有气体外,原子半径最大的元素是_______,它的原子结构示意图是_________;
(6)原子半径最小的元素是______;
(7)气态氢化物水溶液呈碱性的元素是______;
(8)气态氢化物最稳定的物质的化学式是______;
(9)最高价氧化物对应水化物的酸性最强的元素是_______。
Na
F2
Cl2,F2
白磷
Na
H
N
HF
Cl
课堂合作探究
项 目 同周期(从左到右,稀有气体除外)
最外层电子数 由1递增至7(第1周期除外)
主要化合价 最高正价:+1→+7(O、F除外)
负价:-4→-1
原子半径 逐渐减小
得失电子能力 失电子能力减弱,得电子能力增强
单质的氧化性、还原性 还原性减弱,氧化性增强
最高价氧化物对应水化物的酸碱性 碱性减弱,酸性增强
非金属的氢化物 形成由难到易,稳定性由弱到强
金属单质与水、酸反应 越来越难
同周期,从左到右,金属性逐渐减弱,非金属性逐渐增强 课堂素养达标
