1.1 第1课时 物体是由大量分子组成的 课件(21张PPT)
文档属性
| 名称 | 1.1 第1课时 物体是由大量分子组成的 课件(21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2022-03-29 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
第1课时 物体是由大量分子组成的
第一章 分子动理论
知道阿伏加德罗常数及其意义,会用阿伏加德罗常数进行计算或估算.
3
知道分子模型,体会建立模型在研究物理问题中的作用
2
识物体是由大量分子组成的
1
学习目标
道生一,一生二,二生三,三生万物 ,世界万物的都是由“道”组成。
中国古代的自然观,以老子为代表
古代的自然观
一、物体是由大量分子组成的
西方古代的自然观,以德谟克利特为代表
万物的本原是原子与虚空。原子是一种最后的不可再分的物质微粒。世界万物都是由在虚空中运动着的原子构成。
现代认识
实际上构成物质的单元是多种多样的,或是原子(如金属)或是离子(盐类)或是分子(如有机物)。
在热学中,由于原子、离子、分子这些微粒做热运动时遵从相同的规律,通常统称为分子。除了一些有机物质的大分子外,多数分子尺寸的数量级为10-10m。
化学中讲的分子是:具有各种物质的化学性质的最小微粒。
1、分子的大小
扫描隧道显微镜(能放大几亿倍!)
组成物质的分子是很小的,不但用肉眼不能直接看到它们,就是用光学显微镜也看不到它们。那怎么才能看到分子呢
扫描隧道显微镜,1982年用此人类才观测到物质表面原子的排列。
扫描隧道显微镜下的硅片表面原子的图像
我国科学家在1993年首次利用超真空扫描隧道显微镜技术,在一块晶体硅的表面直接移动硅原子写下了”中国“ 两字。
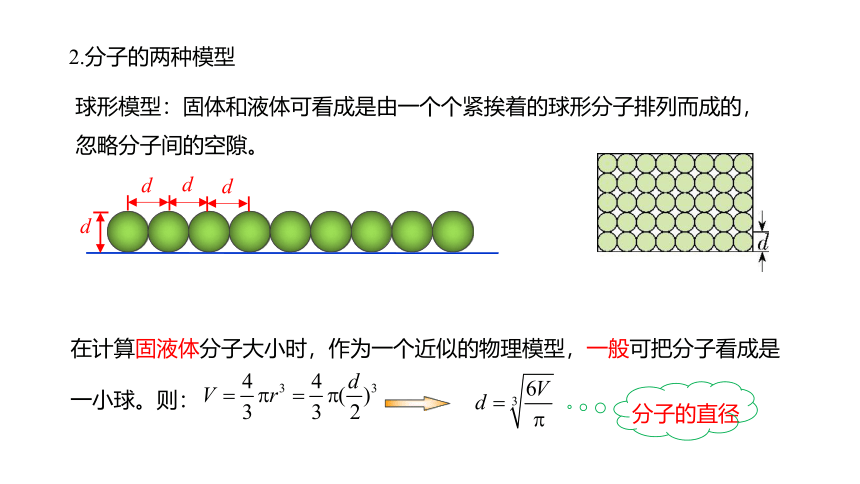
2.分子的两种模型
球形模型:固体和液体可看成是由一个个紧挨着的球形分子排列而成的,忽略分子间的空隙。
d
d
d
d
在计算固液体分子大小时,作为一个近似的物理模型,一般可把分子看成是一小球。则:
分子的直径
立方体模型:气体分子间的空隙很大,把气体分成若干个小立方体,气体分子位于每个小立方体的中心,每个小立方体是位于中心的分子占有的活动空间,这时忽略气体分子的大小。
对气体可以把分子当作是一个小立方体,这个小立方体的边长可以看作相当于分子间的平均距离,即 。
气体分子间的
平均距离
例1: 将1cm3的油酸溶于酒精,制成200cm3的油酸酒精溶液. 该油酸酒精溶液50滴的体积为1cm3,现取1滴溶液滴在水面上,随着酒精溶于水,油酸在水面上形成单分子油膜,油膜面积为0.2m2,由此估算油酸分子的直径。
其中含油酸体积为:
油酸分子直径为:
1滴油酸酒精溶液的体积为:
典例精析
二、阿伏伽德罗常数
1.阿伏加德罗常数NA:1摩尔(mol)任何物质所含的微粒数叫做阿伏加德罗常数.
2.阿伏加德罗常数是联系微观世界和宏观世界的桥梁.
阿伏加德罗常数是联系微观物理量和宏观物理量的桥梁。它把摩尔质量Mmol、摩尔体积Vmol、物体的质量m、物体的体积V、物体的密度ρ等宏观量,跟单个分子的质量m0、单个分子的体积V0等微观量联系起来。
宏观量
微观量
宏观量
微观量
(2)阿伏加德罗常数公式NA= 只适用于固体、液体,对气体不成立,这是因为固体和液体分子排列比较紧密,分子间距可以忽略,但气体分子间距较大,分子间距不能忽略。
注意要点
(1)密度 ,但要切记对单个分子 是没有物理意义的。
3.常用的重要关系式
(1)分子的质量m0=
(2)分子的体积V0 (适用于固体和液体)
(3)单位质量中所含有的分子数n
(4)单位体积中所含有的分子数n
(5)气体分子间的平均距离d (V0为气体分子所占据空间的体积)
(6)固体、液体分子直径d =
典例精析
例2:水的分子量是18 g·mol-1,水的密度ρ=1.0×103 kg/m3,阿伏加德罗常数NA=6.02×1023 mol-1,结果均保留两位有效数字,则:
(1)水的摩尔质量M= g·mol-1或M= kg·mol-1,水的摩尔体积Vmol= m3·mol-1。
(2)水分子的质量m0= kg,水分子的体积V'= m3。
(3)36 g水中所含水分子个数N= 个。
(4)1 cm3水中所含水分子个数N'= 个。
解析:
(1)某种物质的摩尔质量用“g·mol-1”作单位时,其数值与该种物质的分子量相同,所以水的摩尔质量M 18 g·mol-1。如果摩尔质量用“kg·mol-1”表示,就要换算成M 1.8×10-2 kg·mol-1。水的摩尔体积
(2)水分子的质量m0 kg3.0×10-26 kg
水分子的体积V'= m33.0×10-29 m3。
(3)36 g水中所含水分子的个数NNA×6.02×1023个1.2×1024个。
Vmol m3·mol-1 1.8×10-5 m3·mol-1。
1.已知在标准状况下,1 mol氢气的体积为22.4 L,氢气分子直径的数量级为( )
A.10-9 m B.10-10 m
C.10-11 m D.10-8 m
【解析】 分子直径数量级约为10-10 m,故B正确。
跟踪练习
2.下列关于分子数量的说法中,正确的是( )
A.1 g的氢气和1 g的氧气中含有的分子数相等,都是6.02×1023个
B.体积相等的固体和液体相比较,固体中含有较多的分子
C.无论是什么物质,只要他们的摩尔数相同,就含有相同的分子数
D.无论是什么物质,只要他们的体积相同,就含有相同的分子数
解析:1 mol物质的微粒个数都是6.02×1023个,而1 g氢气和1 g氧气的量分别为0.5 mol、mol,它们中的分子的数目是不相等的,故A错误;比较物质中分子数目的多少,是通过比较物质的量,即比较摩尔数,无论是什么物质,只要他们的摩尔数相同,分子数就相同,不能通过比较体积来完成。故C正确,B、D错误.
3.(多选)若已知阿伏加德罗常数、物质的摩尔质量、摩尔体积,则可以计算出( )
A.固体物质分子的大小和质量
B.液体物质分子的大小和质量
C.气体分子的大小和质量
D.气体分子的质量和分子的直径
解析:用M表示摩尔质量,即1mol物质的质量,而1mol物质中含有NA个分子,因此每个分子的质量为.。由于固体和液体中分子间距离较小,可以近似地认为分子是紧密地排列在一起的,那么若用V表示摩尔体积,即NA个分子所具有的总体积,显然就可以表示每个分子的体积,故A、B正确。
4.(多选)阿伏加德罗常数是NA mol-1,铜的摩尔质量是μ kg/mol,铜的密度是ρ kg/m3,以下表达式仅考虑数值,不考虑单位,则下列说法正确的是( )
A.1 m3铜中所含的原子数为 B.一个铜原子的质量是
C.一个铜原子所占的体积是 D.1 kg铜所含有的原子数目是ρNA
解析:1 m3铜所含有的原子数为N= ·NA= ·NA= ,选项A正确;一个铜原子的质量为m0= ,选项B正确;一个铜原子所占的体积为V0= ,选项C正确;1 kg铜所含原子数目为N= ·NA= ,选项D错误。
第1课时 物体是由大量分子组成的
第一章 分子动理论
知道阿伏加德罗常数及其意义,会用阿伏加德罗常数进行计算或估算.
3
知道分子模型,体会建立模型在研究物理问题中的作用
2
识物体是由大量分子组成的
1
学习目标
道生一,一生二,二生三,三生万物 ,世界万物的都是由“道”组成。
中国古代的自然观,以老子为代表
古代的自然观
一、物体是由大量分子组成的
西方古代的自然观,以德谟克利特为代表
万物的本原是原子与虚空。原子是一种最后的不可再分的物质微粒。世界万物都是由在虚空中运动着的原子构成。
现代认识
实际上构成物质的单元是多种多样的,或是原子(如金属)或是离子(盐类)或是分子(如有机物)。
在热学中,由于原子、离子、分子这些微粒做热运动时遵从相同的规律,通常统称为分子。除了一些有机物质的大分子外,多数分子尺寸的数量级为10-10m。
化学中讲的分子是:具有各种物质的化学性质的最小微粒。
1、分子的大小
扫描隧道显微镜(能放大几亿倍!)
组成物质的分子是很小的,不但用肉眼不能直接看到它们,就是用光学显微镜也看不到它们。那怎么才能看到分子呢
扫描隧道显微镜,1982年用此人类才观测到物质表面原子的排列。
扫描隧道显微镜下的硅片表面原子的图像
我国科学家在1993年首次利用超真空扫描隧道显微镜技术,在一块晶体硅的表面直接移动硅原子写下了”中国“ 两字。
2.分子的两种模型
球形模型:固体和液体可看成是由一个个紧挨着的球形分子排列而成的,忽略分子间的空隙。
d
d
d
d
在计算固液体分子大小时,作为一个近似的物理模型,一般可把分子看成是一小球。则:
分子的直径
立方体模型:气体分子间的空隙很大,把气体分成若干个小立方体,气体分子位于每个小立方体的中心,每个小立方体是位于中心的分子占有的活动空间,这时忽略气体分子的大小。
对气体可以把分子当作是一个小立方体,这个小立方体的边长可以看作相当于分子间的平均距离,即 。
气体分子间的
平均距离
例1: 将1cm3的油酸溶于酒精,制成200cm3的油酸酒精溶液. 该油酸酒精溶液50滴的体积为1cm3,现取1滴溶液滴在水面上,随着酒精溶于水,油酸在水面上形成单分子油膜,油膜面积为0.2m2,由此估算油酸分子的直径。
其中含油酸体积为:
油酸分子直径为:
1滴油酸酒精溶液的体积为:
典例精析
二、阿伏伽德罗常数
1.阿伏加德罗常数NA:1摩尔(mol)任何物质所含的微粒数叫做阿伏加德罗常数.
2.阿伏加德罗常数是联系微观世界和宏观世界的桥梁.
阿伏加德罗常数是联系微观物理量和宏观物理量的桥梁。它把摩尔质量Mmol、摩尔体积Vmol、物体的质量m、物体的体积V、物体的密度ρ等宏观量,跟单个分子的质量m0、单个分子的体积V0等微观量联系起来。
宏观量
微观量
宏观量
微观量
(2)阿伏加德罗常数公式NA= 只适用于固体、液体,对气体不成立,这是因为固体和液体分子排列比较紧密,分子间距可以忽略,但气体分子间距较大,分子间距不能忽略。
注意要点
(1)密度 ,但要切记对单个分子 是没有物理意义的。
3.常用的重要关系式
(1)分子的质量m0=
(2)分子的体积V0 (适用于固体和液体)
(3)单位质量中所含有的分子数n
(4)单位体积中所含有的分子数n
(5)气体分子间的平均距离d (V0为气体分子所占据空间的体积)
(6)固体、液体分子直径d =
典例精析
例2:水的分子量是18 g·mol-1,水的密度ρ=1.0×103 kg/m3,阿伏加德罗常数NA=6.02×1023 mol-1,结果均保留两位有效数字,则:
(1)水的摩尔质量M= g·mol-1或M= kg·mol-1,水的摩尔体积Vmol= m3·mol-1。
(2)水分子的质量m0= kg,水分子的体积V'= m3。
(3)36 g水中所含水分子个数N= 个。
(4)1 cm3水中所含水分子个数N'= 个。
解析:
(1)某种物质的摩尔质量用“g·mol-1”作单位时,其数值与该种物质的分子量相同,所以水的摩尔质量M 18 g·mol-1。如果摩尔质量用“kg·mol-1”表示,就要换算成M 1.8×10-2 kg·mol-1。水的摩尔体积
(2)水分子的质量m0 kg3.0×10-26 kg
水分子的体积V'= m33.0×10-29 m3。
(3)36 g水中所含水分子的个数NNA×6.02×1023个1.2×1024个。
Vmol m3·mol-1 1.8×10-5 m3·mol-1。
1.已知在标准状况下,1 mol氢气的体积为22.4 L,氢气分子直径的数量级为( )
A.10-9 m B.10-10 m
C.10-11 m D.10-8 m
【解析】 分子直径数量级约为10-10 m,故B正确。
跟踪练习
2.下列关于分子数量的说法中,正确的是( )
A.1 g的氢气和1 g的氧气中含有的分子数相等,都是6.02×1023个
B.体积相等的固体和液体相比较,固体中含有较多的分子
C.无论是什么物质,只要他们的摩尔数相同,就含有相同的分子数
D.无论是什么物质,只要他们的体积相同,就含有相同的分子数
解析:1 mol物质的微粒个数都是6.02×1023个,而1 g氢气和1 g氧气的量分别为0.5 mol、mol,它们中的分子的数目是不相等的,故A错误;比较物质中分子数目的多少,是通过比较物质的量,即比较摩尔数,无论是什么物质,只要他们的摩尔数相同,分子数就相同,不能通过比较体积来完成。故C正确,B、D错误.
3.(多选)若已知阿伏加德罗常数、物质的摩尔质量、摩尔体积,则可以计算出( )
A.固体物质分子的大小和质量
B.液体物质分子的大小和质量
C.气体分子的大小和质量
D.气体分子的质量和分子的直径
解析:用M表示摩尔质量,即1mol物质的质量,而1mol物质中含有NA个分子,因此每个分子的质量为.。由于固体和液体中分子间距离较小,可以近似地认为分子是紧密地排列在一起的,那么若用V表示摩尔体积,即NA个分子所具有的总体积,显然就可以表示每个分子的体积,故A、B正确。
4.(多选)阿伏加德罗常数是NA mol-1,铜的摩尔质量是μ kg/mol,铜的密度是ρ kg/m3,以下表达式仅考虑数值,不考虑单位,则下列说法正确的是( )
A.1 m3铜中所含的原子数为 B.一个铜原子的质量是
C.一个铜原子所占的体积是 D.1 kg铜所含有的原子数目是ρNA
解析:1 m3铜所含有的原子数为N= ·NA= ·NA= ,选项A正确;一个铜原子的质量为m0= ,选项B正确;一个铜原子所占的体积为V0= ,选项C正确;1 kg铜所含原子数目为N= ·NA= ,选项D错误。
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
