7.2物质溶解的量-2021-2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 7.2物质溶解的量-2021-2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 160.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 09:22:09 | ||
图片预览




文档简介
科粤版九年级化学下册 7.2 物质溶解的量
一、单选题
1.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
2.x,y两概念符合图示“包含关系”的是。
A.饱和溶液 溶液 B.溶质 溶剂
C.乳浊液 溶液 D.稀溶液 不饱和溶液
3.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
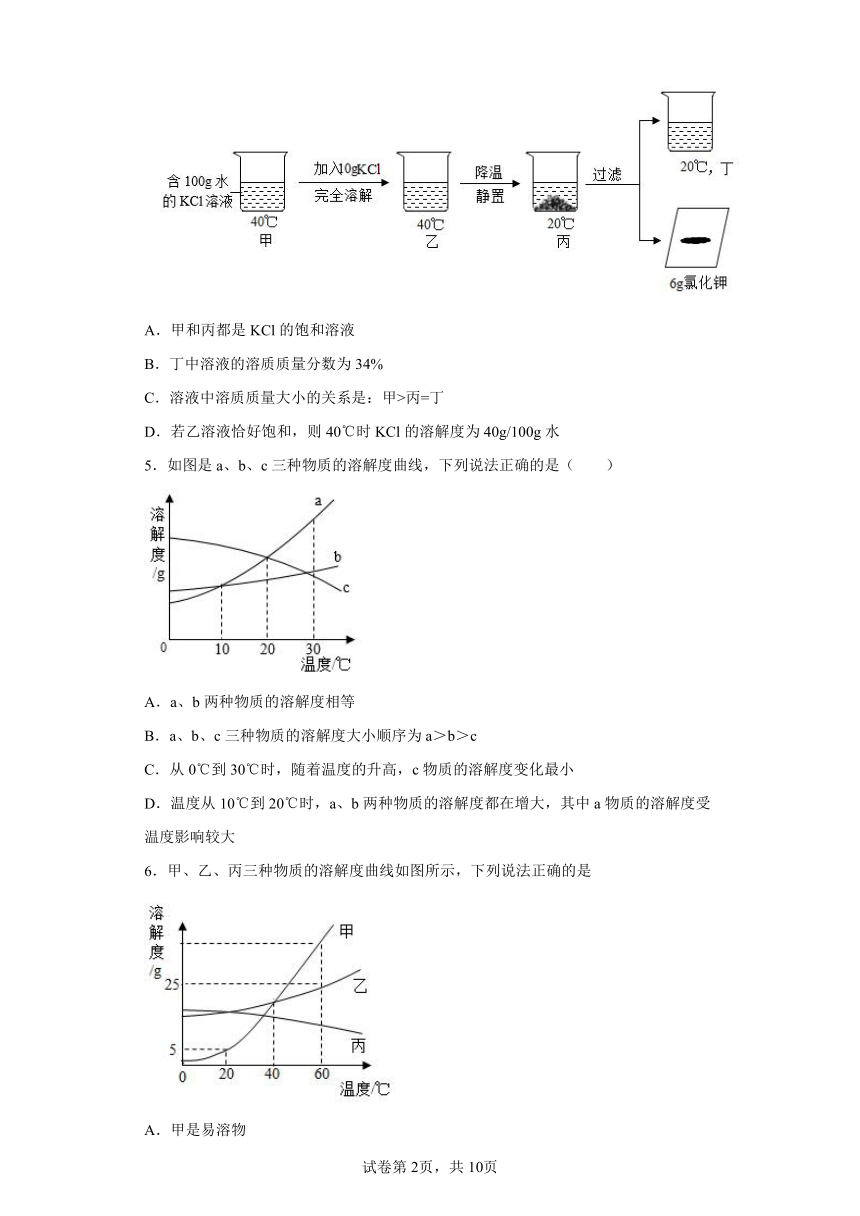
4.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
5.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
A.a、b两种物质的溶解度相等
B.a、b、c三种物质的溶解度大小顺序为a>b>c
C.从0℃到30℃时,随着温度的升高,c物质的溶解度变化最小
D.温度从10℃到20℃时,a、b两种物质的溶解度都在增大,其中a物质的溶解度受温度影响较大
6.甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是
A.甲是易溶物
B.60℃时,将等质量的甲、乙饱和溶液降温至40℃,溶液的质量乙>甲
C.60℃时,将100g乙的饱和溶液配成质量分数为5%的溶液,需加水380g
D.甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
7.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
8.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
9.下列加速溶解的措施中,能改变固体溶解度的是( )
A.把固体研细 B.加热 C.搅拌 D.振荡
10.如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是
A.20℃时,100g甲、乙两种物质的溶液中含有相同质量的溶质
B.40℃时,甲比乙的溶解度、溶质的质量分数都大
C.甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲>乙
D.将100g溶质的质量分数为20%的甲溶液从40℃降温至20℃,其溶质的质量分数仍然为20%
11.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
12.下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其它物质
13.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.甲、丙的溶解度大小为:甲>丙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍为饱和溶液
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,将甲、乙各30g分别加入100g水中,均形成对应的饱和溶液
14.t℃时,向一支盛有0.l克熟石灰的试管内加人 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
15.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
16.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
二、综合应用题
17.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
【查阅资料】
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
18.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
19.(1)小明取串场河的河水,按下列流程进行实验,制取蒸馏水。请回答下列问题:
①滤液中有难闻的异味,可添加__________除去,
②生活中常用_____________来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过__________方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中铁元素的化合价为____________。
(2)如图是A、B、C三种物质的溶解度曲线,请回答:
①在t2℃时,将30gA物质充分溶解在盛有50g水的烧杯中,所得溶液的质量为_________g;若将烧杯内物质降温至t1℃(不考虑水蒸发),溶液中变化的是_____________(填字母序号)。
a 溶剂的质量 b 溶液的质量 c 溶质的质量分数
②当A物质中混有少量B、C两种物质时,采用_____________的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是____________。
(3)实验室用质量分数为 6%的氯化钠溶液(密度为1.04g/cm3)配制 50g 质量分数为3%的氯化钠溶液。
①经计算,所需 6%的氯化钠的体积为________mL;加水_______克
②若量取水时,采取仰视读数,其它操作均正确,则配制得到的稀溶液中溶质质量分数_______3% (填“>”“<”或“ = ”)。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为 ___(填字母序号)
A 15.5g B 16.1g C 18.1g
20.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
21.t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②中的上层清液是否达到饱和状态?_______(填“是”、“否”或“无法判断”);
(2)烧杯②中溶解的溶质是________(写化学式);
(3)t1℃时200g硝酸钾的饱和溶液中硝酸钾的质量______g;
(4)关于图1中烧杯内的物质,下列说法正确的是_________
A烧杯①内溶液中溶质的质量分数<烧杯②内上层清液中溶质的质量分数
B烧杯②中加热蒸发少量水时,同时一定还有固体析出
C将两个烧杯中的溶液混合,充分搅拌后,烧杯中可能还有氯化钾没有溶解
D将温度升高到t2℃,烧杯②中固体一定全溶解,并成为不饱和溶液(不考虑水的蒸发)
E将温度升高到t2℃,烧杯①内溶液的质量=烧杯②内溶液的质量(不考虑水的蒸发)
22.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.B
7.C
8.C
9.B
10.D
11.B
12.C
13.A
14.B
15.D
16.D
17. 增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
18. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
19. 活性炭 肥皂水 煮沸 +6 70 bc 降温结晶 B>A>C 24 25 < B
20. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
21. 是 KNO3 40g DE
22. 白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
答案第1页,共2页
答案第1页,共2页
一、单选题
1.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
2.x,y两概念符合图示“包含关系”的是。
A.饱和溶液 溶液 B.溶质 溶剂
C.乳浊液 溶液 D.稀溶液 不饱和溶液
3.分析下图溶解度曲线,判断下列说法错误的是
A.t1℃时,甲乙的溶解度是相等的,都是40g
B.t3℃时等质量的甲、乙饱和溶液降温至t1℃时,所得甲溶液质量小于乙溶液
C.甲中混有少量乙,可以用冷却热饱和溶液的方法提纯甲物质
D.取t2℃的甲乙的饱和溶液降温至t1℃时,甲乙溶液中析出固体的质量比2:1
4.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
5.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
A.a、b两种物质的溶解度相等
B.a、b、c三种物质的溶解度大小顺序为a>b>c
C.从0℃到30℃时,随着温度的升高,c物质的溶解度变化最小
D.温度从10℃到20℃时,a、b两种物质的溶解度都在增大,其中a物质的溶解度受温度影响较大
6.甲、乙、丙三种物质的溶解度曲线如图所示,下列说法正确的是
A.甲是易溶物
B.60℃时,将等质量的甲、乙饱和溶液降温至40℃,溶液的质量乙>甲
C.60℃时,将100g乙的饱和溶液配成质量分数为5%的溶液,需加水380g
D.甲中混有少量丙,若要得到较纯净的甲,常采用蒸发结晶的方法
7.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
8.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
9.下列加速溶解的措施中,能改变固体溶解度的是( )
A.把固体研细 B.加热 C.搅拌 D.振荡
10.如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是
A.20℃时,100g甲、乙两种物质的溶液中含有相同质量的溶质
B.40℃时,甲比乙的溶解度、溶质的质量分数都大
C.甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲>乙
D.将100g溶质的质量分数为20%的甲溶液从40℃降温至20℃,其溶质的质量分数仍然为20%
11.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
12.下列有关溶液的说法正确的是( )
A.将植物油加入水中搅拌,可得到溶液
B.溶液一定是无色透明的液体
C.蔗糖溶液中,蔗糖是溶质,水是溶剂
D.饱和溶液中一定不能再溶解其它物质
13.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.甲、丙的溶解度大小为:甲>丙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍为饱和溶液
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,将甲、乙各30g分别加入100g水中,均形成对应的饱和溶液
14.t℃时,向一支盛有0.l克熟石灰的试管内加人 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
15.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
16.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
二、综合应用题
17.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
【查阅资料】
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
18.人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和 ________ 。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为 ______ 。
③实验C,滴加水后看到U型管中 ______ (填“左边”或“右边”)液面升高。
(2)如图D是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是 _____ 。 ②下列说法一定正确的是 _______
A.甲的溶解度比乙的溶解度大
B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水
D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?并说明理由 ____ 。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩, __________ ,然后过滤。
19.(1)小明取串场河的河水,按下列流程进行实验,制取蒸馏水。请回答下列问题:
①滤液中有难闻的异味,可添加__________除去,
②生活中常用_____________来比较所取水样与制得的蒸馏水的硬度。
③经过净化后的水,在生活中通过__________方法,降低水的硬度并杀菌;
④消毒剂为高铁酸钾(K2FeO4)。高铁酸钾中铁元素的化合价为____________。
(2)如图是A、B、C三种物质的溶解度曲线,请回答:
①在t2℃时,将30gA物质充分溶解在盛有50g水的烧杯中,所得溶液的质量为_________g;若将烧杯内物质降温至t1℃(不考虑水蒸发),溶液中变化的是_____________(填字母序号)。
a 溶剂的质量 b 溶液的质量 c 溶质的质量分数
②当A物质中混有少量B、C两种物质时,采用_____________的方法可以提纯A.
③将t2℃的A、B、C三种物质的饱和溶液分别降温到t1℃时,所得溶液的溶质质量分数由大到小的顺序是____________。
(3)实验室用质量分数为 6%的氯化钠溶液(密度为1.04g/cm3)配制 50g 质量分数为3%的氯化钠溶液。
①经计算,所需 6%的氯化钠的体积为________mL;加水_______克
②若量取水时,采取仰视读数,其它操作均正确,则配制得到的稀溶液中溶质质量分数_______3% (填“>”“<”或“ = ”)。
③向该49g20%的稀硫酸中,加入7.3g已部分氧化的锌粉,恰好完全反应。则所得溶液中溶质的质量为 ___(填字母序号)
A 15.5g B 16.1g C 18.1g
20.下表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) 10 20 30 40 50 60
甲 35.8 36.0 36.3 36.6 37.0 37.3
乙 20.9 31.6 45.8 63.9 85.5 110.0
丙 0.182 0.165 0.160 0.141 x 0.121
(1)10℃时,甲物质的溶解度是_____g/100g水。
(2)三种物质中溶解度受温度影响较大的是_____;
(3)物质在水中的溶解性与其溶解度(20℃)的关系示意图如下,则丙物质在水中的溶解性是_____;
(4)30℃时,乙物质饱和溶液的溶质质量分数是_____;(列式即可,不要求计算)
(5)50℃时,三种物质的溶解度由大到小的顺序是_____;
(6)向不同温度的100g水中分别放入等质量的乙物质,保持温度不变,溶解情况如图所示。相关分析正确的是_____;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液质量:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ一定是不饱和溶液
d.使Ⅳ中的固体恰好全部溶解,溶质质量分数不变
(7)气体的溶解度也有一定的变化规律,不同温度下,氧气的溶解度随压强变化如下图所示,图中t2对应温度为30℃,则t1对应的温度_____。
A小于30℃ B等于30℃ C大于30℃ D无法确定
(8)t℃时,某物质(固体)的饱和溶液中,溶质与溶液的质量比是 n:m,则在 t℃时,该物质的溶解度为_____。
21.t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
(1)烧杯②中的上层清液是否达到饱和状态?_______(填“是”、“否”或“无法判断”);
(2)烧杯②中溶解的溶质是________(写化学式);
(3)t1℃时200g硝酸钾的饱和溶液中硝酸钾的质量______g;
(4)关于图1中烧杯内的物质,下列说法正确的是_________
A烧杯①内溶液中溶质的质量分数<烧杯②内上层清液中溶质的质量分数
B烧杯②中加热蒸发少量水时,同时一定还有固体析出
C将两个烧杯中的溶液混合,充分搅拌后,烧杯中可能还有氯化钾没有溶解
D将温度升高到t2℃,烧杯②中固体一定全溶解,并成为不饱和溶液(不考虑水的蒸发)
E将温度升高到t2℃,烧杯①内溶液的质量=烧杯②内溶液的质量(不考虑水的蒸发)
22.水和溶液与我们的生活息息相关。
(1)将厨房中的下列物质:胡椒、花生油、面粉、白糖分别放入水中,能形成溶液的是_____。
(2)消毒液碘酒中的溶剂是_____(写名称)。
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
①在t2°C时,甲的溶解度为_____,把30g甲溶解在50g水中得到溶液的质量为_____克。
②把N点甲的溶液转化为M点溶液的方法(写一种)_____。
③将甲、乙、丙三种物质的饱和溶液从t3°C降到t2°C,溶质质量分数由大到小的顺序是_____。
④要配制等质量t3°C的甲、乙、丙三种物质的饱和溶液,所需水的质量最多是_____。配制过程中若量取水时仰视读数,则会造成所配溶液的溶质质量分数_____。(“偏大”或“偏小”)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.B
7.C
8.C
9.B
10.D
11.B
12.C
13.A
14.B
15.D
16.D
17. 增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
18. 隔绝氧气 CO2+H2O=H2CO3 左边 20g BC 可行,t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
19. 活性炭 肥皂水 煮沸 +6 70 bc 降温结晶 B>A>C 24 25 < B
20. 35.8 乙 微溶于水 ×100% 乙、甲、丙 bd A
21. 是 KNO3 40g DE
22. 白糖 酒精 30g 65 添加溶质 乙大于甲大于丙 丙 偏小
答案第1页,共2页
答案第1页,共2页
