粤教版化学九年级下册同步提优训练 8.2 第2课时 稀酸的化学性质(word版有答案)
文档属性
| 名称 | 粤教版化学九年级下册同步提优训练 8.2 第2课时 稀酸的化学性质(word版有答案) |

|
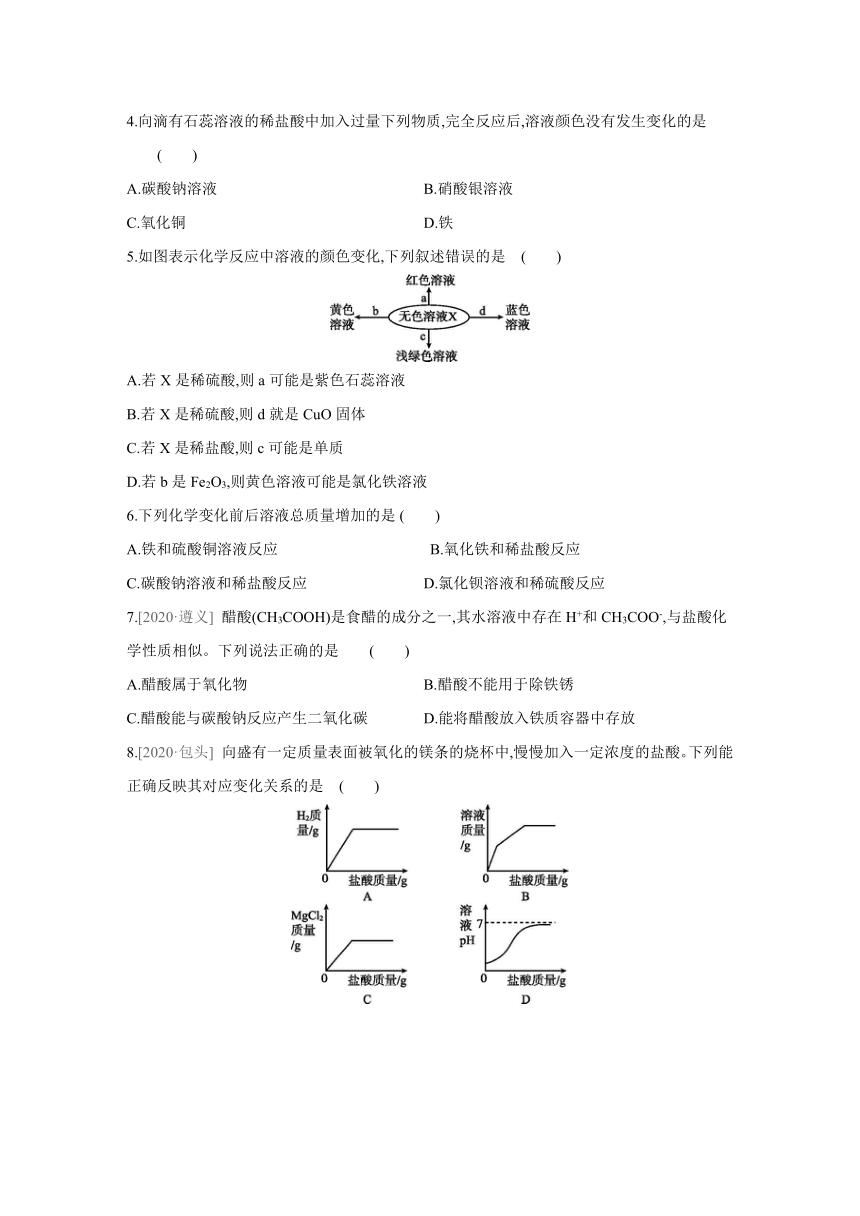
|
| 格式 | docx | ||
| 文件大小 | 178.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 00:00:00 | ||
图片预览

文档简介
数学
化学
8.2 常见的酸和碱
第2课时 稀酸的化学性质
判断正误:(在括号内打“√”或“×”)
(1)紫色石蕊溶液遇稀盐酸变红,遇稀硫酸变蓝 ( )
(2)稀硫酸与铁反应时溶液的颜色变为黄色 ( )
(3)在金属活动性顺序表中,排在氢之前的金属与所有的酸都能反应产生氢气( )
(4)将生锈的铁制品长期浸泡在足量盐酸中除锈 ( )
(5)2Fe+3H2SO4Fe2(SO4)3+3H2↑ ( )
(6)Fe2O3+4HCl2FeCl2+2H2O ( )
(7)AgNO3+HClAgCl↓+HNO3 ( )
[核心知识] 稀盐酸、稀硫酸的化学性质:(1)能与酸碱指示剂反应;(2)能与较活泼金属反应生成盐和氢气;(3)能与金属氧化物反应生成盐和水;(4)能与某些盐反应生成新酸和新盐。
[易错点拨] 单质铁与稀酸发生置换反应时,其化合价由0变为+2;铁锈(主要成分Fe2O3)与稀酸发生反应时,生成物中铁的化合价不变,仍为+3。
1.下列有关物质的用途的叙述不正确的是 ( )
A.盐酸可用来除铁锈
B.在实验室里常用稀硫酸和石灰石反应制备二氧化碳
C.实验室常用锌粒和稀硫酸反应制备氢气
D.铁钉和稀盐酸反应溶液逐渐变为浅绿色
2.检验某溶液是不是酸时,不能选用的药品是 ( )
A.碳酸钠 B.锌粒
C.无色酚酞溶液 D.铁锈
3.下列实验不能达到实验目的的是 ( )
A.用紫色石蕊溶液区分稀盐酸和蒸馏水
B.用稀硫酸除去铁粉中的铜粉
C.用适量的盐酸除铁锈
D.用稀盐酸清洗试剂瓶壁上的碳酸钙
4.向滴有石蕊溶液的稀盐酸中加入过量下列物质,完全反应后,溶液颜色没有发生变化的是 ( )
A.碳酸钠溶液 B.硝酸银溶液
C.氧化铜 D.铁
5.如图表示化学反应中溶液的颜色变化,下列叙述错误的是 ( )
A.若X是稀硫酸,则a可能是紫色石蕊溶液
B.若X是稀硫酸,则d就是CuO固体
C.若X是稀盐酸,则c可能是单质
D.若b是Fe2O3,则黄色溶液可能是氯化铁溶液
6.下列化学变化前后溶液总质量增加的是 ( )
A.铁和硫酸铜溶液反应 B.氧化铁和稀盐酸反应
C.碳酸钠溶液和稀盐酸反应 D.氯化钡溶液和稀硫酸反应
7.[2020·遵义] 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和CH3COO-,与盐酸化学性质相似。下列说法正确的是 ( )
A.醋酸属于氧化物 B.醋酸不能用于除铁锈
C.醋酸能与碳酸钠反应产生二氧化碳 D.能将醋酸放入铁质容器中存放
8.[2020·包头] 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列能正确反映其对应变化关系的是 ( )
9.[2020·河北] 向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是 ( )
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b) g
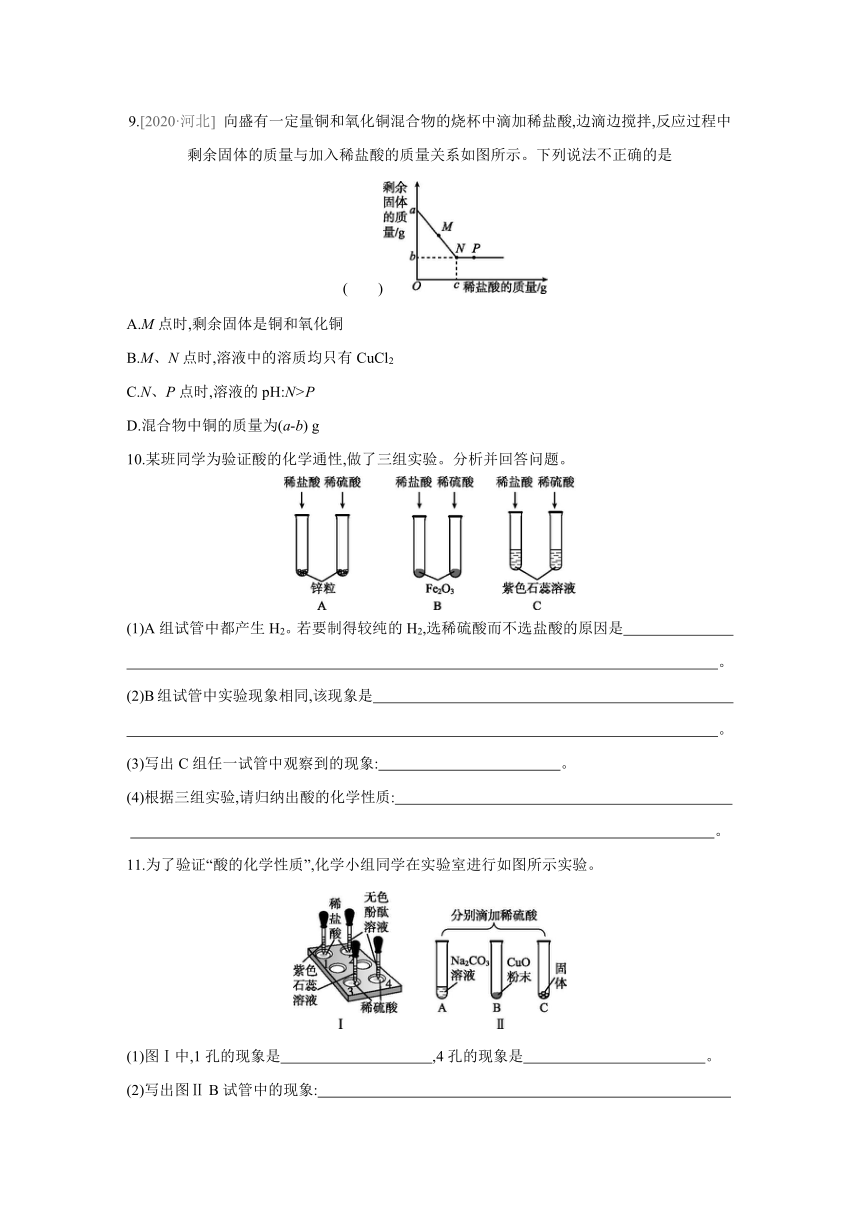
10.某班同学为验证酸的化学通性,做了三组实验。分析并回答问题。
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是
。
(2)B组试管中实验现象相同,该现象是
。
(3)写出C组任一试管中观察到的现象: 。
(4)根据三组实验,请归纳出酸的化学性质:
。
11.为了验证“酸的化学性质”,化学小组同学在实验室进行如图所示实验。
(1)图Ⅰ中,1孔的现象是 ,4孔的现象是 。
(2)写出图Ⅱ B试管中的现象:
。
(3)要全面验证酸的化学性质,C试管中能与酸反应的固体单质是 (写出1种即可)。
(4)实验完成后,将A、B、C三支试管中的废液倒入废液缸内,测得pH=2,写出废液缸中所含全部溶质的化学式: (溶质不计指示剂与气体)。
12.[2020·平凉] 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图2所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
13.某兴趣小组做了锌粒与稀硫酸反应的实验后,用浓硫酸代替稀硫酸与锌粒进行实验,发现有刺激性气味气体产生。为了验证该气体的成分,该小组通过查阅资料得知:浓硫酸有强氧化性,能与多种物质反应;SO2能使品红溶液褪色,可被酸性KMnO4溶液吸收。于是他们进行如下实验:
(1)实验现象与结论
①反应进行不久,观察到B处 ,D处无明显现象,证明产生的气体是SO2,写出有关反应的化学方程式: 。
②反应继续进行一段时间后,D处气体能燃烧,干燥的烧杯内壁有水珠,证明产生的气体是H2,产生该气体的原因是
。
(2)反思与评价
小明认为,工业上可用锌粒和浓硫酸反应大量制取硫酸锌溶液,小红认为不适宜,她的理由是 。
答案
(1)× (2)× (3)× (4)× (5)× (6)× (7)√
[应考能力提升练]
1.B 稀硫酸和石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石表面,会阻碍反应继续进行,因此不能用于制备二氧化碳。
2.C 因无色酚酞溶液遇酸不变色,不能用于检验某溶液是不是酸。
3.B 稀硫酸与铁反应,不与铜反应。因此将稀硫酸加入铁粉和铜粉的混合物中,除去的是铁粉,不是铜粉。
4.B
5.B 稀硫酸能使石蕊溶液变红,若X是稀硫酸,则a可能是紫色石蕊溶液;稀硫酸与氧化铜反应生成硫酸铜和水,稀硫酸和氢氧化铜的反应也生成硫酸铜和水,硫酸铜溶液呈蓝色,若X是稀硫酸,则d可能为CuO固体;盐酸与铁反应生成氯化亚铁和氢气,盐酸与氧化亚铁反应生成氯化亚铁和水,盐酸与氢氧化亚铁反应也生成氯化亚铁和水,氯化亚铁呈浅绿色,若X是稀盐酸,则c可能是单质铁;氧化铁与盐酸反应生成氯化铁和水,氧化铁与硫酸反应生成硫酸铁和水,若b是Fe2O3,则黄色溶液可能是氯化铁溶液。
6.B 铁和硫酸铜溶液反应生成铜和硫酸亚铁,溶液质量减少;氧化铁和稀盐酸反应生成氯化铁和水,溶液质量增加;碳酸钠溶液和稀盐酸发生反应生成水、二氧化碳和氯化钠,溶液质量减少;氯化钡溶液和稀硫酸反应生成硫酸钡沉淀和盐酸,溶液质量减少。
7.C 醋酸由三种元素组成,不属于氧化物;醋酸能和氧化铁反应,可用于除铁锈;醋酸能与铁反应,不能将醋酸放入铁质容器中存放。
8.C 氧化镁先与稀盐酸反应生成氯化镁和水,镁再与稀盐酸反应生成氯化镁和氢气,一开始不会产生氢气,图像起点不应为原点。氧化镁先与稀盐酸反应生成氯化镁和水,溶液质量增加,镁再与稀盐酸反应生成氯化镁和氢气,由于有氢气生成,溶液质量增加的幅度要小;完全反应后继续滴加稀盐酸,溶液的质量继续增加。氧化镁、镁与稀盐酸反应均生成氯化镁,氯化镁的质量逐渐增加,至完全反应后不再发生改变。加入稀盐酸前,烧杯中只有氧化镁和镁,不存在溶液,溶液的pH不可能小于7,加入稀盐酸后,氧化镁先与稀盐酸反应生成氯化镁和水,镁再与稀盐酸反应生成氯化镁和氢气,完全反应时溶液显中性,继续滴加稀盐酸,溶液酸性又开始增强。
9.D M点时,氧化铜部分反应,剩余固体是铜和氧化铜;M、N点时,溶液中的溶质均只有CuCl2;N点时,氧化铜恰好完全反应,pH=7,P点时,稀盐酸过量,溶液显酸性,pH小于7,溶液的pH是N>P;混合物中铜的质量为b g。
10.(1)盐酸有挥发性(或盐酸会挥发出氯化氢气体或制得的氢气中混有氯化氢气体)
(2)红棕色固体逐渐减少,溶液变成黄色
(3)紫色石蕊溶液变为红色
(4)能与较活泼的金属反应,能与金属氧化物反应,能与酸碱指示剂反应
(1)盐酸具有挥发性,用盐酸制氢气,氢气中会混入氯化氢。(2)稀盐酸和稀硫酸都能与氧化铁反应,生成氯化铁或硫酸铁和水,氯化铁溶液或硫酸铁溶液都显黄色。
11.(1)紫色石蕊溶液变为红色 无色酚酞溶液不变色
(2)黑色粉末逐渐溶解,溶液变为蓝色
(3)Zn(或Fe等,合理即可)
(4)H2SO4、Na2SO4、CuSO4、ZnSO4[与(3)对应合理即可]
(1)紫色石蕊溶液遇酸性溶液变红,稀盐酸显酸性,1孔的现象是紫色石蕊溶液变为红色;无色酚酞溶液遇酸性溶液不变色,稀硫酸显酸性,4孔的现象是无色酚酞溶液不变色。(2)B试管中氧化铜与稀硫酸反应生成硫酸铜和水,实验现象是黑色粉末逐渐溶解,溶液变为蓝色。(3)酸能与活泼金属反应生成盐和氢气,C试管中能与酸反应的固体单质是锌或铁等金属,其化学式为Zn或Fe等。(4)将A、B、C三支试管中的废液倒入废液缸内,测得pH=2,说明溶液显酸性,稀硫酸有剩余,废液中还一定含有硫酸钠、硫酸铜、硫酸锌(或硫酸亚铁等),其化学式为H2SO4、Na2SO4、CuSO4、ZnSO4(或FeSO4等)。
12.(1)0.08
(2)解:设10 g稀硫酸中含硫酸的质量为x。
Fe+H2SO4FeSO4+H2↑
98 2
x 0.04 g
= x=1.96 g
稀硫酸中溶质的质量分数为×100%=19.6%。
答:原稀硫酸中溶质的质量分数为19.6%。
13.(1)①品红溶液褪色
Zn+2H2SO4(浓)ZnSO4+2H2O+SO2↑
②随着硫酸的消耗和水的生成,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气
(2)会产生大量的有毒气体二氧化硫,污染空气
化学
8.2 常见的酸和碱
第2课时 稀酸的化学性质
判断正误:(在括号内打“√”或“×”)
(1)紫色石蕊溶液遇稀盐酸变红,遇稀硫酸变蓝 ( )
(2)稀硫酸与铁反应时溶液的颜色变为黄色 ( )
(3)在金属活动性顺序表中,排在氢之前的金属与所有的酸都能反应产生氢气( )
(4)将生锈的铁制品长期浸泡在足量盐酸中除锈 ( )
(5)2Fe+3H2SO4Fe2(SO4)3+3H2↑ ( )
(6)Fe2O3+4HCl2FeCl2+2H2O ( )
(7)AgNO3+HClAgCl↓+HNO3 ( )
[核心知识] 稀盐酸、稀硫酸的化学性质:(1)能与酸碱指示剂反应;(2)能与较活泼金属反应生成盐和氢气;(3)能与金属氧化物反应生成盐和水;(4)能与某些盐反应生成新酸和新盐。
[易错点拨] 单质铁与稀酸发生置换反应时,其化合价由0变为+2;铁锈(主要成分Fe2O3)与稀酸发生反应时,生成物中铁的化合价不变,仍为+3。
1.下列有关物质的用途的叙述不正确的是 ( )
A.盐酸可用来除铁锈
B.在实验室里常用稀硫酸和石灰石反应制备二氧化碳
C.实验室常用锌粒和稀硫酸反应制备氢气
D.铁钉和稀盐酸反应溶液逐渐变为浅绿色
2.检验某溶液是不是酸时,不能选用的药品是 ( )
A.碳酸钠 B.锌粒
C.无色酚酞溶液 D.铁锈
3.下列实验不能达到实验目的的是 ( )
A.用紫色石蕊溶液区分稀盐酸和蒸馏水
B.用稀硫酸除去铁粉中的铜粉
C.用适量的盐酸除铁锈
D.用稀盐酸清洗试剂瓶壁上的碳酸钙
4.向滴有石蕊溶液的稀盐酸中加入过量下列物质,完全反应后,溶液颜色没有发生变化的是 ( )
A.碳酸钠溶液 B.硝酸银溶液
C.氧化铜 D.铁
5.如图表示化学反应中溶液的颜色变化,下列叙述错误的是 ( )
A.若X是稀硫酸,则a可能是紫色石蕊溶液
B.若X是稀硫酸,则d就是CuO固体
C.若X是稀盐酸,则c可能是单质
D.若b是Fe2O3,则黄色溶液可能是氯化铁溶液
6.下列化学变化前后溶液总质量增加的是 ( )
A.铁和硫酸铜溶液反应 B.氧化铁和稀盐酸反应
C.碳酸钠溶液和稀盐酸反应 D.氯化钡溶液和稀硫酸反应
7.[2020·遵义] 醋酸(CH3COOH)是食醋的成分之一,其水溶液中存在H+和CH3COO-,与盐酸化学性质相似。下列说法正确的是 ( )
A.醋酸属于氧化物 B.醋酸不能用于除铁锈
C.醋酸能与碳酸钠反应产生二氧化碳 D.能将醋酸放入铁质容器中存放
8.[2020·包头] 向盛有一定质量表面被氧化的镁条的烧杯中,慢慢加入一定浓度的盐酸。下列能正确反映其对应变化关系的是 ( )
9.[2020·河北] 向盛有一定量铜和氧化铜混合物的烧杯中滴加稀盐酸,边滴边搅拌,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法不正确的是 ( )
A.M点时,剩余固体是铜和氧化铜
B.M、N点时,溶液中的溶质均只有CuCl2
C.N、P点时,溶液的pH:N>P
D.混合物中铜的质量为(a-b) g
10.某班同学为验证酸的化学通性,做了三组实验。分析并回答问题。
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是
。
(2)B组试管中实验现象相同,该现象是
。
(3)写出C组任一试管中观察到的现象: 。
(4)根据三组实验,请归纳出酸的化学性质:
。
11.为了验证“酸的化学性质”,化学小组同学在实验室进行如图所示实验。
(1)图Ⅰ中,1孔的现象是 ,4孔的现象是 。
(2)写出图Ⅱ B试管中的现象:
。
(3)要全面验证酸的化学性质,C试管中能与酸反应的固体单质是 (写出1种即可)。
(4)实验完成后,将A、B、C三支试管中的废液倒入废液缸内,测得pH=2,写出废液缸中所含全部溶质的化学式: (溶质不计指示剂与气体)。
12.[2020·平凉] 向盛有一定质量铁粉的烧杯中逐滴加入稀硫酸充分反应,产生气体质量与所加稀硫酸质量的关系如图2所示。请根据该图信息计算:
(1)铁粉反应完时,产生氢气的质量为 g。
(2)原稀硫酸中溶质的质量分数(写出计算过程)。
13.某兴趣小组做了锌粒与稀硫酸反应的实验后,用浓硫酸代替稀硫酸与锌粒进行实验,发现有刺激性气味气体产生。为了验证该气体的成分,该小组通过查阅资料得知:浓硫酸有强氧化性,能与多种物质反应;SO2能使品红溶液褪色,可被酸性KMnO4溶液吸收。于是他们进行如下实验:
(1)实验现象与结论
①反应进行不久,观察到B处 ,D处无明显现象,证明产生的气体是SO2,写出有关反应的化学方程式: 。
②反应继续进行一段时间后,D处气体能燃烧,干燥的烧杯内壁有水珠,证明产生的气体是H2,产生该气体的原因是
。
(2)反思与评价
小明认为,工业上可用锌粒和浓硫酸反应大量制取硫酸锌溶液,小红认为不适宜,她的理由是 。
答案
(1)× (2)× (3)× (4)× (5)× (6)× (7)√
[应考能力提升练]
1.B 稀硫酸和石灰石反应生成的硫酸钙微溶于水,覆盖在石灰石表面,会阻碍反应继续进行,因此不能用于制备二氧化碳。
2.C 因无色酚酞溶液遇酸不变色,不能用于检验某溶液是不是酸。
3.B 稀硫酸与铁反应,不与铜反应。因此将稀硫酸加入铁粉和铜粉的混合物中,除去的是铁粉,不是铜粉。
4.B
5.B 稀硫酸能使石蕊溶液变红,若X是稀硫酸,则a可能是紫色石蕊溶液;稀硫酸与氧化铜反应生成硫酸铜和水,稀硫酸和氢氧化铜的反应也生成硫酸铜和水,硫酸铜溶液呈蓝色,若X是稀硫酸,则d可能为CuO固体;盐酸与铁反应生成氯化亚铁和氢气,盐酸与氧化亚铁反应生成氯化亚铁和水,盐酸与氢氧化亚铁反应也生成氯化亚铁和水,氯化亚铁呈浅绿色,若X是稀盐酸,则c可能是单质铁;氧化铁与盐酸反应生成氯化铁和水,氧化铁与硫酸反应生成硫酸铁和水,若b是Fe2O3,则黄色溶液可能是氯化铁溶液。
6.B 铁和硫酸铜溶液反应生成铜和硫酸亚铁,溶液质量减少;氧化铁和稀盐酸反应生成氯化铁和水,溶液质量增加;碳酸钠溶液和稀盐酸发生反应生成水、二氧化碳和氯化钠,溶液质量减少;氯化钡溶液和稀硫酸反应生成硫酸钡沉淀和盐酸,溶液质量减少。
7.C 醋酸由三种元素组成,不属于氧化物;醋酸能和氧化铁反应,可用于除铁锈;醋酸能与铁反应,不能将醋酸放入铁质容器中存放。
8.C 氧化镁先与稀盐酸反应生成氯化镁和水,镁再与稀盐酸反应生成氯化镁和氢气,一开始不会产生氢气,图像起点不应为原点。氧化镁先与稀盐酸反应生成氯化镁和水,溶液质量增加,镁再与稀盐酸反应生成氯化镁和氢气,由于有氢气生成,溶液质量增加的幅度要小;完全反应后继续滴加稀盐酸,溶液的质量继续增加。氧化镁、镁与稀盐酸反应均生成氯化镁,氯化镁的质量逐渐增加,至完全反应后不再发生改变。加入稀盐酸前,烧杯中只有氧化镁和镁,不存在溶液,溶液的pH不可能小于7,加入稀盐酸后,氧化镁先与稀盐酸反应生成氯化镁和水,镁再与稀盐酸反应生成氯化镁和氢气,完全反应时溶液显中性,继续滴加稀盐酸,溶液酸性又开始增强。
9.D M点时,氧化铜部分反应,剩余固体是铜和氧化铜;M、N点时,溶液中的溶质均只有CuCl2;N点时,氧化铜恰好完全反应,pH=7,P点时,稀盐酸过量,溶液显酸性,pH小于7,溶液的pH是N>P;混合物中铜的质量为b g。
10.(1)盐酸有挥发性(或盐酸会挥发出氯化氢气体或制得的氢气中混有氯化氢气体)
(2)红棕色固体逐渐减少,溶液变成黄色
(3)紫色石蕊溶液变为红色
(4)能与较活泼的金属反应,能与金属氧化物反应,能与酸碱指示剂反应
(1)盐酸具有挥发性,用盐酸制氢气,氢气中会混入氯化氢。(2)稀盐酸和稀硫酸都能与氧化铁反应,生成氯化铁或硫酸铁和水,氯化铁溶液或硫酸铁溶液都显黄色。
11.(1)紫色石蕊溶液变为红色 无色酚酞溶液不变色
(2)黑色粉末逐渐溶解,溶液变为蓝色
(3)Zn(或Fe等,合理即可)
(4)H2SO4、Na2SO4、CuSO4、ZnSO4[与(3)对应合理即可]
(1)紫色石蕊溶液遇酸性溶液变红,稀盐酸显酸性,1孔的现象是紫色石蕊溶液变为红色;无色酚酞溶液遇酸性溶液不变色,稀硫酸显酸性,4孔的现象是无色酚酞溶液不变色。(2)B试管中氧化铜与稀硫酸反应生成硫酸铜和水,实验现象是黑色粉末逐渐溶解,溶液变为蓝色。(3)酸能与活泼金属反应生成盐和氢气,C试管中能与酸反应的固体单质是锌或铁等金属,其化学式为Zn或Fe等。(4)将A、B、C三支试管中的废液倒入废液缸内,测得pH=2,说明溶液显酸性,稀硫酸有剩余,废液中还一定含有硫酸钠、硫酸铜、硫酸锌(或硫酸亚铁等),其化学式为H2SO4、Na2SO4、CuSO4、ZnSO4(或FeSO4等)。
12.(1)0.08
(2)解:设10 g稀硫酸中含硫酸的质量为x。
Fe+H2SO4FeSO4+H2↑
98 2
x 0.04 g
= x=1.96 g
稀硫酸中溶质的质量分数为×100%=19.6%。
答:原稀硫酸中溶质的质量分数为19.6%。
13.(1)①品红溶液褪色
Zn+2H2SO4(浓)ZnSO4+2H2O+SO2↑
②随着硫酸的消耗和水的生成,浓硫酸变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气
(2)会产生大量的有毒气体二氧化硫,污染空气
