粤教版化学九年级下册同步提优训练 8.3 酸和碱的反应(word版有答案)
文档属性
| 名称 | 粤教版化学九年级下册同步提优训练 8.3 酸和碱的反应(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 136.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 00:00:00 | ||
图片预览


文档简介
数学
化学
8.3 酸和碱的反应
判断正误:(在括号内打“√”或“×”)
(1)中和反应的反应物一定是酸和碱 ( )
(2)生成盐和水的反应一定是中和反应 ( )
(3)用盐酸除铁锈利用了中和反应的原理( )
(4)NaOH可用来改良酸性土壤( )
(5)中和反应属于基本反应类型( )
(6)中和反应都没有现象 ( )
(7)中和反应的实质是H+和OH—结合生成水分子 ( )
[核心知识]
1.中和反应:酸跟碱生成盐和水的反应。
2.中和反应的实质:H++OH-H2O。
[易错点拨]
1.生成盐和水的反应不一定是中和反应。
2.中和反应属于复分解反应。
3.不是所有的碱都能用于改良酸性土壤或治疗胃酸过多。
1.下列各组物质之间的反应必须通过滴加指示剂才能观察到的是 ( )
A.Fe和稀硫酸
B.Ca(OH)2溶液和稀盐酸
C.稀硫酸和Na2CO3溶液
D.CuO与稀硫酸
2.下列有关酸和碱的说法不正确的是 ( )
A.用酚酞溶液检验溶液是否显酸性
B.浓氢氧化钠溶液不慎沾到皮肤上,立即用大量的水冲洗,然后再涂上硼酸溶液
C.NaOH溶液和澄清石灰水都能使酚酞溶液变红,其原因是二者的溶液中均含有OH-
D.向久置空气中的澄清石灰水中滴入足量稀盐酸,产生气泡
3.如图是酸与碱溶液反应的示意图,下列关于酸和碱反应的说法中正确的是 ( )
A.酸碱中和反应的实质是氢离子和氢氧根离子结合生成水分子
B.生成盐和水的反应都是中和反应
C.当酸和碱完全中和时,两者所用质量一定相等
D.当酸和碱完全中和时,所得盐溶液pH等于0
4.中和反应在生活和生产中有广泛的应用,下列做法不是利用中和反应原理的是 ( )
A.用熟石灰改良酸性土壤
B.用含氢氧化镁的药物治疗胃酸过多
C.用盐酸除去铁锈
D.用氨水(NH3·H2O)处理工厂污水中的硫酸
5.[2021·苏州] 如图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线。下列说法不正确的是 ( )
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中
B.a点到b点pH变化的原因是H+和OH-发生反应
C.b点时,参加反应的HCl与NaOH的质量比为36.5∶40
D.c点时,溶液中的Na+个数大于Cl-个数
6.下列反应属于中和反应的是 ( )
A.CuO+2HClCuCl2+H2O B.Ca(OH)2+CO2CaCO3↓+H2O
C.Na2CO3+2HCl2NaCl+H2O+CO2↑ D.2HCl+Ca(OH)2CaCl2+2H2O
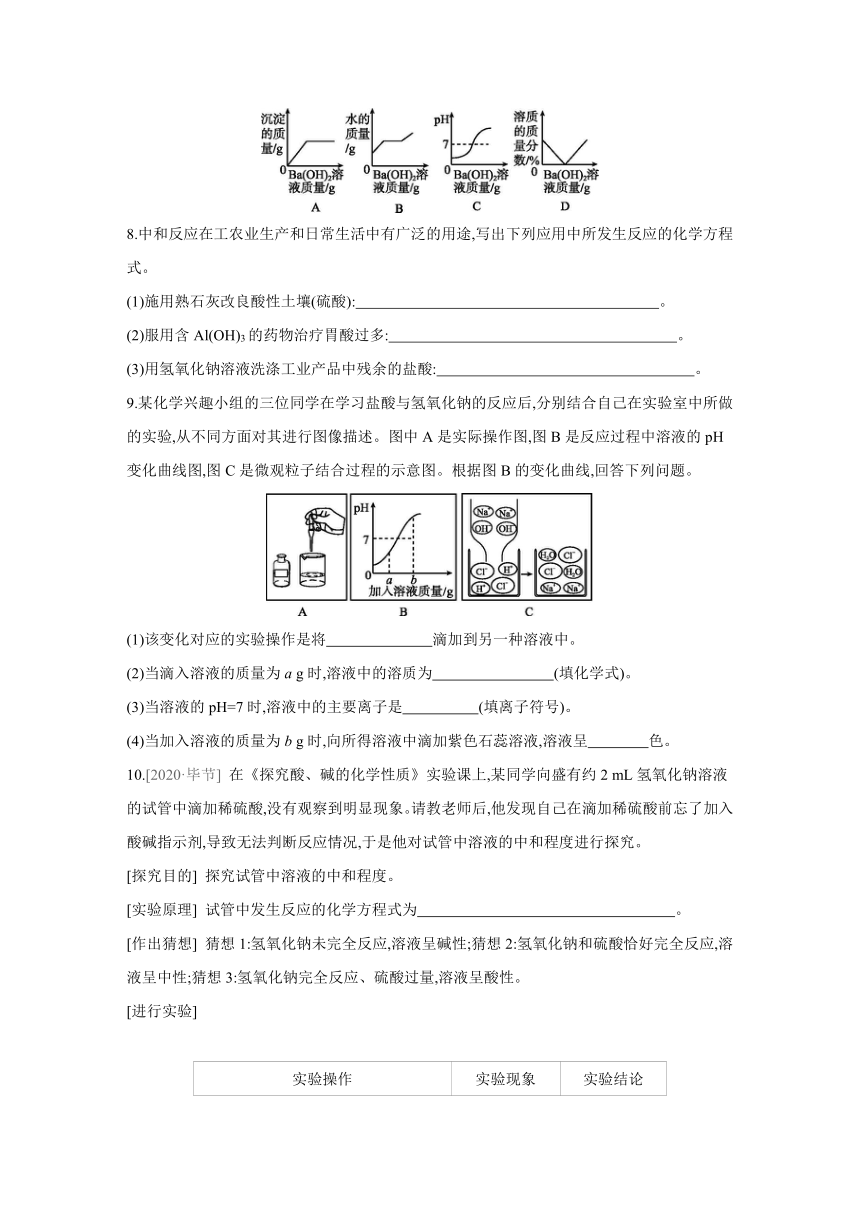
7.向盛有稀硫酸的小烧杯中逐滴滴加稀Ba(OH)2溶液至过量。有关量的变化情况如图所示。其中肯定不正确的是 ( )
8.中和反应在工农业生产和日常生活中有广泛的用途,写出下列应用中所发生反应的化学方程式。
(1)施用熟石灰改良酸性土壤(硫酸): 。
(2)服用含Al(OH)3的药物治疗胃酸过多: 。
(3)用氢氧化钠溶液洗涤工业产品中残余的盐酸: 。
9.某化学兴趣小组的三位同学在学习盐酸与氢氧化钠的反应后,分别结合自己在实验室中所做的实验,从不同方面对其进行图像描述。图中A是实际操作图,图B是反应过程中溶液的pH变化曲线图,图C是微观粒子结合过程的示意图。根据图B的变化曲线,回答下列问题。
(1)该变化对应的实验操作是将 滴加到另一种溶液中。
(2)当滴入溶液的质量为a g时,溶液中的溶质为 (填化学式)。
(3)当溶液的pH=7时,溶液中的主要离子是 (填离子符号)。
(4)当加入溶液的质量为b g时,向所得溶液中滴加紫色石蕊溶液,溶液呈 色。
10.[2020·毕节] 在《探究酸、碱的化学性质》实验课上,某同学向盛有约2 mL氢氧化钠溶液的试管中滴加稀硫酸,没有观察到明显现象。请教老师后,他发现自己在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况,于是他对试管中溶液的中和程度进行探究。
[探究目的] 探究试管中溶液的中和程度。
[实验原理] 试管中发生反应的化学方程式为 。
[作出猜想] 猜想1:氢氧化钠未完全反应,溶液呈碱性;猜想2:氢氧化钠和硫酸恰好完全反应,溶液呈中性;猜想3:氢氧化钠完全反应、硫酸过量,溶液呈酸性。
[进行实验]
实验操作 实验现象 实验结论
另用试管取该溶液1~2 mL,滴入1~2滴无色酚酞溶液,振荡 溶液变 溶液呈碱性
溶液不变色 溶液呈酸性或中性
[分析思考] (1)若溶液呈碱性,向试管里的溶液中逐滴加入FeCl3溶液,将产生红褐色沉淀,反应的化学方程式为 。
(2)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
方案1 用pH试纸测其酸碱度,若pH (填“>”“<”或“=”)7,则溶液呈酸性
方案2 加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为
11.[2021·陕西] 学习小组的同学通过如图所示实验测定一瓶失去标签的稀硫酸中溶质的质量分数。请完成下列分析与计算。
(1)反应中用去稀硫酸的质量为 。
(2)计算稀硫酸中溶质的质量分数。
12.在氢氧化钠溶液中加入一定量的稀盐酸后,下列能证明两者恰好完全中和的是 ( )
A.滴入适量 FeCl3 溶液,溶液变黄,但无沉淀生成
B.滴入几滴酚酞溶液,酚酞溶液不变色
C.测得反应后溶液中 Na+与 Cl-的个数比为 1∶1
D.滴入适量 AgNO3溶液和稀硝酸,观察到产生白色沉淀
答案
(1)√ (2)× (3)× (4)× (5)× (6)× (7)√
[应考能力提升练]
1.B 2.A
3.A 中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如用稀盐酸除铁锈,生成氯化铁和水,但该反应不是中和反应;当酸和碱完全中和时,所用酸和碱的质量不一定相等;氢氧化钠溶液和盐酸完全中和时,生成氯化钠和水,氯化钠溶液为中性,pH等于7。
4.C 铁锈的主要成分是氧化铁,不是碱,与盐酸反应不是中和反应。
5.D 由图像可知,溶液的pH逐渐减小,是将稀盐酸逐滴滴入稀氢氧化钠溶液中;a点到b点pH发生变化,说明氢氧化钠与盐酸发生反应,实质是H+和OH-结合生成水分子;b点时,二者恰好完全反应,参加反应的HCl与NaOH的质量比为36.5∶40;c点时,盐酸过量,溶液中的Na+个数小于Cl-个数。
6.D
7.B 逐滴滴加Ba(OH)2溶液至过量,水的质量不断增加,不会出现不变的情况。
8.(1)Ca(OH)2+H2SO4CaSO4+2H2O
(2)Al(OH)3+3HClAlCl3+3H2O
(3)NaOH+HClNaCl+H2O
9.(1)氢氧化钠溶液
(2)HCl、NaCl
(3)Na+、Cl-
(4)蓝
10.[实验原理] 2NaOH+H2SO4Na2SO4+2H2O
[进行实验] 红
[分析思考] (1)3NaOH+FeCl3Fe(OH)3↓+3NaCl
(2)< Zn+H2SO4ZnSO4+H2↑
11.(1)20 g
(2)解:设稀硫酸中溶质的质量分数为x。
H2SO4+2NaOHNa2SO4+2H2O
98 80
20 g×x 20 g×20%
= x=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
12.C 滴入适量FeCl3溶液,如果盐酸过量也不会有沉淀生成;酚酞溶液在酸性或中性条件下均不变色,滴入几滴酚酞溶液,如果盐酸过量也不会变色;只要加入AgNO3溶液,Cl-就会和Ag+结合生成沉淀。
化学
8.3 酸和碱的反应
判断正误:(在括号内打“√”或“×”)
(1)中和反应的反应物一定是酸和碱 ( )
(2)生成盐和水的反应一定是中和反应 ( )
(3)用盐酸除铁锈利用了中和反应的原理( )
(4)NaOH可用来改良酸性土壤( )
(5)中和反应属于基本反应类型( )
(6)中和反应都没有现象 ( )
(7)中和反应的实质是H+和OH—结合生成水分子 ( )
[核心知识]
1.中和反应:酸跟碱生成盐和水的反应。
2.中和反应的实质:H++OH-H2O。
[易错点拨]
1.生成盐和水的反应不一定是中和反应。
2.中和反应属于复分解反应。
3.不是所有的碱都能用于改良酸性土壤或治疗胃酸过多。
1.下列各组物质之间的反应必须通过滴加指示剂才能观察到的是 ( )
A.Fe和稀硫酸
B.Ca(OH)2溶液和稀盐酸
C.稀硫酸和Na2CO3溶液
D.CuO与稀硫酸
2.下列有关酸和碱的说法不正确的是 ( )
A.用酚酞溶液检验溶液是否显酸性
B.浓氢氧化钠溶液不慎沾到皮肤上,立即用大量的水冲洗,然后再涂上硼酸溶液
C.NaOH溶液和澄清石灰水都能使酚酞溶液变红,其原因是二者的溶液中均含有OH-
D.向久置空气中的澄清石灰水中滴入足量稀盐酸,产生气泡
3.如图是酸与碱溶液反应的示意图,下列关于酸和碱反应的说法中正确的是 ( )
A.酸碱中和反应的实质是氢离子和氢氧根离子结合生成水分子
B.生成盐和水的反应都是中和反应
C.当酸和碱完全中和时,两者所用质量一定相等
D.当酸和碱完全中和时,所得盐溶液pH等于0
4.中和反应在生活和生产中有广泛的应用,下列做法不是利用中和反应原理的是 ( )
A.用熟石灰改良酸性土壤
B.用含氢氧化镁的药物治疗胃酸过多
C.用盐酸除去铁锈
D.用氨水(NH3·H2O)处理工厂污水中的硫酸
5.[2021·苏州] 如图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线。下列说法不正确的是 ( )
A.实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中
B.a点到b点pH变化的原因是H+和OH-发生反应
C.b点时,参加反应的HCl与NaOH的质量比为36.5∶40
D.c点时,溶液中的Na+个数大于Cl-个数
6.下列反应属于中和反应的是 ( )
A.CuO+2HClCuCl2+H2O B.Ca(OH)2+CO2CaCO3↓+H2O
C.Na2CO3+2HCl2NaCl+H2O+CO2↑ D.2HCl+Ca(OH)2CaCl2+2H2O
7.向盛有稀硫酸的小烧杯中逐滴滴加稀Ba(OH)2溶液至过量。有关量的变化情况如图所示。其中肯定不正确的是 ( )
8.中和反应在工农业生产和日常生活中有广泛的用途,写出下列应用中所发生反应的化学方程式。
(1)施用熟石灰改良酸性土壤(硫酸): 。
(2)服用含Al(OH)3的药物治疗胃酸过多: 。
(3)用氢氧化钠溶液洗涤工业产品中残余的盐酸: 。
9.某化学兴趣小组的三位同学在学习盐酸与氢氧化钠的反应后,分别结合自己在实验室中所做的实验,从不同方面对其进行图像描述。图中A是实际操作图,图B是反应过程中溶液的pH变化曲线图,图C是微观粒子结合过程的示意图。根据图B的变化曲线,回答下列问题。
(1)该变化对应的实验操作是将 滴加到另一种溶液中。
(2)当滴入溶液的质量为a g时,溶液中的溶质为 (填化学式)。
(3)当溶液的pH=7时,溶液中的主要离子是 (填离子符号)。
(4)当加入溶液的质量为b g时,向所得溶液中滴加紫色石蕊溶液,溶液呈 色。
10.[2020·毕节] 在《探究酸、碱的化学性质》实验课上,某同学向盛有约2 mL氢氧化钠溶液的试管中滴加稀硫酸,没有观察到明显现象。请教老师后,他发现自己在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况,于是他对试管中溶液的中和程度进行探究。
[探究目的] 探究试管中溶液的中和程度。
[实验原理] 试管中发生反应的化学方程式为 。
[作出猜想] 猜想1:氢氧化钠未完全反应,溶液呈碱性;猜想2:氢氧化钠和硫酸恰好完全反应,溶液呈中性;猜想3:氢氧化钠完全反应、硫酸过量,溶液呈酸性。
[进行实验]
实验操作 实验现象 实验结论
另用试管取该溶液1~2 mL,滴入1~2滴无色酚酞溶液,振荡 溶液变 溶液呈碱性
溶液不变色 溶液呈酸性或中性
[分析思考] (1)若溶液呈碱性,向试管里的溶液中逐滴加入FeCl3溶液,将产生红褐色沉淀,反应的化学方程式为 。
(2)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
方案1 用pH试纸测其酸碱度,若pH (填“>”“<”或“=”)7,则溶液呈酸性
方案2 加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为
11.[2021·陕西] 学习小组的同学通过如图所示实验测定一瓶失去标签的稀硫酸中溶质的质量分数。请完成下列分析与计算。
(1)反应中用去稀硫酸的质量为 。
(2)计算稀硫酸中溶质的质量分数。
12.在氢氧化钠溶液中加入一定量的稀盐酸后,下列能证明两者恰好完全中和的是 ( )
A.滴入适量 FeCl3 溶液,溶液变黄,但无沉淀生成
B.滴入几滴酚酞溶液,酚酞溶液不变色
C.测得反应后溶液中 Na+与 Cl-的个数比为 1∶1
D.滴入适量 AgNO3溶液和稀硝酸,观察到产生白色沉淀
答案
(1)√ (2)× (3)× (4)× (5)× (6)× (7)√
[应考能力提升练]
1.B 2.A
3.A 中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如用稀盐酸除铁锈,生成氯化铁和水,但该反应不是中和反应;当酸和碱完全中和时,所用酸和碱的质量不一定相等;氢氧化钠溶液和盐酸完全中和时,生成氯化钠和水,氯化钠溶液为中性,pH等于7。
4.C 铁锈的主要成分是氧化铁,不是碱,与盐酸反应不是中和反应。
5.D 由图像可知,溶液的pH逐渐减小,是将稀盐酸逐滴滴入稀氢氧化钠溶液中;a点到b点pH发生变化,说明氢氧化钠与盐酸发生反应,实质是H+和OH-结合生成水分子;b点时,二者恰好完全反应,参加反应的HCl与NaOH的质量比为36.5∶40;c点时,盐酸过量,溶液中的Na+个数小于Cl-个数。
6.D
7.B 逐滴滴加Ba(OH)2溶液至过量,水的质量不断增加,不会出现不变的情况。
8.(1)Ca(OH)2+H2SO4CaSO4+2H2O
(2)Al(OH)3+3HClAlCl3+3H2O
(3)NaOH+HClNaCl+H2O
9.(1)氢氧化钠溶液
(2)HCl、NaCl
(3)Na+、Cl-
(4)蓝
10.[实验原理] 2NaOH+H2SO4Na2SO4+2H2O
[进行实验] 红
[分析思考] (1)3NaOH+FeCl3Fe(OH)3↓+3NaCl
(2)< Zn+H2SO4ZnSO4+H2↑
11.(1)20 g
(2)解:设稀硫酸中溶质的质量分数为x。
H2SO4+2NaOHNa2SO4+2H2O
98 80
20 g×x 20 g×20%
= x=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
12.C 滴入适量FeCl3溶液,如果盐酸过量也不会有沉淀生成;酚酞溶液在酸性或中性条件下均不变色,滴入几滴酚酞溶液,如果盐酸过量也不会变色;只要加入AgNO3溶液,Cl-就会和Ag+结合生成沉淀。
