粤教版化学九年级下册同步提优训练 实验五 一定溶质质量分数的氯化钠溶液的配制和粗盐中难溶性杂质的去除((word版 含答案)
文档属性
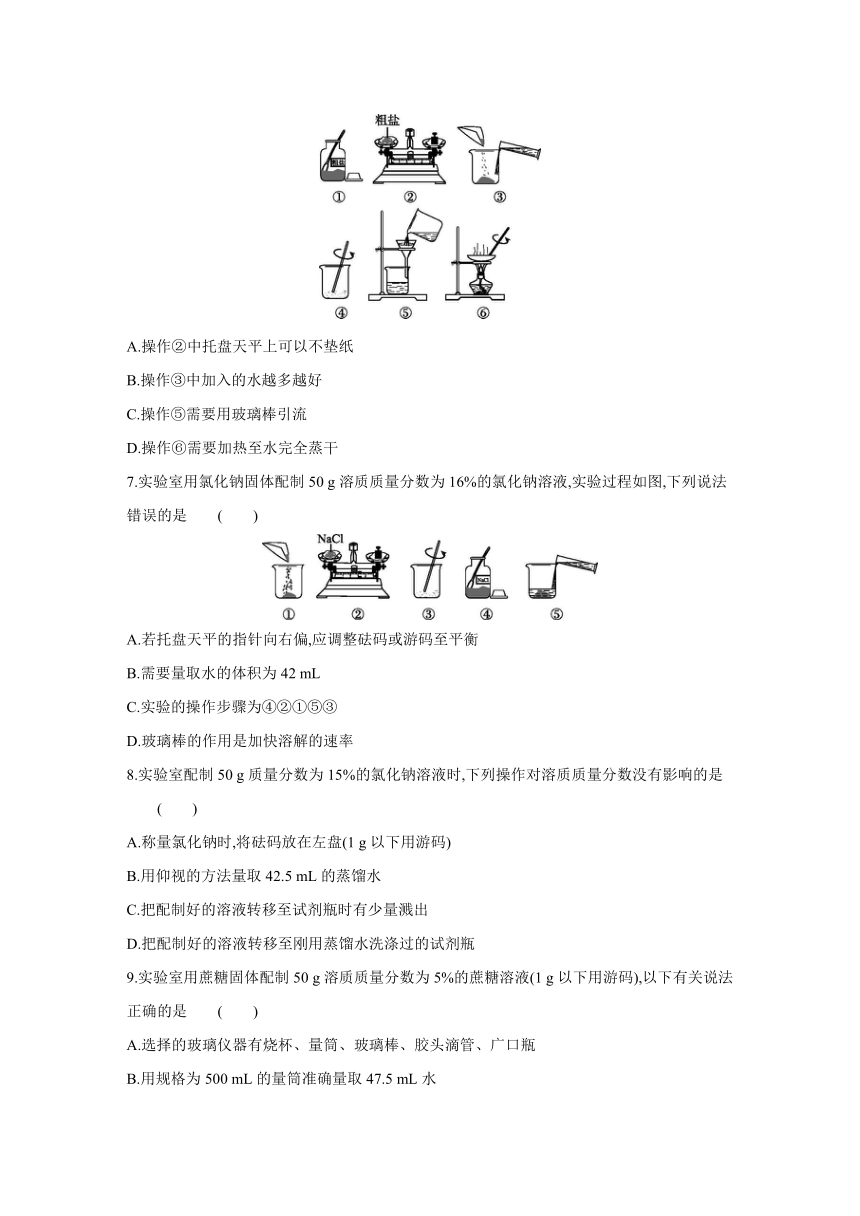
| 名称 | 粤教版化学九年级下册同步提优训练 实验五 一定溶质质量分数的氯化钠溶液的配制和粗盐中难溶性杂质的去除((word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 214.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 00:00:00 | ||
图片预览

文档简介
数学
化学
实验五 一定溶质质量分数的氯化钠溶液的配制和
粗盐中难溶性杂质的去除
1.在“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中都能使用到的是 ( )
A.烧杯、玻璃棒、托盘天平、量筒 B.烧杯、玻璃棒、托盘天平、试管
C.托盘天平、量筒、烧杯、漏斗 D.蒸发皿、酒精灯、烧杯、铁架台
2.粗盐提纯实验和配制一定溶质质量分数的氯化钠溶液实验中,下列操作正确的是 ( )
3.有关“粗盐中难溶性杂质的去除”实验,说法错误的是 ( )
A.多加水,可让粗盐加速溶解
B.过滤时,有滤液溅出,会使精盐产率偏低
C.当蒸发皿中出现较多固体时,停止加热
D.粗盐经过溶解、过滤、蒸发、结晶得到的精盐仍为混合物
4.20 ℃时,氯化钠的溶解度是36 g。现称取10 g粗盐,经溶解、过滤、蒸发、转移等操作,得到精盐。下列操作正确且合理的是 ( )
5.下列过滤操作及其解释中,不正确的是 ( )
A.滤纸要紧贴在漏斗内壁上——加快过滤速度
B.滤纸高于漏斗边缘——增加漏斗盛放液体的体积
C.玻璃棒要轻靠在三层滤纸处——防止弄破滤纸
D.漏斗下端要紧靠在烧杯内壁上——防止滤液溅出
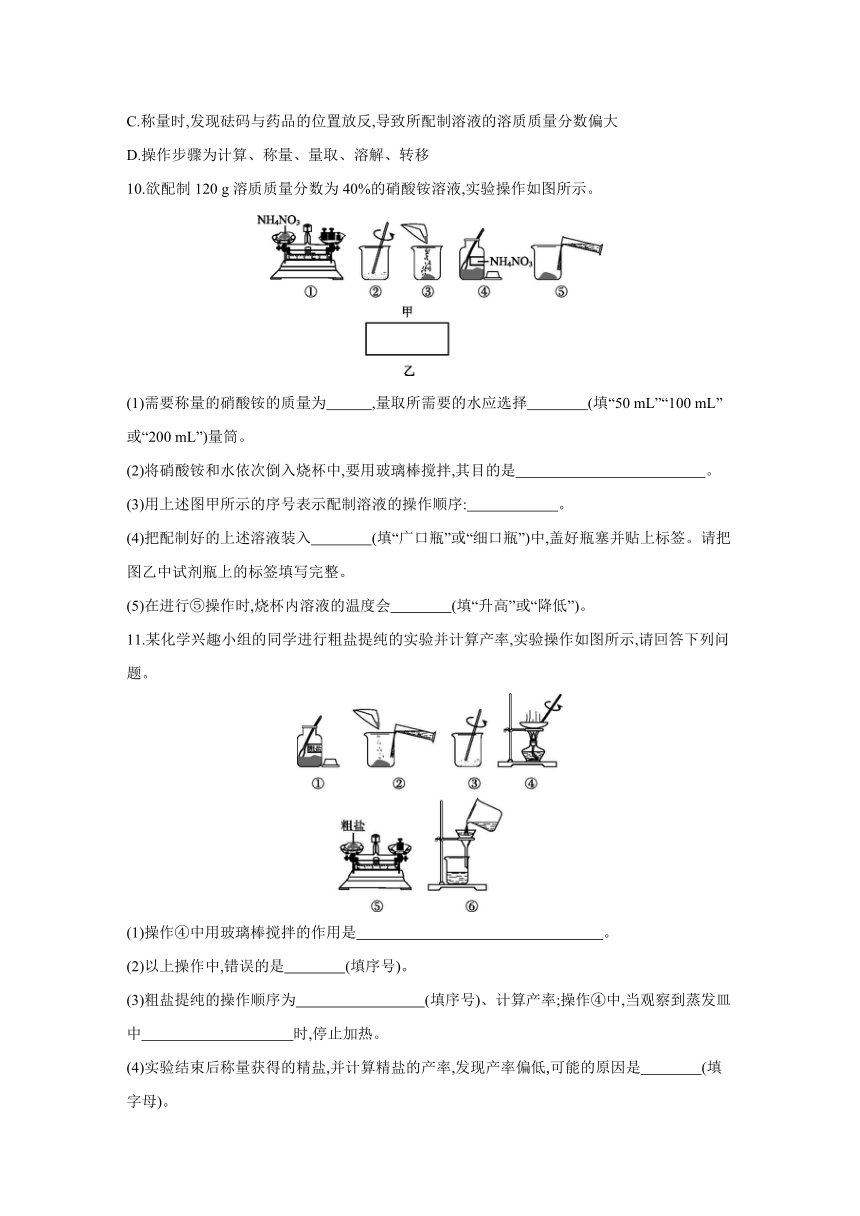
6.化学兴趣小组的同学做粗盐(只含难溶性杂质)提纯实验,下列说法正确的是 ( )
A.操作②中托盘天平上可以不垫纸
B.操作③中加入的水越多越好
C.操作⑤需要用玻璃棒引流
D.操作⑥需要加热至水完全蒸干
7.实验室用氯化钠固体配制50 g溶质质量分数为16%的氯化钠溶液,实验过程如图,下列说法错误的是 ( )
A.若托盘天平的指针向右偏,应调整砝码或游码至平衡
B.需要量取水的体积为42 mL
C.实验的操作步骤为④②①⑤③
D.玻璃棒的作用是加快溶解的速率
8.实验室配制50 g质量分数为15%的氯化钠溶液时,下列操作对溶质质量分数没有影响的是 ( )
A.称量氯化钠时,将砝码放在左盘(1 g以下用游码)
B.用仰视的方法量取42.5 mL的蒸馏水
C.把配制好的溶液转移至试剂瓶时有少量溅出
D.把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶
9.实验室用蔗糖固体配制50 g溶质质量分数为5%的蔗糖溶液(1 g以下用游码),以下有关说法正确的是 ( )
A.选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、广口瓶
B.用规格为500 mL的量筒准确量取47.5 mL水
C.称量时,发现砝码与药品的位置放反,导致所配制溶液的溶质质量分数偏大
D.操作步骤为计算、称量、量取、溶解、转移
10.欲配制120 g溶质质量分数为40%的硝酸铵溶液,实验操作如图所示。
(1)需要称量的硝酸铵的质量为 ,量取所需要的水应选择 (填“50 mL”“100 mL”或“200 mL”)量筒。
(2)将硝酸铵和水依次倒入烧杯中,要用玻璃棒搅拌,其目的是 。
(3)用上述图甲所示的序号表示配制溶液的操作顺序: 。
(4)把配制好的上述溶液装入 (填“广口瓶”或“细口瓶”)中,盖好瓶塞并贴上标签。请把图乙中试剂瓶上的标签填写完整。
(5)在进行⑤操作时,烧杯内溶液的温度会 (填“升高”或“降低”)。
11.某化学兴趣小组的同学进行粗盐提纯的实验并计算产率,实验操作如图所示,请回答下列问题。
(1)操作④中用玻璃棒搅拌的作用是 。
(2)以上操作中,错误的是 (填序号)。
(3)粗盐提纯的操作顺序为 (填序号)、计算产率;操作④中,当观察到蒸发皿中 时,停止加热。
(4)实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,可能的原因是 (填字母)。
A.粗盐没有全部溶解即过滤
B.过滤时滤液高于滤纸的边缘
C.蒸发后,所得精盐很潮湿
D.蒸发皿上沾有的精盐没有全部转移到称量纸上
12.某实验小组利用图所示仪器进行“配制一定质量分数的氯化钠溶液”的实验。
(1)完成此实验正确的操作顺序是 (填序号)。
①溶解
②把配好的溶液装入试剂瓶
③称量(量取)
④计算
(2)按实验要求,图Ⅰ中还缺少的玻璃仪器是 (填名称)。
(3)小婧按图Ⅱ的操作称取氯化钠,小民发现小婧的操作有错误,你认为小婧操作中的错误是 ;她称取的氯化钠实际质量为 g。(该托盘天平5 g以下用游码)
(4)小民所取蒸馏水的体积如图Ⅲ所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为 (水的密度约为1 g·cm-3)。其他小组配制的氯化钠溶液的质量分数偏小,则造成这种结果的原因可能有(至少举出三点):
① ;
② ;
③ 。
详解
1.A
2.D 过滤液体时,漏斗下端要紧靠在烧杯壁上,用玻璃棒引流;不能用手拿正在加热的蒸发皿,以免烫伤;使用托盘天平时应该“左物右码”;量筒读数时,视线与凹液面的最低处保持水平。
3.A
4.D 20 ℃时,氯化钠的溶解度是36 g,加入20 mL水,10 g粗盐中的氯化钠可能不会全部溶解;过滤时漏斗的尖端要靠在烧杯内壁上;加热蒸发皿不用垫上石棉网。
5.B 滤纸的边缘应低于漏斗的边缘,防止液体从漏斗外流下。
6.C 药品不能直接放到天平上称量;加入的水使氯化钠全部溶解,但不能过多,若水的量太多,过滤、蒸发需要的时间太长;蒸发时观察到有较多的固体析出时停止加热,利用蒸发皿的余温将剩余的水蒸发掉。
7.A 托盘天平指针向右偏转,说明药品的质量小于所需的质量,应继续向左盘添加氯化钠,直至天平平衡;溶质质量=溶液质量×溶质的质量分数,配制50 g溶质质量分数为16%的氯化钠溶液,需氯化钠的质量为50 g×16%=8 g,溶剂质量=溶液质量-溶质质量,则所需水的质量为50 g-8 g=42 g,即42 mL;配制溶液时,先计算所需的氯化钠和水的质量,用药匙取用氯化钠放在天平上称量,之后将氯化钠倒入烧杯,加入量取好的水,然后用玻璃棒搅拌,加快氯化钠的溶解速率。
8.C 称量氯化钠时,将砝码放在左盘(1 g以下用游码),即砝码和氯化钠放反了,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小;用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小;溶液具有均一性,把配制好的溶液转移至试剂瓶时有少量溅出,溶质质量分数不变;把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶中,相当于稀释溶液,使溶质质量分数偏小。
9.D 溶液配制过程中需要用到的玻璃仪器是量筒、烧杯、玻璃棒、胶头滴管、细口瓶,广口瓶用于盛放固体药品;所需溶质的质量为50 g×5%=2.5 g,需要水的质量为50 g-2.5 g=47.5 g,则水的体积为47.5 mL,应选择50 mL的量筒来量取;用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量过程中使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
10.(1)48 g 100 mL
(2)加速溶解
(3)④①③⑤②
(4)细口瓶
(5)降低
11.(1)防止液体局部温度过高,造成液滴飞溅
(2)⑥
(3)①⑤②③⑥④ 有较多的固体析出
(4)AD
12.(1)④③①②
(2)玻璃棒
(3)药品和砝码的位置放反 12.0
(4)18%
①用量筒量取水时,仰视液面读数
②用托盘天平称量氯化钠时,砝码和氯化钠放反了,且使用了游码
③氯化钠固体中含有杂质(合理即可)
(3)由图示可以看出托盘天平的使用错误,物码放反了,由正确称量:“物质质量=砝码质量+游码质量”得出,药品实际质量=砝码质量-游码质量=15 g-3 g=12 g。(4)由图中所示数据可得,所量取水的体积为82 mL,则水的质量为82 mL×1 g/mL=82 g。由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为10 g+5 g+3 g=18 g,原计划配制溶液质量为82 g+18 g=100 g,则溶质质量分数为18 g÷100 g×100%=18%。用量筒量取水时,仰视液面读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;用托盘天平称量氯化钠时,砝码和氯化钠放反了,且使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;氯化钠固体中含有杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小(合理即可)。
化学
实验五 一定溶质质量分数的氯化钠溶液的配制和
粗盐中难溶性杂质的去除
1.在“一定溶质质量分数的氯化钠溶液的配制”和“粗盐中难溶性杂质的去除”两个实验中都能使用到的是 ( )
A.烧杯、玻璃棒、托盘天平、量筒 B.烧杯、玻璃棒、托盘天平、试管
C.托盘天平、量筒、烧杯、漏斗 D.蒸发皿、酒精灯、烧杯、铁架台
2.粗盐提纯实验和配制一定溶质质量分数的氯化钠溶液实验中,下列操作正确的是 ( )
3.有关“粗盐中难溶性杂质的去除”实验,说法错误的是 ( )
A.多加水,可让粗盐加速溶解
B.过滤时,有滤液溅出,会使精盐产率偏低
C.当蒸发皿中出现较多固体时,停止加热
D.粗盐经过溶解、过滤、蒸发、结晶得到的精盐仍为混合物
4.20 ℃时,氯化钠的溶解度是36 g。现称取10 g粗盐,经溶解、过滤、蒸发、转移等操作,得到精盐。下列操作正确且合理的是 ( )
5.下列过滤操作及其解释中,不正确的是 ( )
A.滤纸要紧贴在漏斗内壁上——加快过滤速度
B.滤纸高于漏斗边缘——增加漏斗盛放液体的体积
C.玻璃棒要轻靠在三层滤纸处——防止弄破滤纸
D.漏斗下端要紧靠在烧杯内壁上——防止滤液溅出
6.化学兴趣小组的同学做粗盐(只含难溶性杂质)提纯实验,下列说法正确的是 ( )
A.操作②中托盘天平上可以不垫纸
B.操作③中加入的水越多越好
C.操作⑤需要用玻璃棒引流
D.操作⑥需要加热至水完全蒸干
7.实验室用氯化钠固体配制50 g溶质质量分数为16%的氯化钠溶液,实验过程如图,下列说法错误的是 ( )
A.若托盘天平的指针向右偏,应调整砝码或游码至平衡
B.需要量取水的体积为42 mL
C.实验的操作步骤为④②①⑤③
D.玻璃棒的作用是加快溶解的速率
8.实验室配制50 g质量分数为15%的氯化钠溶液时,下列操作对溶质质量分数没有影响的是 ( )
A.称量氯化钠时,将砝码放在左盘(1 g以下用游码)
B.用仰视的方法量取42.5 mL的蒸馏水
C.把配制好的溶液转移至试剂瓶时有少量溅出
D.把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶
9.实验室用蔗糖固体配制50 g溶质质量分数为5%的蔗糖溶液(1 g以下用游码),以下有关说法正确的是 ( )
A.选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、广口瓶
B.用规格为500 mL的量筒准确量取47.5 mL水
C.称量时,发现砝码与药品的位置放反,导致所配制溶液的溶质质量分数偏大
D.操作步骤为计算、称量、量取、溶解、转移
10.欲配制120 g溶质质量分数为40%的硝酸铵溶液,实验操作如图所示。
(1)需要称量的硝酸铵的质量为 ,量取所需要的水应选择 (填“50 mL”“100 mL”或“200 mL”)量筒。
(2)将硝酸铵和水依次倒入烧杯中,要用玻璃棒搅拌,其目的是 。
(3)用上述图甲所示的序号表示配制溶液的操作顺序: 。
(4)把配制好的上述溶液装入 (填“广口瓶”或“细口瓶”)中,盖好瓶塞并贴上标签。请把图乙中试剂瓶上的标签填写完整。
(5)在进行⑤操作时,烧杯内溶液的温度会 (填“升高”或“降低”)。
11.某化学兴趣小组的同学进行粗盐提纯的实验并计算产率,实验操作如图所示,请回答下列问题。
(1)操作④中用玻璃棒搅拌的作用是 。
(2)以上操作中,错误的是 (填序号)。
(3)粗盐提纯的操作顺序为 (填序号)、计算产率;操作④中,当观察到蒸发皿中 时,停止加热。
(4)实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,可能的原因是 (填字母)。
A.粗盐没有全部溶解即过滤
B.过滤时滤液高于滤纸的边缘
C.蒸发后,所得精盐很潮湿
D.蒸发皿上沾有的精盐没有全部转移到称量纸上
12.某实验小组利用图所示仪器进行“配制一定质量分数的氯化钠溶液”的实验。
(1)完成此实验正确的操作顺序是 (填序号)。
①溶解
②把配好的溶液装入试剂瓶
③称量(量取)
④计算
(2)按实验要求,图Ⅰ中还缺少的玻璃仪器是 (填名称)。
(3)小婧按图Ⅱ的操作称取氯化钠,小民发现小婧的操作有错误,你认为小婧操作中的错误是 ;她称取的氯化钠实际质量为 g。(该托盘天平5 g以下用游码)
(4)小民所取蒸馏水的体积如图Ⅲ所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为 (水的密度约为1 g·cm-3)。其他小组配制的氯化钠溶液的质量分数偏小,则造成这种结果的原因可能有(至少举出三点):
① ;
② ;
③ 。
详解
1.A
2.D 过滤液体时,漏斗下端要紧靠在烧杯壁上,用玻璃棒引流;不能用手拿正在加热的蒸发皿,以免烫伤;使用托盘天平时应该“左物右码”;量筒读数时,视线与凹液面的最低处保持水平。
3.A
4.D 20 ℃时,氯化钠的溶解度是36 g,加入20 mL水,10 g粗盐中的氯化钠可能不会全部溶解;过滤时漏斗的尖端要靠在烧杯内壁上;加热蒸发皿不用垫上石棉网。
5.B 滤纸的边缘应低于漏斗的边缘,防止液体从漏斗外流下。
6.C 药品不能直接放到天平上称量;加入的水使氯化钠全部溶解,但不能过多,若水的量太多,过滤、蒸发需要的时间太长;蒸发时观察到有较多的固体析出时停止加热,利用蒸发皿的余温将剩余的水蒸发掉。
7.A 托盘天平指针向右偏转,说明药品的质量小于所需的质量,应继续向左盘添加氯化钠,直至天平平衡;溶质质量=溶液质量×溶质的质量分数,配制50 g溶质质量分数为16%的氯化钠溶液,需氯化钠的质量为50 g×16%=8 g,溶剂质量=溶液质量-溶质质量,则所需水的质量为50 g-8 g=42 g,即42 mL;配制溶液时,先计算所需的氯化钠和水的质量,用药匙取用氯化钠放在天平上称量,之后将氯化钠倒入烧杯,加入量取好的水,然后用玻璃棒搅拌,加快氯化钠的溶解速率。
8.C 称量氯化钠时,将砝码放在左盘(1 g以下用游码),即砝码和氯化钠放反了,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小;用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小;溶液具有均一性,把配制好的溶液转移至试剂瓶时有少量溅出,溶质质量分数不变;把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶中,相当于稀释溶液,使溶质质量分数偏小。
9.D 溶液配制过程中需要用到的玻璃仪器是量筒、烧杯、玻璃棒、胶头滴管、细口瓶,广口瓶用于盛放固体药品;所需溶质的质量为50 g×5%=2.5 g,需要水的质量为50 g-2.5 g=47.5 g,则水的体积为47.5 mL,应选择50 mL的量筒来量取;用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量过程中使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
10.(1)48 g 100 mL
(2)加速溶解
(3)④①③⑤②
(4)细口瓶
(5)降低
11.(1)防止液体局部温度过高,造成液滴飞溅
(2)⑥
(3)①⑤②③⑥④ 有较多的固体析出
(4)AD
12.(1)④③①②
(2)玻璃棒
(3)药品和砝码的位置放反 12.0
(4)18%
①用量筒量取水时,仰视液面读数
②用托盘天平称量氯化钠时,砝码和氯化钠放反了,且使用了游码
③氯化钠固体中含有杂质(合理即可)
(3)由图示可以看出托盘天平的使用错误,物码放反了,由正确称量:“物质质量=砝码质量+游码质量”得出,药品实际质量=砝码质量-游码质量=15 g-3 g=12 g。(4)由图中所示数据可得,所量取水的体积为82 mL,则水的质量为82 mL×1 g/mL=82 g。由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为10 g+5 g+3 g=18 g,原计划配制溶液质量为82 g+18 g=100 g,则溶质质量分数为18 g÷100 g×100%=18%。用量筒量取水时,仰视液面读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小;用托盘天平称量氯化钠时,砝码和氯化钠放反了,且使用了游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;氯化钠固体中含有杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小(合理即可)。
