3.1铁及其化合物(14页ppt)
文档属性
| 名称 | 3.1铁及其化合物(14页ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-30 11:42:22 | ||
图片预览






文档简介
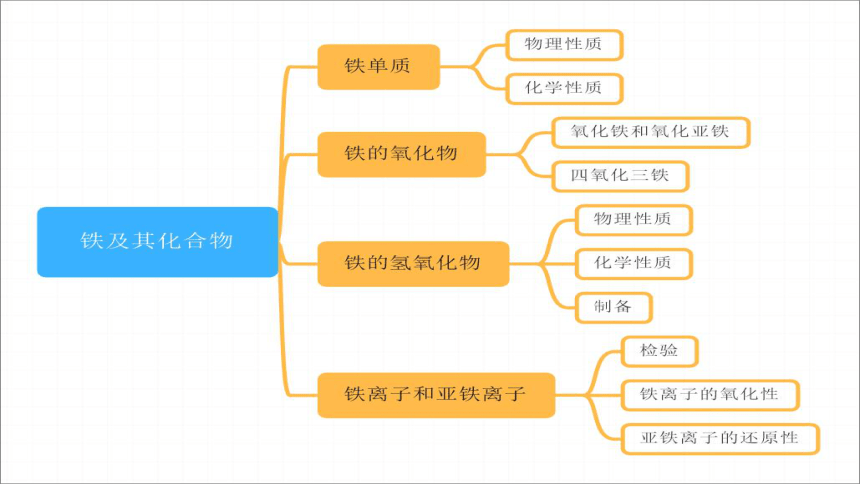
(共14张PPT)
3.1铁及其化合物
铁的物理性质
铁在地壳中的含量仅次于氧、硅、铝,位于第四位。是使用最广泛的金属。
铁有金属光泽、导热性、导电性、延展性等金属通性。能够被磁铁吸引。
铁的化学性质
1.与非金属单质反应
为什么铁的化合价不同
铁的化学性质
2.与水蒸气的反应
铁的化学性质
3.与非氧化性酸反应
4.与盐溶液的反应
氧化铁和氧化亚铁在分类上属于碱性氧化物,回忆一下碱性氧化物的定义
铁的氢氧化物
名称 氢氧化亚铁 氢氧化铁
化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
水溶性 难溶 难溶
与酸反应
稳定性 不稳定,在空气中迅速被氧化由白色变成灰绿色最后变成红褐色
常温下稳定,加热分解
制备
在隔绝氧气的条件下制备
Fe(OH)2的制备
Fe2+和Fe3+的检验
三价铁离子的检验
1.SCN- (硫氰根离子)法:取少量待测液于试管中,随后滴加无色
KSCN溶液,若溶液变成血红色,证明原溶液中有Fe2+
Fe3+ + 3SCN- Fe(SCN)3
2.碱液法:取少量待测液于试管中,随后滴加NaOH溶液,若产生红褐色沉淀,证明原溶液中有Fe2+
Fe3+ + 3OH- Fe(OH)3↓
Fe2+和Fe3+的检验
二价铁离子的检验
1.SCN- 氯水法:取少量待测液于试管中,随后滴加无色
KSCN溶液,若溶液不变红,再滴加氯水溶液变红,证明原溶液中有Fe2+
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- Fe3+ + 3SCN- Fe(SCN)3
2.碱液法:取少量待测液于试管中,随后滴加NaOH溶液,若产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,则证明原溶液中有Fe3+
如果Fe2+和Fe3+混合在一起如何检验
还原性:
K > Na > Mg > Al > Zn > Fe >. . . ( >H ) > Cu >Hg >Ag
氧化性:
K+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ <. . . (还原性:
S2- > SO32- > > Fe2+ > Br-> Cl- > OH-
氧化性:
S < SO32- < Ⅰ2 < Fe3+ < Br2 < Cl2
强氧化剂:KMnO4 H2SO4( 浓) HNO3 H2O2 HClO Cl2 O2
铁三角的转化关系
Fe2+
Fe3+
强氧化剂
H2SO4( 浓) HNO3 Cl2等
Al CO H2等
Cu2+ H+ S I2等弱氧化剂
Fe Zn Cu H2S KI 等
H2SO4( 浓) Cl2 O2 KMnO4 HNO3等
Al Zn等
含Fe2+ Fe3+溶液的除杂问题
主要成分 杂质 除杂方法
FeCl3 FeCl2 Cl2
FeCl2 FeCl3 还原Fe粉
FeCl2 CuCl2 还原Fe粉,再过滤,取滤液
3.1铁及其化合物
铁的物理性质
铁在地壳中的含量仅次于氧、硅、铝,位于第四位。是使用最广泛的金属。
铁有金属光泽、导热性、导电性、延展性等金属通性。能够被磁铁吸引。
铁的化学性质
1.与非金属单质反应
为什么铁的化合价不同
铁的化学性质
2.与水蒸气的反应
铁的化学性质
3.与非氧化性酸反应
4.与盐溶液的反应
氧化铁和氧化亚铁在分类上属于碱性氧化物,回忆一下碱性氧化物的定义
铁的氢氧化物
名称 氢氧化亚铁 氢氧化铁
化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
水溶性 难溶 难溶
与酸反应
稳定性 不稳定,在空气中迅速被氧化由白色变成灰绿色最后变成红褐色
常温下稳定,加热分解
制备
在隔绝氧气的条件下制备
Fe(OH)2的制备
Fe2+和Fe3+的检验
三价铁离子的检验
1.SCN- (硫氰根离子)法:取少量待测液于试管中,随后滴加无色
KSCN溶液,若溶液变成血红色,证明原溶液中有Fe2+
Fe3+ + 3SCN- Fe(SCN)3
2.碱液法:取少量待测液于试管中,随后滴加NaOH溶液,若产生红褐色沉淀,证明原溶液中有Fe2+
Fe3+ + 3OH- Fe(OH)3↓
Fe2+和Fe3+的检验
二价铁离子的检验
1.SCN- 氯水法:取少量待测液于试管中,随后滴加无色
KSCN溶液,若溶液不变红,再滴加氯水溶液变红,证明原溶液中有Fe2+
2Fe2+ + Cl2 = 2Fe3+ + 2Cl- Fe3+ + 3SCN- Fe(SCN)3
2.碱液法:取少量待测液于试管中,随后滴加NaOH溶液,若产生白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,则证明原溶液中有Fe3+
如果Fe2+和Fe3+混合在一起如何检验
还原性:
K > Na > Mg > Al > Zn > Fe >. . . ( >H ) > Cu >Hg >Ag
氧化性:
K+ < Na+ < Mg2+ < Al3+ < Zn2+ < Fe2+ <. . . (
S2- > SO32- > > Fe2+ > Br-> Cl- > OH-
氧化性:
S < SO32- < Ⅰ2 < Fe3+ < Br2 < Cl2
强氧化剂:KMnO4 H2SO4( 浓) HNO3 H2O2 HClO Cl2 O2
铁三角的转化关系
Fe2+
Fe3+
强氧化剂
H2SO4( 浓) HNO3 Cl2等
Al CO H2等
Cu2+ H+ S I2等弱氧化剂
Fe Zn Cu H2S KI 等
H2SO4( 浓) Cl2 O2 KMnO4 HNO3等
Al Zn等
含Fe2+ Fe3+溶液的除杂问题
主要成分 杂质 除杂方法
FeCl3 FeCl2 Cl2
FeCl2 FeCl3 还原Fe粉
FeCl2 CuCl2 还原Fe粉,再过滤,取滤液
