8.3酸和碱的反应 -2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 8.3酸和碱的反应 -2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 159.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-31 11:02:25 | ||
图片预览




文档简介
科粤版九年级化学下册 8.3 酸和碱的反应
一、单选题
1.许多化学反应的发生离不开反应条件的支持,以下化学方程式的书写,来自同学们的作业中,其中反应条件错误的是
A. B.
C. D.
2.等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )
A.所用氢氧化钠溶液和稀盐酸的溶质质量分数相等
B.混合溶液中钠离子与氯离子个数相等
C.混合前后水分子总数不变
D.混合前后阳离子总数不变
3.下列反应属于中和反应的是( )
A.2HCl+CuO═CuCl2+H2O
B.2NaOH+CO2═Na2CO3+H2O
C.2HCl+Cu(OH)2═CuCl2+2H2O
D.CaO+H2O═Ca(OH)2
4.如图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH=0
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl
D.反应前后各元素的化合价均无变化
5.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
6.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
7.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
8.黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7 ) B.牙膏(pH≈9) C.肥皂(pH≈10 ) D.米醋(pH≈3)
9.下列区分物质的试剂或方法不正确的是
A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋
C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸
10.推理是化学学习的重要方法,下列推理正确的是
A.酸雨的pH小于5.6,则pH小于5.6的雨水一定是酸雨
B.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的一定是碱溶液
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
11.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
12.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
13.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是
A.La(OH)3和 HCl B.La2O3和 HCl
C.La 和 HCl D.NaCl 和 La(OH)3
14.室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关叙述错误的是
A.容器中发生的反应属于中和反应 B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应 D.c点溶液中的溶质是NaCl和NaOH
15.推理是学习化学的一种重要方法,下列推理合理的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则只含一种元素的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
16.在A+ B→盐+水的反应中,A和B不可能是
A.HCl和NaOH B.CO2和NaOH
C.H2SO4和Fe2O3 D.H2SO4和BaCl2
二、综合应用题
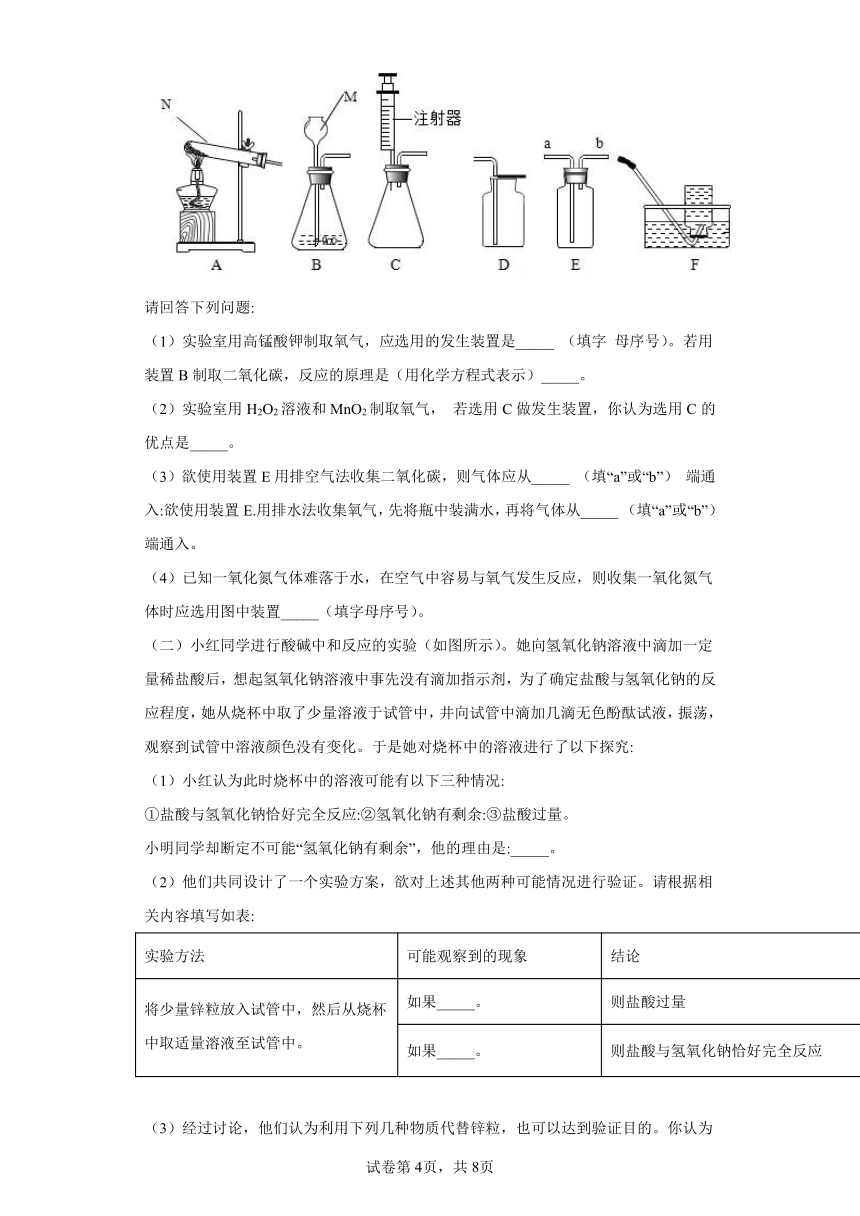
17.(一) 下图所示为实验室中常见的气体制备和收集装置.
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 可能观察到的现象 结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 如果_____。 则盐酸过量
如果_____。 则盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。
18.正常情况下人的胃液pH为0.8—1.5,相应含氯化氢的质量分数为0.2%—0.4%,胃液中氯化氢过多过少都不利于健康。某人出现反胃、吐酸水的症状,经检查其胃液中氯化氢的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_________性。
(2)若人的胃液总量为100mL,正常胃液中HCl的质量范围为___________________ g。
(3)服用碱性物质可以治疗胃液中HCl含量过多,你认为该患者 ___________ (填能或不能)服用熟石灰来治疗胃酸过多,理由是 ______________________________________ 。
(4)医生给患者开的药是胃舒平[有效成分是Al(OH)3],每片胃舒平含Al(OH)3 的质量为0.39g。请根据化学方程式计算该患者至少服用________片胃舒平,胃液才能恢复正常? (请写出计算过程)
19.化学与人类生产生活息息相关。
(1)下列物质的性质与应用关系不正确的是 _____ 。
A 氢氧化钠能与油脂反应,在生活中可用来除油污
B 人体缺少必需微量元素会得病,应合理补充微量元素
C 中和反应生成盐和水,那么生成盐和水的反应一定是中和反应
D 熟石灰具有碱性,可用于改良酸性土壤
(2)兴趣小组的同学借助无色酚酞溶液验证氢氧化钠和盐酸确实发生了反应,反应后溶液呈无色,甲同学认为氢氧化钠与盐酸恰好完全反应,乙同学认为甲同学的说法不准确,你觉得呢?说出你的猜想,并证明 _____ 。
(3)为探究一氧化碳还原氧化铁的实验,同学们设计如图的实验,并查阅了相关资料,仔细思考,回答下列问题。
【查阅资料】草酸晶体(H2C2O4 3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4 3H2OCO2↑+CO↑+4H2O
【问题讨论】
①D装置的化学反应方程式为 _____ 。
②进入D装置的气体是纯净、干燥的CO,则A、C装置中的试剂依次是 _____ 、 _____ (填名称)。
③请指出上述实验装置的一个明显缺陷,怎样改进实验装置 _____ 。
(4)将10g的铜一锌合金放入试管中,向其中加入49g质量分数为20%的稀硫酸,恰好完全反应,求:①生成氢气的质量 _____ 。②样品中锌的质量分数 _____ 。
20.实验室有一瓶标签破损的硫酸。为测定该瓶硫酸溶液的溶质质量分数,小强同学在烧杯中加入50g该硫酸,然后向烧杯中滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的滴入,溶液的pH变化情况如下表所示,请分析并计算:
氢氧化钠溶液的质量/g 溶液的pH 所得溶液
30 pH<7 a
40 pH =7 b
45 pH>7 c
(1)a、b、c三种溶液中只含一种溶质的是________。
(2)该瓶硫酸溶液的溶质质量分数是多少____ (写出解题过程)(H2SO4+2NaOH==Na2SO4+2H2O)
21.盐酸是重要的化工产。
(1)生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是___________________________________。
(2)如图从不同角度反映稀盐酸和氢氧化钠溶液进行的中和反应。图A是实际操作图,图B是反应过程中溶液的酸碱度变化图,图C是微观粒子结合过程的示意图。
①根据图B的曲线变化,该实验是将__________溶液滴加到另一种溶液中。当滴入的溶液质量为ag时,溶液中溶质的成分是______________(填化学式),下列物质中能证明此时溶液显酸性的是_______(填字母)。
a.酚酞溶液 b.锌粒 c.纯碱 d.氧化铁
②如图C表示该反应前后溶液中存在的主要离子,写出每种图形表示的离子(填离子符号)。
_______________________________。
③下列物质中能与氢氧化钾溶液发生如图C的类似反应的是_________(填字母)。
a.HNO3
b.CuSO4
c.CaCl2
d.AgNO3
22.金属、酸、碱是重要的化学物质,与人类日常生活和工农业生产关系十分密切。
(1)某同学为探究相关金属的化学性质,做了下列实验:
①只通过A和B实验尚不能证明银铜的活动性强弱,需补充一个实验来证明,应补充的实验是______。
②实验C中物质充分反应后溶液呈无色,过滤所得滤渣的成分是______。
(2)铁车架的表面刷油漆能防止锈蚀,其原因是______;用硫酸除铁锈(Fe2O3)的化学方程式为______。
(3)如图是盐酸和氢氧化钠反应的过程中,溶液pH的变化图象,请回答下列问题。
①写出氢氧化钠和盐酸反应的化学方程式______。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是______mL。
③向图中b点所示溶液中滴加酚酞溶液,溶液呈______色。
(4)某同学用50g稀盐酸与石灰石反应制取CO2气体,恰好完全反应后,得到溶质质量分数为20%的溶液55.5g,则该稀盐酸中溶质的质量分数是多少?
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.A
2.B
3.C
4.D
5.D
6.C
7.C
8.D
9.D
10.A
11.C
12.B
13.D
14.C
15.B
16.D
17. A 可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
18. 酸性 0.2—0.4g 不能 因为氢氧化钙有腐蚀性。 该患者至少服用2片胃舒平,胃液才能恢复正常。
19. C 甲同学的说法是不准确的。盐酸可能过量,取少量反应后的溶液于试管中,滴加紫色石蕊试液,紫色石蕊试液变红色,说明盐酸过量 3CO+Fe2O32Fe+3CO2 氢氧化钠溶液 浓硫酸 缺少尾气处理装置,应该在F装置末端放一燃着的酒精灯 0.2g 65%
20.(1)b(2)9.8%。
21. 铁锈逐渐消失,无色溶液变为黄色,有气泡产生 氢氧化钠溶液 NaCl、HCl bcd H+ Cl- a
22.(1) Cu和Ag NO3溶液反应。 Ag和Cu,可能有Zn。
(2) 隔绝空气中的氧气和水蒸气。
(3) 10 红色
(4)14.6%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.许多化学反应的发生离不开反应条件的支持,以下化学方程式的书写,来自同学们的作业中,其中反应条件错误的是
A. B.
C. D.
2.等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )
A.所用氢氧化钠溶液和稀盐酸的溶质质量分数相等
B.混合溶液中钠离子与氯离子个数相等
C.混合前后水分子总数不变
D.混合前后阳离子总数不变
3.下列反应属于中和反应的是( )
A.2HCl+CuO═CuCl2+H2O
B.2NaOH+CO2═Na2CO3+H2O
C.2HCl+Cu(OH)2═CuCl2+2H2O
D.CaO+H2O═Ca(OH)2
4.如图是NaOH溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应后溶液的pH=0
B.反应前两种溶液均能导电,反应后的溶液不导电
C.反应后溶液中的粒子只有Na+和Cl
D.反应前后各元素的化合价均无变化
5.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
6.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
7.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
8.黄蜂的毒液呈碱性,若被黄蜂蜇了,涂抹下列物质可缓解疼痛的是
A.食盐水(pH≈7 ) B.牙膏(pH≈9) C.肥皂(pH≈10 ) D.米醋(pH≈3)
9.下列区分物质的试剂或方法不正确的是
A.用水区分氯化钙和碳酸钙 B.用闻气味的方法区分白酒和白醋
C.用盐酸区分黄金和黄铜(含锌) D.用酚酞溶液区分氯化钠溶液和盐酸
10.推理是化学学习的重要方法,下列推理正确的是
A.酸雨的pH小于5.6,则pH小于5.6的雨水一定是酸雨
B.中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C.碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的一定是碱溶液
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
11.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
12.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
13.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是
A.La(OH)3和 HCl B.La2O3和 HCl
C.La 和 HCl D.NaCl 和 La(OH)3
14.室温下,将氢氧化钠溶液滴加到盛有一定量稀盐酸的容器中,边滴边搅拌,用数字pH仪连接电脑实时测得pH变化曲线如图。下列相关叙述错误的是
A.容器中发生的反应属于中和反应 B.a点溶液能使紫色石蕊溶液变红
C.b点表示HCl与NaOH等质量反应 D.c点溶液中的溶质是NaCl和NaOH
15.推理是学习化学的一种重要方法,下列推理合理的是
A.离子是带电荷的粒子,则带电荷的粒子一定是离子
B.单质是由同种元素组成的,则只含一种元素的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
16.在A+ B→盐+水的反应中,A和B不可能是
A.HCl和NaOH B.CO2和NaOH
C.H2SO4和Fe2O3 D.H2SO4和BaCl2
二、综合应用题
17.(一) 下图所示为实验室中常见的气体制备和收集装置.
请回答下列问题:
(1)实验室用高锰酸钾制取氧气,应选用的发生装置是_____ (填字 母序号)。若用装置B制取二氧化碳,反应的原理是(用化学方程式表示)_____。
(2)实验室用H2O2溶液和MnO2制取氧气, 若选用C做发生装置,你认为选用C的优点是_____。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应从_____ (填“a”或“b”) 端通入:欲使用装置E.用排水法收集氧气,先将瓶中装满水,再将气体从_____ (填“a”或“b”) 端通入。
(4)已知一氧化氮气体难落于水,在空气中容易与氧气发生反应,则收集一氧化氮气体时应选用图中装置_____(填字母序号)。
(二)小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,井向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应:②氢氧化钠有剩余:③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:_____。
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
实验方法 可能观察到的现象 结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 如果_____。 则盐酸过量
如果_____。 则盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是_____。(填序号).
A 生锈的铁钉
B 碳酸钠粉末
C 硫酸钠粉末
D 氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是_____(填序号)。
18.正常情况下人的胃液pH为0.8—1.5,相应含氯化氢的质量分数为0.2%—0.4%,胃液中氯化氢过多过少都不利于健康。某人出现反胃、吐酸水的症状,经检查其胃液中氯化氢的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_________性。
(2)若人的胃液总量为100mL,正常胃液中HCl的质量范围为___________________ g。
(3)服用碱性物质可以治疗胃液中HCl含量过多,你认为该患者 ___________ (填能或不能)服用熟石灰来治疗胃酸过多,理由是 ______________________________________ 。
(4)医生给患者开的药是胃舒平[有效成分是Al(OH)3],每片胃舒平含Al(OH)3 的质量为0.39g。请根据化学方程式计算该患者至少服用________片胃舒平,胃液才能恢复正常? (请写出计算过程)
19.化学与人类生产生活息息相关。
(1)下列物质的性质与应用关系不正确的是 _____ 。
A 氢氧化钠能与油脂反应,在生活中可用来除油污
B 人体缺少必需微量元素会得病,应合理补充微量元素
C 中和反应生成盐和水,那么生成盐和水的反应一定是中和反应
D 熟石灰具有碱性,可用于改良酸性土壤
(2)兴趣小组的同学借助无色酚酞溶液验证氢氧化钠和盐酸确实发生了反应,反应后溶液呈无色,甲同学认为氢氧化钠与盐酸恰好完全反应,乙同学认为甲同学的说法不准确,你觉得呢?说出你的猜想,并证明 _____ 。
(3)为探究一氧化碳还原氧化铁的实验,同学们设计如图的实验,并查阅了相关资料,仔细思考,回答下列问题。
【查阅资料】草酸晶体(H2C2O4 3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4 3H2OCO2↑+CO↑+4H2O
【问题讨论】
①D装置的化学反应方程式为 _____ 。
②进入D装置的气体是纯净、干燥的CO,则A、C装置中的试剂依次是 _____ 、 _____ (填名称)。
③请指出上述实验装置的一个明显缺陷,怎样改进实验装置 _____ 。
(4)将10g的铜一锌合金放入试管中,向其中加入49g质量分数为20%的稀硫酸,恰好完全反应,求:①生成氢气的质量 _____ 。②样品中锌的质量分数 _____ 。
20.实验室有一瓶标签破损的硫酸。为测定该瓶硫酸溶液的溶质质量分数,小强同学在烧杯中加入50g该硫酸,然后向烧杯中滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的滴入,溶液的pH变化情况如下表所示,请分析并计算:
氢氧化钠溶液的质量/g 溶液的pH 所得溶液
30 pH<7 a
40 pH =7 b
45 pH>7 c
(1)a、b、c三种溶液中只含一种溶质的是________。
(2)该瓶硫酸溶液的溶质质量分数是多少____ (写出解题过程)(H2SO4+2NaOH==Na2SO4+2H2O)
21.盐酸是重要的化工产。
(1)生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是___________________________________。
(2)如图从不同角度反映稀盐酸和氢氧化钠溶液进行的中和反应。图A是实际操作图,图B是反应过程中溶液的酸碱度变化图,图C是微观粒子结合过程的示意图。
①根据图B的曲线变化,该实验是将__________溶液滴加到另一种溶液中。当滴入的溶液质量为ag时,溶液中溶质的成分是______________(填化学式),下列物质中能证明此时溶液显酸性的是_______(填字母)。
a.酚酞溶液 b.锌粒 c.纯碱 d.氧化铁
②如图C表示该反应前后溶液中存在的主要离子,写出每种图形表示的离子(填离子符号)。
_______________________________。
③下列物质中能与氢氧化钾溶液发生如图C的类似反应的是_________(填字母)。
a.HNO3
b.CuSO4
c.CaCl2
d.AgNO3
22.金属、酸、碱是重要的化学物质,与人类日常生活和工农业生产关系十分密切。
(1)某同学为探究相关金属的化学性质,做了下列实验:
①只通过A和B实验尚不能证明银铜的活动性强弱,需补充一个实验来证明,应补充的实验是______。
②实验C中物质充分反应后溶液呈无色,过滤所得滤渣的成分是______。
(2)铁车架的表面刷油漆能防止锈蚀,其原因是______;用硫酸除铁锈(Fe2O3)的化学方程式为______。
(3)如图是盐酸和氢氧化钠反应的过程中,溶液pH的变化图象,请回答下列问题。
①写出氢氧化钠和盐酸反应的化学方程式______。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是______mL。
③向图中b点所示溶液中滴加酚酞溶液,溶液呈______色。
(4)某同学用50g稀盐酸与石灰石反应制取CO2气体,恰好完全反应后,得到溶质质量分数为20%的溶液55.5g,则该稀盐酸中溶质的质量分数是多少?
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.A
2.B
3.C
4.D
5.D
6.C
7.C
8.D
9.D
10.A
11.C
12.B
13.D
14.C
15.B
16.D
17. A 可以控制产生氧气的速率 a b F 观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余; 有气泡冒出 没有气体生成 C C
18. 酸性 0.2—0.4g 不能 因为氢氧化钙有腐蚀性。 该患者至少服用2片胃舒平,胃液才能恢复正常。
19. C 甲同学的说法是不准确的。盐酸可能过量,取少量反应后的溶液于试管中,滴加紫色石蕊试液,紫色石蕊试液变红色,说明盐酸过量 3CO+Fe2O32Fe+3CO2 氢氧化钠溶液 浓硫酸 缺少尾气处理装置,应该在F装置末端放一燃着的酒精灯 0.2g 65%
20.(1)b(2)9.8%。
21. 铁锈逐渐消失,无色溶液变为黄色,有气泡产生 氢氧化钠溶液 NaCl、HCl bcd H+ Cl- a
22.(1) Cu和Ag NO3溶液反应。 Ag和Cu,可能有Zn。
(2) 隔绝空气中的氧气和水蒸气。
(3) 10 红色
(4)14.6%
答案第1页,共2页
答案第1页,共2页
