必修1工业流程
图片预览


文档简介
必修一涉及到的工业流程及一些实验
海水的综合利用
注:
(1)粗盐(杂质:Ca2+, Mg2+, SO42-,泥沙)的除杂
注意:除杂质时所加试剂的顺序要求是:
Na2CO3必须在BaCl2之后,其他试剂顺序可调。
在过滤之后加入盐酸。
(2)电解饱和食盐水
电极反应:阴极 2H+ + 2 e- =H2↑ 滴有酚酞的溶液变红; 氧化反应
阳极 2Cl- - 2 e- = Cl2↑ 湿润的淀粉碘化钾试纸变蓝; 还原反应
总反应:2NaCl + 2H2O 通电 2NaOH + H2↑+ Cl2↑
阴极产物 阳极产物
氯碱工业:
Cl2+2NaOH=NaCl+NaClO+H2O;
2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(变质:Ca(ClO)2 + CO2 +H2O= CaCO3↓+ 2HClO; 2HClO 光照或△ 2HCl + O2↑)
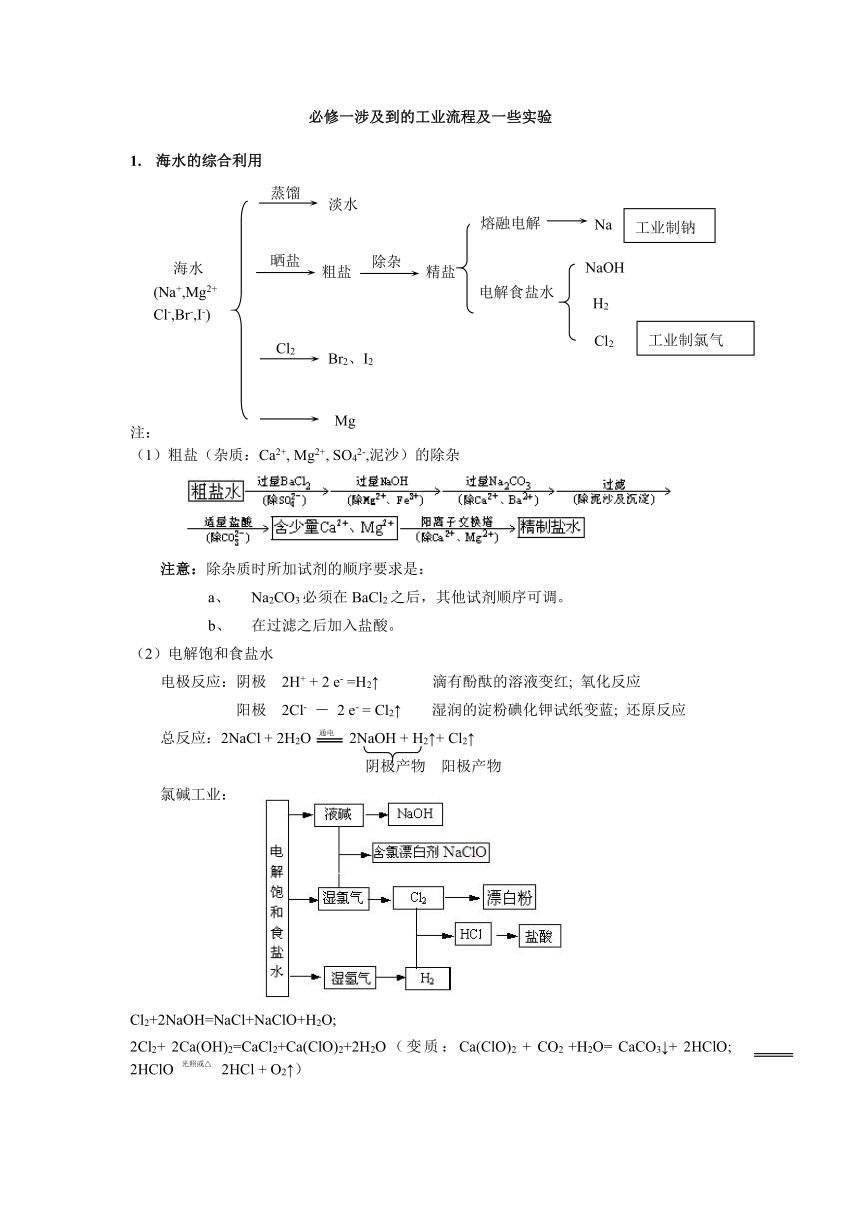
(3)从海水中提取溴
通入Cl2 鼓入热空气或水蒸气 精制
Br2挥发,冷凝
将氯气通入母液中,Cl2 + 2Br— === 2Cl—+ Br2 ,再鼓入热空气(因为溴易挥发,因此溴就会随着热空气溢出),再冷疑、萃取提纯
(4)从海水中的某些植物(海带)中提取碘
水 氯气
(5)海水提镁:
海水或苦卤(MgCl2) 过滤 Mg(OH)2 HCl MgCl2(aq) 蒸发结晶 MgCl2·6H2O
贝壳(CaCO3)煅烧 水 Ca(OH)2 HCl △
Mg 熔融电解 MgCl2
步骤
化学方程式
贝壳煅烧成石灰,并将石灰制成石灰乳
石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀
氢氧化镁与颜色反应,蒸发结晶获得六水合氯化镁晶体
六水合氯化镁晶体在氯化氢气流中加热生成无水氯化镁
电解熔融的氯化镁得到金属镁
(6)氯气的实验室制法和主要性质:
? ①.净化:
(1)除杂:用饱和食盐水除氯化氢气体。其中水可吸收除掉氯化氢,而大量食盐存在可以降低氯气在水中的溶解度。
(2)干燥:用浓硫酸除水。
②.收集:
(1)收集方法:向上排空气取气法。
(2)验满:湿润的淀粉KI试纸Cl2+2KI=I2+2KCl I2使淀粉变蓝;或者看颜色。
③.尾气处理:用NaOH溶液。 ④.替代制法:MnO2可被KMnO4、KClO3、NaClO等强氧化剂代替,反应常温即可进行;而浓盐酸可以被氯化钠固体和浓硫酸的混合物替代?
(7)侯氏制碱法:
例1:工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体,在加热分解碳酸氢钠得到纯碱。该反应原理可以用以下化学方程式表示,此反应是放热反应。NH3 + CO2 + H2O + NaCl(饱和)=NaHCO3(晶体)↓+ NH4Cl。某校学生实验小组利用上述反应原理,设计如图18所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图18中夹持装置已略去。
?可选用的药品有:a.石灰石? b.生石灰? c.6 mol/L盐酸? d.稀硫酸?? e.浓氨水 f.饱和氯化钠溶液。
①A中制备气体时,所需药品是ac;E中制备气体时,所需药品是b e(选填字母代号) ②B中盛有饱和碳酸氢钠溶液,其作用是除去CO2中的HCl; ③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为NH3; ④检验D出口处是否有氨气逸出的方法是将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出,若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。)。
提示:装置C中通入两种气体:NH3 和 CO2,先通入NH3形成碱性溶液,提高CO2吸收率。同时注意NH3溶解过程中的防倒吸问题,故A装置制备CO2,E装置制备NH3
从矿物质到基础物质
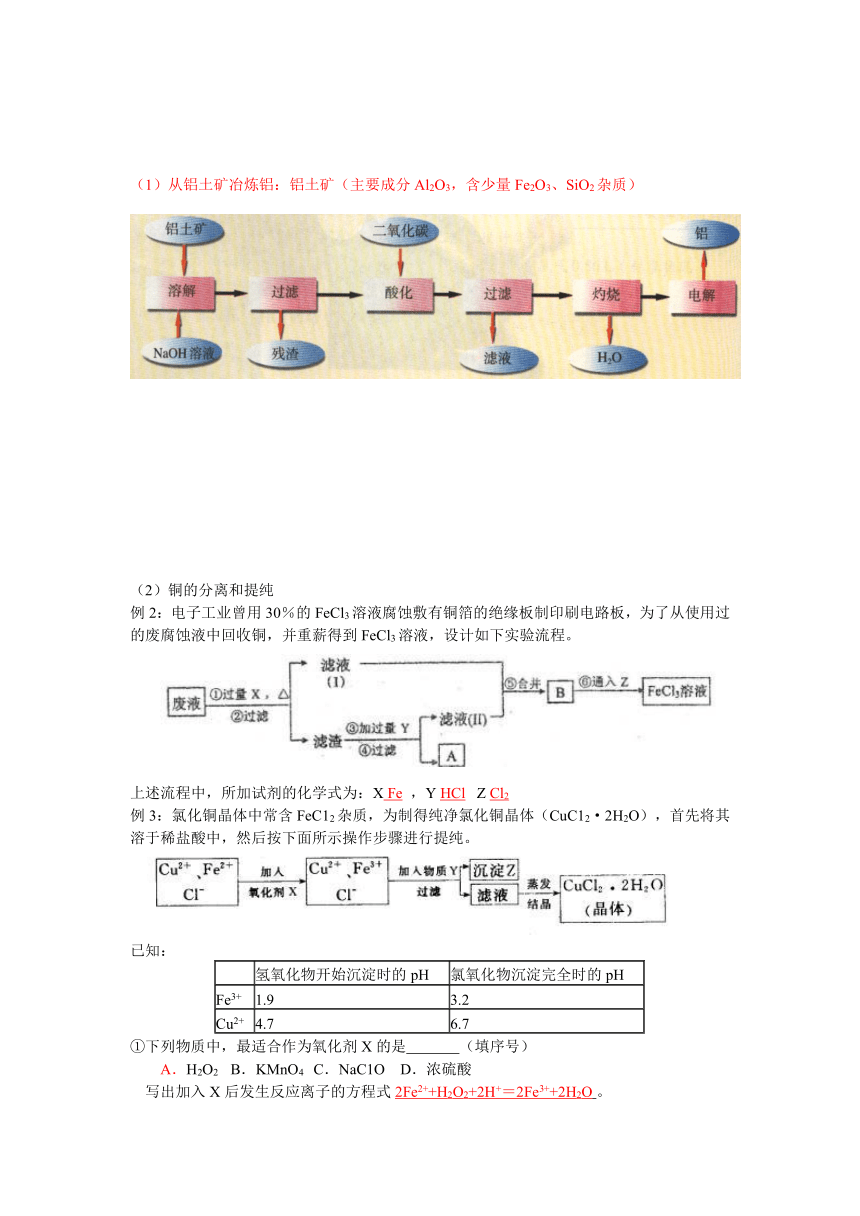
(1)从铝土矿冶炼铝:铝土矿(主要成分Al2O3,含少量Fe2O3、SiO2杂质)
(2)铜的分离和提纯
例2:电子工业曾用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重薪得到FeCl3溶液,设计如下实验流程。 ?????? 上述流程中,所加试剂的化学式为:X Fe ,Y HCl? Z Cl2
例3:氯化铜晶体中常含FeC12杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。 已知:
?
氢氧化物开始沉淀时的pH
氯氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Cu2+
4.7
6.7
①下列物质中,最适合作为氧化剂X的是???????? ????(填序号) A.H2O2??? B.KMnO4?? C.NaC1O?? D.浓硫酸 写出加入X后发生反应离子的方程式2Fe2++H2O2+2H+=2Fe3++2H2O?。 ②加入的物质Y可以是CuO或Cu(OH)2或CuCO3?,目的是?调节溶液的pH,只生成Fe(OH)3沉淀。 ③从CuC12稀溶液中得到CuC12·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是加入适量稀盐酸防止水解。
(3)从二氧化硅到晶体硅
SiO2 + 2C? 高温? Si +? 2CO ↑(制得粗硅)
Si+2Cl2 高温 SiCl4 SiCl4+2H2 高温 Si?+4HCl(制得高纯度硅)
(4)Fe(OH)2 的制备
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4、铁屑。
②除去蒸馏水中溶解的O2常采用煮沸的方法。
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是避免生成的Fe(OH)2沉淀接触O2,
方法二:在如图,用NaOH溶液、铁屑、稀NaSO4等试剂制备。
①在试管I里加入的试剂是 稀H2SO4、铁屑。
②在试管Ⅱ里加入的试剂是 NaOH溶液。
③为了制得白色Fe(OH)2沉淀,在试管工和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
④这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入。
方法三:隔绝空气电解法。 ①b电极材料为石墨, a电极材料为 铁,电极反应式为Fe—2e- =Fe2+
②电解液c可以是 ( ) A.蒸馏水 B.NaOH溶液 C.无水乙醇 D.Na2SO4溶液
③根据①与②写出电解的化学方程式 Fe + 2H2O 电解 Fe (OH)2 + H2↑。 ④液体d为苯或植物油,其作用为 隔绝空气,防止Fe(OH)2被氧化 思考:当电解一段时间看到白色沉淀后,再反接电源,除了电极上看到气泡外,混合物中另一明显现象为白色沉淀迅速变为灰绿色。最终变成红褐色沉淀
提示:当反接电源后,铁做阴极被保护,电解方程式为:2H2O2H2↑+O2↑ 在阳极(石墨)处生成O2,把上一步生成的白色Fe(OH)2氧化生成红褐色的Fe(OH)3
环境污染与可持续发展
注:
(1)氧气的实验室制法:
KMnO4 △ K2MnO4 + MnO2 + O2↑ 2KClO32KCl + 3O2↑
2H2O22H2O + O2↑
(2)氨气的实验室制法
① ② ③
Ca(OH)2 +2NH4Cl CaCl2 +2NH3↑+ H2O
③在氨水中有下列平衡:NH3+H2O NH3·H2O?NH4++OH—,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH—),促使化学平衡逆向移动。
(3)二氧化硫的实验室制法和主要性质
①实验室制备SO2除了用上述方法外,还可以如何制备,用化学方程式表示:Na2SO3+H2SO4= Na2SO4 + SO2 ↑+H2O
②装品红溶液的试管中的现象:溶液褪色,加热后现象为:恢复红色。该装置的目的是:检验生成的SO2。若将品红换成紫色石蕊溶液,现象为:溶液变红。
③洗气瓶中装有KMnO4溶液时,现象为溶液褪色,体现SO2的还原性
洗气瓶中装有碘淀粉溶液时,现象为溶液褪色,写出化学方程式:SO2 + I2+H2O= H2SO4+HI
④烧杯中装有NaOH溶液,作用是:吸收SO2防止污染空气
(4)酸雨
例4:我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。 ?? ?⑴ 现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.62
4.56
4.55
4.55
分析数据,回答下列问题: ????? ①雨水样品的pH变化的原因是(用化学方程式表示) 2H2SO3+O2==2H2SO4。 ????? ②如果将刚取样的上述雨水和自来水相混合,pH将变小,原因是(用化学方程式表示)
H2SO3+HClO==H2SO4+HCl (或SO2+Cl2+2H2O==H2SO4 +2HCl)。 ⑵你认为减少酸雨产生的途径可采用的措施是__________。 ???? ? ①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;
④在已酸化的土壤中加石灰; ⑤开发新能源。 ????? A.①②③?????? B.②③④⑤?????? C.①③⑤???????? D.①③④⑤
(5)NO、NO2的制备和性质
例5:甲同学采用如图I所示装置验证铜于稀硝酸的反应,并采用排水阀收集NO气体
①实验室用金属铜和稀硝酸制取NO的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O , 实验现象为:铜片溶解,溶液呈蓝色,开始时在液面上方看到红棕色气体,一段时间后消失,排水法收集到无色气体。
②乙同学认为虽然收集到的气体为NO,但并不能说明反应中一定生成NO,你认为他的理由是:反应若生成NO2,NO2溶于水后也得到NO。
③丙同学采用如图II所示装置进行实验,证明了铜与稀硝酸反应生成NO。该同学的步骤如下表所示,请回答实验中的有关问题。
实验步骤
实验现象及原因
1. 从U形管左端加入稀硝酸,至U形管右端
生成的气体,使U形管右端液面下降
2. 等反应停止后打开胶塞
U形管右端形成红棕色
(6)合成氨与硝酸工业
反应原理:
合成氨: N2+3H2 2NH3
硝酸工业:4NH3 + 5 O2 4NO + 6 H2O
2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
生产硝酸氨:NH3 + HNO3 = NH4NO3
合成氨条件选择:
反应特点
提高反应
速率措施
提高平衡
转化率措施
其他因素
实际措施
反应可逆
提高反应物浓度
提高反应物浓度或降低产物浓度
充分利用原料
液化分离产物NH3,原料气循环使用
分子数减小
增大压强
增大压强
钢材费用
20~50MPa
放热
提高温度
降低温度
催化剂活性
700K
(7)硫酸工业:
反应原理:
4FeS2 + 11O2 △ 4Fe2O3+8 SO2 或S + O2 点燃 SO2
2SO2+O2 2SO3 SO3+ H2O = H2SO4
反应特征:三步反应均为放热反应
SO3吸收:使用浓硫酸吸收SO3,防止反应放热引起酸雾。
尾气处理:SO2+2NH3+ H2O= (NH4)2SO3 或 SO2+2NH3·H2O= (NH4)2SO3+H2O
例5:下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。 ???试填写下列空白: (1)写出工业上用FeS2制取SO2的化学方程式4FeS2 + 11O2 △ 4Fe2O3+8 SO2。 (2)写出上图中部分装置的作用:甲:①混合SO2和O2;②干燥SO2和O2 ③调节气体流速(或“观察通入SO2和O2体积比”);丙和丁:吸收SO3并做对照实验?。 (3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;②浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收。 (4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于接触室;丙和丁相当于吸收塔 。 (5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是??? ?????(填下列各项的序号)。 A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧 B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
分析:A.硫铁矿燃烧前需要粉碎,以增加与氧气的接触面积,提高反应速率 B.从沸腾炉出来的炉气需净化,杂质会使催化剂中毒 C.二氧化硫氧化为三氧化硫时需使用催化剂,可以提高反应速率,但不影响二氧化硫的转化率。
氨的工业制法,适宜条件的选择及其原因(特别关注催化剂问题)
(8)两个重要的置换反应:
唯一能置换出氧气的反应:2F2 + 2H2O = O2 + 4HF
Mg + CO2 点燃 2MgO + C
海水的综合利用
注:
(1)粗盐(杂质:Ca2+, Mg2+, SO42-,泥沙)的除杂
注意:除杂质时所加试剂的顺序要求是:
Na2CO3必须在BaCl2之后,其他试剂顺序可调。
在过滤之后加入盐酸。
(2)电解饱和食盐水
电极反应:阴极 2H+ + 2 e- =H2↑ 滴有酚酞的溶液变红; 氧化反应
阳极 2Cl- - 2 e- = Cl2↑ 湿润的淀粉碘化钾试纸变蓝; 还原反应
总反应:2NaCl + 2H2O 通电 2NaOH + H2↑+ Cl2↑
阴极产物 阳极产物
氯碱工业:
Cl2+2NaOH=NaCl+NaClO+H2O;
2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(变质:Ca(ClO)2 + CO2 +H2O= CaCO3↓+ 2HClO; 2HClO 光照或△ 2HCl + O2↑)
(3)从海水中提取溴
通入Cl2 鼓入热空气或水蒸气 精制
Br2挥发,冷凝
将氯气通入母液中,Cl2 + 2Br— === 2Cl—+ Br2 ,再鼓入热空气(因为溴易挥发,因此溴就会随着热空气溢出),再冷疑、萃取提纯
(4)从海水中的某些植物(海带)中提取碘
水 氯气
(5)海水提镁:
海水或苦卤(MgCl2) 过滤 Mg(OH)2 HCl MgCl2(aq) 蒸发结晶 MgCl2·6H2O
贝壳(CaCO3)煅烧 水 Ca(OH)2 HCl △
Mg 熔融电解 MgCl2
步骤
化学方程式
贝壳煅烧成石灰,并将石灰制成石灰乳
石灰乳加入到海水沉淀池中,得到氢氧化镁沉淀
氢氧化镁与颜色反应,蒸发结晶获得六水合氯化镁晶体
六水合氯化镁晶体在氯化氢气流中加热生成无水氯化镁
电解熔融的氯化镁得到金属镁
(6)氯气的实验室制法和主要性质:
? ①.净化:
(1)除杂:用饱和食盐水除氯化氢气体。其中水可吸收除掉氯化氢,而大量食盐存在可以降低氯气在水中的溶解度。
(2)干燥:用浓硫酸除水。
②.收集:
(1)收集方法:向上排空气取气法。
(2)验满:湿润的淀粉KI试纸Cl2+2KI=I2+2KCl I2使淀粉变蓝;或者看颜色。
③.尾气处理:用NaOH溶液。 ④.替代制法:MnO2可被KMnO4、KClO3、NaClO等强氧化剂代替,反应常温即可进行;而浓盐酸可以被氯化钠固体和浓硫酸的混合物替代?
(7)侯氏制碱法:
例1:工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体,在加热分解碳酸氢钠得到纯碱。该反应原理可以用以下化学方程式表示,此反应是放热反应。NH3 + CO2 + H2O + NaCl(饱和)=NaHCO3(晶体)↓+ NH4Cl。某校学生实验小组利用上述反应原理,设计如图18所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图18中夹持装置已略去。
?可选用的药品有:a.石灰石? b.生石灰? c.6 mol/L盐酸? d.稀硫酸?? e.浓氨水 f.饱和氯化钠溶液。
①A中制备气体时,所需药品是ac;E中制备气体时,所需药品是b e(选填字母代号) ②B中盛有饱和碳酸氢钠溶液,其作用是除去CO2中的HCl; ③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为NH3; ④检验D出口处是否有氨气逸出的方法是将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出,若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。)。
提示:装置C中通入两种气体:NH3 和 CO2,先通入NH3形成碱性溶液,提高CO2吸收率。同时注意NH3溶解过程中的防倒吸问题,故A装置制备CO2,E装置制备NH3
从矿物质到基础物质
(1)从铝土矿冶炼铝:铝土矿(主要成分Al2O3,含少量Fe2O3、SiO2杂质)
(2)铜的分离和提纯
例2:电子工业曾用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重薪得到FeCl3溶液,设计如下实验流程。 ?????? 上述流程中,所加试剂的化学式为:X Fe ,Y HCl? Z Cl2
例3:氯化铜晶体中常含FeC12杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。 已知:
?
氢氧化物开始沉淀时的pH
氯氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Cu2+
4.7
6.7
①下列物质中,最适合作为氧化剂X的是???????? ????(填序号) A.H2O2??? B.KMnO4?? C.NaC1O?? D.浓硫酸 写出加入X后发生反应离子的方程式2Fe2++H2O2+2H+=2Fe3++2H2O?。 ②加入的物质Y可以是CuO或Cu(OH)2或CuCO3?,目的是?调节溶液的pH,只生成Fe(OH)3沉淀。 ③从CuC12稀溶液中得到CuC12·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是加入适量稀盐酸防止水解。
(3)从二氧化硅到晶体硅
SiO2 + 2C? 高温? Si +? 2CO ↑(制得粗硅)
Si+2Cl2 高温 SiCl4 SiCl4+2H2 高温 Si?+4HCl(制得高纯度硅)
(4)Fe(OH)2 的制备
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4、铁屑。
②除去蒸馏水中溶解的O2常采用煮沸的方法。
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是避免生成的Fe(OH)2沉淀接触O2,
方法二:在如图,用NaOH溶液、铁屑、稀NaSO4等试剂制备。
①在试管I里加入的试剂是 稀H2SO4、铁屑。
②在试管Ⅱ里加入的试剂是 NaOH溶液。
③为了制得白色Fe(OH)2沉淀,在试管工和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
④这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是试管Ⅰ中反应生成的H2充满了试管I和试管Ⅱ,且外界空气不容易进入。
方法三:隔绝空气电解法。 ①b电极材料为石墨, a电极材料为 铁,电极反应式为Fe—2e- =Fe2+
②电解液c可以是 ( ) A.蒸馏水 B.NaOH溶液 C.无水乙醇 D.Na2SO4溶液
③根据①与②写出电解的化学方程式 Fe + 2H2O 电解 Fe (OH)2 + H2↑。 ④液体d为苯或植物油,其作用为 隔绝空气,防止Fe(OH)2被氧化 思考:当电解一段时间看到白色沉淀后,再反接电源,除了电极上看到气泡外,混合物中另一明显现象为白色沉淀迅速变为灰绿色。最终变成红褐色沉淀
提示:当反接电源后,铁做阴极被保护,电解方程式为:2H2O2H2↑+O2↑ 在阳极(石墨)处生成O2,把上一步生成的白色Fe(OH)2氧化生成红褐色的Fe(OH)3
环境污染与可持续发展
注:
(1)氧气的实验室制法:
KMnO4 △ K2MnO4 + MnO2 + O2↑ 2KClO32KCl + 3O2↑
2H2O22H2O + O2↑
(2)氨气的实验室制法
① ② ③
Ca(OH)2 +2NH4Cl CaCl2 +2NH3↑+ H2O
③在氨水中有下列平衡:NH3+H2O NH3·H2O?NH4++OH—,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH—),促使化学平衡逆向移动。
(3)二氧化硫的实验室制法和主要性质
①实验室制备SO2除了用上述方法外,还可以如何制备,用化学方程式表示:Na2SO3+H2SO4= Na2SO4 + SO2 ↑+H2O
②装品红溶液的试管中的现象:溶液褪色,加热后现象为:恢复红色。该装置的目的是:检验生成的SO2。若将品红换成紫色石蕊溶液,现象为:溶液变红。
③洗气瓶中装有KMnO4溶液时,现象为溶液褪色,体现SO2的还原性
洗气瓶中装有碘淀粉溶液时,现象为溶液褪色,写出化学方程式:SO2 + I2+H2O= H2SO4+HI
④烧杯中装有NaOH溶液,作用是:吸收SO2防止污染空气
(4)酸雨
例4:我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。 ?? ?⑴ 现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.62
4.56
4.55
4.55
分析数据,回答下列问题: ????? ①雨水样品的pH变化的原因是(用化学方程式表示) 2H2SO3+O2==2H2SO4。 ????? ②如果将刚取样的上述雨水和自来水相混合,pH将变小,原因是(用化学方程式表示)
H2SO3+HClO==H2SO4+HCl (或SO2+Cl2+2H2O==H2SO4 +2HCl)。 ⑵你认为减少酸雨产生的途径可采用的措施是__________。 ???? ? ①少用煤作燃料;②把工厂烟囱造高;③燃料脱硫;
④在已酸化的土壤中加石灰; ⑤开发新能源。 ????? A.①②③?????? B.②③④⑤?????? C.①③⑤???????? D.①③④⑤
(5)NO、NO2的制备和性质
例5:甲同学采用如图I所示装置验证铜于稀硝酸的反应,并采用排水阀收集NO气体
①实验室用金属铜和稀硝酸制取NO的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O , 实验现象为:铜片溶解,溶液呈蓝色,开始时在液面上方看到红棕色气体,一段时间后消失,排水法收集到无色气体。
②乙同学认为虽然收集到的气体为NO,但并不能说明反应中一定生成NO,你认为他的理由是:反应若生成NO2,NO2溶于水后也得到NO。
③丙同学采用如图II所示装置进行实验,证明了铜与稀硝酸反应生成NO。该同学的步骤如下表所示,请回答实验中的有关问题。
实验步骤
实验现象及原因
1. 从U形管左端加入稀硝酸,至U形管右端
生成的气体,使U形管右端液面下降
2. 等反应停止后打开胶塞
U形管右端形成红棕色
(6)合成氨与硝酸工业
反应原理:
合成氨: N2+3H2 2NH3
硝酸工业:4NH3 + 5 O2 4NO + 6 H2O
2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
生产硝酸氨:NH3 + HNO3 = NH4NO3
合成氨条件选择:
反应特点
提高反应
速率措施
提高平衡
转化率措施
其他因素
实际措施
反应可逆
提高反应物浓度
提高反应物浓度或降低产物浓度
充分利用原料
液化分离产物NH3,原料气循环使用
分子数减小
增大压强
增大压强
钢材费用
20~50MPa
放热
提高温度
降低温度
催化剂活性
700K
(7)硫酸工业:
反应原理:
4FeS2 + 11O2 △ 4Fe2O3+8 SO2 或S + O2 点燃 SO2
2SO2+O2 2SO3 SO3+ H2O = H2SO4
反应特征:三步反应均为放热反应
SO3吸收:使用浓硫酸吸收SO3,防止反应放热引起酸雾。
尾气处理:SO2+2NH3+ H2O= (NH4)2SO3 或 SO2+2NH3·H2O= (NH4)2SO3+H2O
例5:下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。 ???试填写下列空白: (1)写出工业上用FeS2制取SO2的化学方程式4FeS2 + 11O2 △ 4Fe2O3+8 SO2。 (2)写出上图中部分装置的作用:甲:①混合SO2和O2;②干燥SO2和O2 ③调节气体流速(或“观察通入SO2和O2体积比”);丙和丁:吸收SO3并做对照实验?。 (3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;②浓硫酸对SO3的吸收效果远好于水,SO3充分被浓硫酸吸收。 (4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于接触室;丙和丁相当于吸收塔 。 (5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是??? ?????(填下列各项的序号)。 A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧 B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
分析:A.硫铁矿燃烧前需要粉碎,以增加与氧气的接触面积,提高反应速率 B.从沸腾炉出来的炉气需净化,杂质会使催化剂中毒 C.二氧化硫氧化为三氧化硫时需使用催化剂,可以提高反应速率,但不影响二氧化硫的转化率。
氨的工业制法,适宜条件的选择及其原因(特别关注催化剂问题)
(8)两个重要的置换反应:
唯一能置换出氧气的反应:2F2 + 2H2O = O2 + 4HF
Mg + CO2 点燃 2MgO + C
