第6章常用的金属和盐巩固-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐巩固-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 144.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 08:35:25 | ||
图片预览



文档简介
第6章常用的金属和盐巩固2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.下列做法不符合“节能降耗、保护环境”这一主题的是( )
A.合理和综合利用煤和石油
B.研制太阳能电池、海洋电池等
C.大量使用农药化肥提高粮食产量
D.推广垃圾分类、回收和处理
2.学校花圃所种的花卉缺乏氮元素和钾元素。如果只施用一种化肥,则应施用( )
A.硝酸钾 B.碳酸钾 C.尿素 D.碳酸氢铵
3.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
4.课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如下,其中正确的是
A.实验①证明蛋壳成分是CaCO3
B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应
D.实验中每步操作都是规范的
5.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
6.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
7.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
8.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2 Na2CO3 B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3 D.NaOH HNO3 NH4NO3
9.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
10.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
11.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
12.向AgNO3和Mg(NO3)2溶液中加入一定量Zn粉和Cu粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是
A.向滤渣中加入稀盐酸,可能有气泡产生 B.滤液中一定有Cu(NO3)2、Mg(NO3)2、Zn(NO3)2
C.滤渣中一定有Ag,可能有Cu和Zn D.滤液中一定无AgNO3,可能有Zn(NO3)2
二、简答题
13.请回答下列问题。
(1)如何稀释稀释浓硫酸? _________。
(2)用铝片与硫酸反应制取氢气时,刚开始无明显现象,一段时间后有气泡产生,产生该现象的原因是什么?_____________。
14.写出下列化学方程式。
(1)工业上用磁铁矿炼铁:________________。
(2)用稀盐酸除铁锈:___________________。
15.国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)
(1)溶解时玻璃棒的作用是______。
(2)实验中加入过量CaCl2溶液的目的是______。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是______;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果______。(选填“偏大”、“不变”或“偏小”)
三、推断题
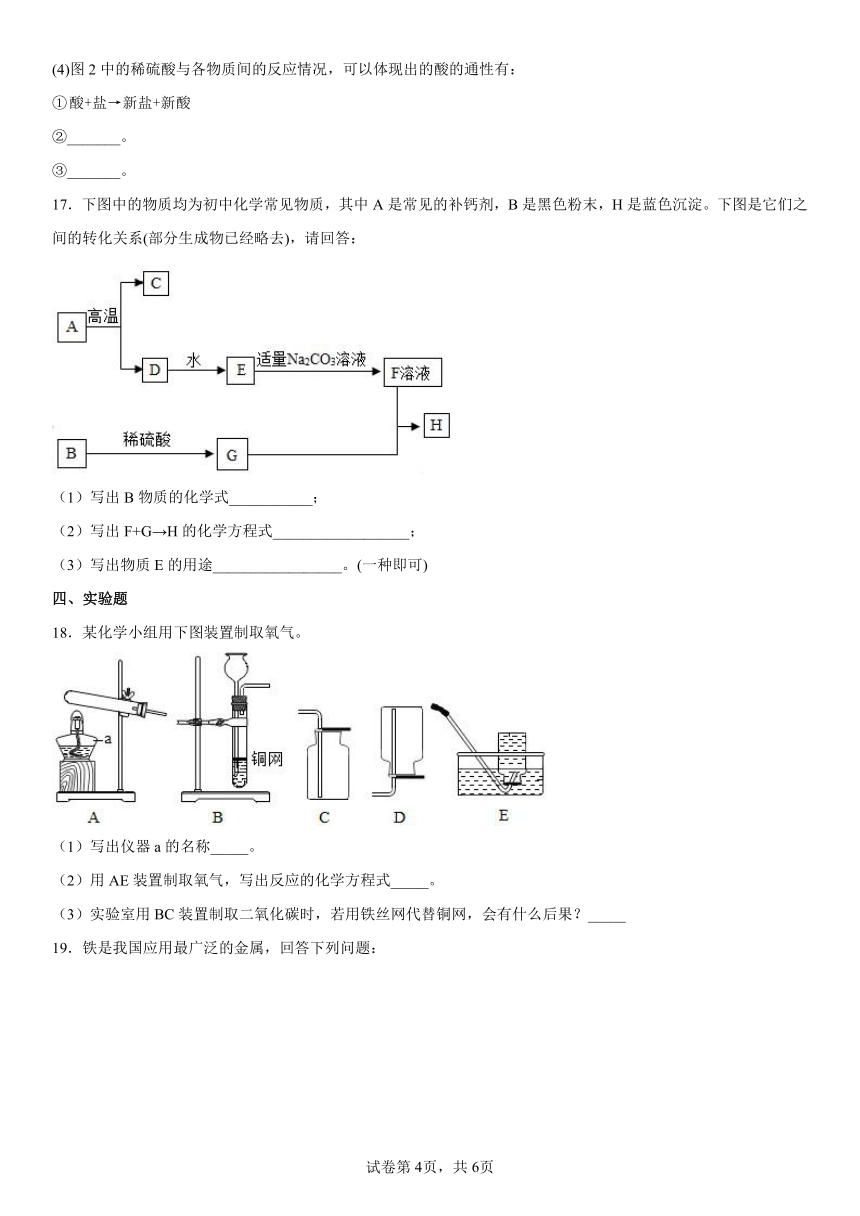
16.五个圆分别表示A(二氧化碳)、B(澄清石灰水)、C(稀硫酸)、D(铁)、E(碳酸钠溶液)五种物质(两圆相切表示两种物质可以发生反应),如图2所示。请回答下列问题:
(1)将B、C、D、E三种物质名称或化学式填入图2的4个圆中。
(2)写出B物质与E物质反应的现象_______。
(3)写出上述反应中有气泡生成的一个化学方程式_______。
(4)图2中的稀硫酸与各物质间的反应情况,可以体现出的酸的通性有:
①
②_______。
③_______。
17.下图中的物质均为初中化学常见物质,其中A是常见的补钙剂,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系(部分生成物已经略去),请回答:
(1)写出B物质的化学式___________;
(2)写出F+G→H的化学方程式__________________;
(3)写出物质E的用途_________________。(一种即可)
四、实验题
18.某化学小组用下图装置制取氧气。
(1)写出仪器a的名称_____。
(2)用AE装置制取氧气,写出反应的化学方程式_____。
(3)实验室用BC装置制取二氧化碳时,若用铁丝网代替铜网,会有什么后果?_____
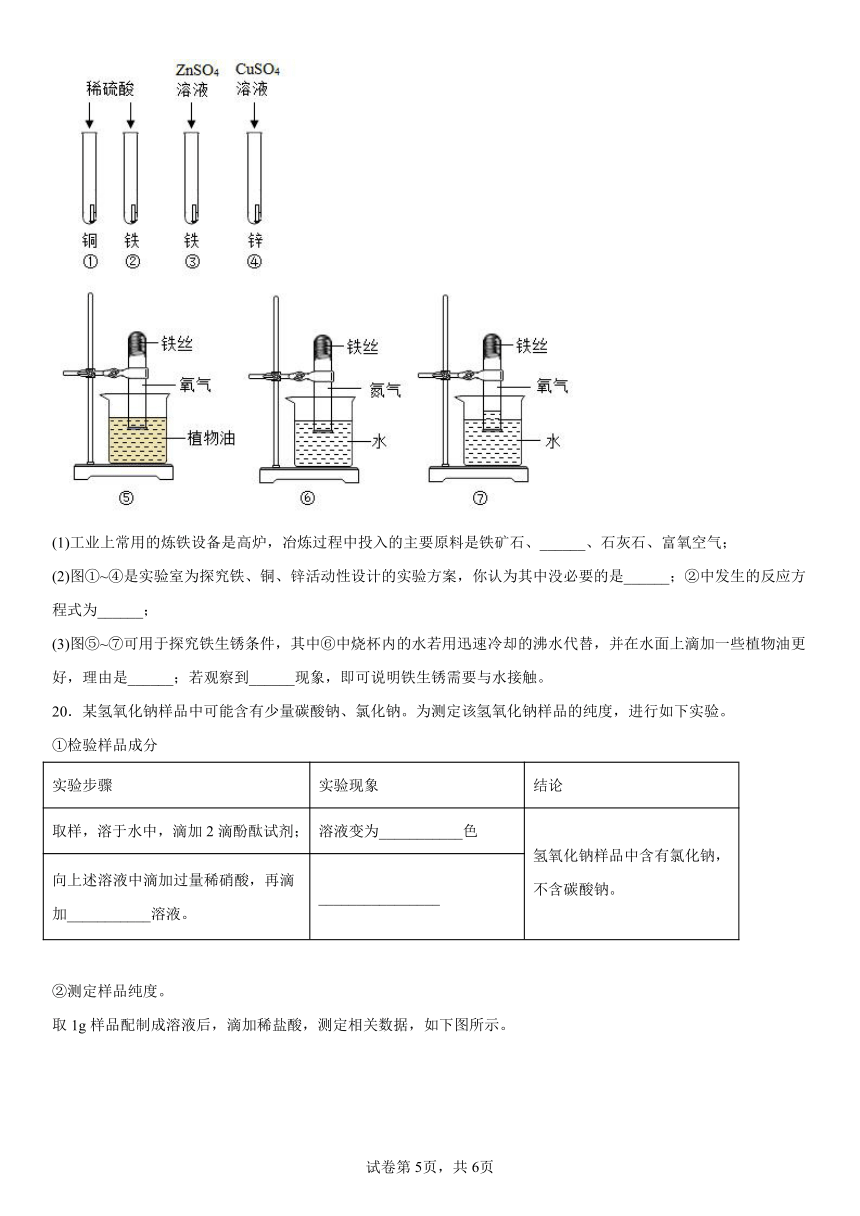
19.铁是我国应用最广泛的金属,回答下列问题:
(1)工业上常用的炼铁设备是高炉,冶炼过程中投入的主要原料是铁矿石、______、石灰石、富氧空气;
(2)图①~④是实验室为探究铁、铜、锌活动性设计的实验方案,你认为其中没必要的是______;②中发生的反应方程式为______;
(3)图⑤~⑦可用于探究铁生锈条件,其中⑥中烧杯内的水若用迅速冷却的沸水代替,并在水面上滴加一些植物油更好,理由是______;若观察到______现象,即可说明铁生锈需要与水接触。
20.某氢氧化钠样品中可能含有少量碳酸钠、氯化钠。为测定该氢氧化钠样品的纯度,进行如下实验。
①检验样品成分
实验步骤 实验现象 结论
取样,溶于水中,滴加2滴酚酞试剂; 溶液变为___________色 氢氧化钠样品中含有氯化钠,不含碳酸钠。
向上述溶液中滴加过量稀硝酸,再滴加___________溶液。 ________________
②测定样品纯度。
取1g样品配制成溶液后,滴加稀盐酸,测定相关数据,如下图所示。
I.发生反应的化学方程式是___________。
II.实验开始前应获知的数据是稀盐酸的密度和___________;实验后应选用的数据是___________(选填“a”“b”或“c”)。
五、计算题
21.实验室用20g含氧化铁80%的赤铁矿石进行炼铁,理论上可炼出纯铁的质量是多少?
22.工业上,把铁矿石和石灰石等物质一起加入高炉,通入热空气,经过一系列反应最终可得到生铁。
(1)炼铁的原料除了铁矿石和石灰石外,还需要的一种物质是 。
(2)工业上某厂日产含铁1.4×104t的生铁,至少需含氧化铁80%的赤铁矿的质量为多少?(根据化学方程式计算并写出解题过程)
23.某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
次数 第1次 第2次 第3次 第4次 第5次
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(注:发生反应的化学方程式为 MgCl2+2NaOH = Mg(OH)2↓+2NaCl)
请完成下列各题:
(1)第___________次恰好完全反应。
(2)样品中MgCl2的质量是___________g。
(3)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。
24.现有50g氯化钙溶液与100g碳酸钠溶液恰好完全反应,将反应后的混合液过滤后得到溶液的质量为140g。(反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)生成沉淀的质量是_______g。
(2)求碳酸钠溶液中溶质的质量分数是多少______?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.C
4.C
5.C
6.D
7.C
8.B
9.C
10.B
11.D
12.B
13.(1)将浓硫酸沿烧杯内壁慢慢加入水中,边加边搅拌
(2)刚开始铝片表面有氧化铝薄膜与硫酸反应不能生成氢气,反应一段时间后铝才与硫酸反应生成氢气,有气泡产生
14. Fe3O4+4CO3Fe+4CO2 Fe2O3+6HCl=2FeCl3+3H2O
15.(1)搅拌,加速溶解;(2)使碳酸钠全部转化为沉淀;(3)设该工业纯碱中碳酸钠的质量分数为x,则
解得x≈98.1%>98.0%;该工业纯碱为合格品。
(4)滤纸破损或液面高于滤纸边缘等;偏大
16.(1)
(2)产生白色沉淀或浑浊
(3)
(4)
17. CuO 2NaOH+CuSO4= Na2SO4+Cu(OH)2↓ 改良酸性土壤(合理即可)
18. 酒精灯 2KClO32KCl+3O2↑ 制取的二氧化碳中会混有氢气
19.(1)焦炭
(2) ④
(3) 防止铁丝与氧气接触 ⑤试管中的液面不升高,⑦试管中的液面升高
20. 红 AgNO3 滴加过量稀硝酸溶液除变为无色外无其他明显现象,滴加AgNO3溶液有白色沉淀生成
溶质质量分数 b
解:设1g样品中氢氧化钠的质量是x
x=0.8g
21.解:样品为20g,赤铁矿含80%氧化铁,则其中铁元素质量=
所以理论上20g赤铁矿可提炼出11.2g铁。
答:理论上可炼出纯铁的质量是11.2g。
22.(1)焦炭
(2)解:设至少需含氧化铁80%的赤铁矿的质量为x
x=2.5×104t
答:至少需含氧化铁80%的赤铁矿的质量为2.5×104t。
23.(1) 4 (2) 解:设生成氢氧化镁的质量为y
y=19g。
答:样品中MgCl2的质量是19g。
(3)恰好完全反应后所得溶液溶质质量分数为20%。
24.(1)10;(2)10.6%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列做法不符合“节能降耗、保护环境”这一主题的是( )
A.合理和综合利用煤和石油
B.研制太阳能电池、海洋电池等
C.大量使用农药化肥提高粮食产量
D.推广垃圾分类、回收和处理
2.学校花圃所种的花卉缺乏氮元素和钾元素。如果只施用一种化肥,则应施用( )
A.硝酸钾 B.碳酸钾 C.尿素 D.碳酸氢铵
3.小明家的甘蔗茎杆细弱,需要追施钾肥,应选择( )
A.KOH B.Ca3(PO4)2 C.K2CO3 D.CO(NH2)2
4.课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如下,其中正确的是
A.实验①证明蛋壳成分是CaCO3
B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应
D.实验中每步操作都是规范的
5.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
6.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
7.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
8.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2 Na2CO3 B.KNO3 HCl CaCl2
C.H2SO4 FeCl3 NaNO3 D.NaOH HNO3 NH4NO3
9.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
10.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
11.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
12.向AgNO3和Mg(NO3)2溶液中加入一定量Zn粉和Cu粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是
A.向滤渣中加入稀盐酸,可能有气泡产生 B.滤液中一定有Cu(NO3)2、Mg(NO3)2、Zn(NO3)2
C.滤渣中一定有Ag,可能有Cu和Zn D.滤液中一定无AgNO3,可能有Zn(NO3)2
二、简答题
13.请回答下列问题。
(1)如何稀释稀释浓硫酸? _________。
(2)用铝片与硫酸反应制取氢气时,刚开始无明显现象,一段时间后有气泡产生,产生该现象的原因是什么?_____________。
14.写出下列化学方程式。
(1)工业上用磁铁矿炼铁:________________。
(2)用稀盐酸除铁锈:___________________。
15.国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)
(1)溶解时玻璃棒的作用是______。
(2)实验中加入过量CaCl2溶液的目的是______。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是______;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果______。(选填“偏大”、“不变”或“偏小”)
三、推断题
16.五个圆分别表示A(二氧化碳)、B(澄清石灰水)、C(稀硫酸)、D(铁)、E(碳酸钠溶液)五种物质(两圆相切表示两种物质可以发生反应),如图2所示。请回答下列问题:
(1)将B、C、D、E三种物质名称或化学式填入图2的4个圆中。
(2)写出B物质与E物质反应的现象_______。
(3)写出上述反应中有气泡生成的一个化学方程式_______。
(4)图2中的稀硫酸与各物质间的反应情况,可以体现出的酸的通性有:
①
②_______。
③_______。
17.下图中的物质均为初中化学常见物质,其中A是常见的补钙剂,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系(部分生成物已经略去),请回答:
(1)写出B物质的化学式___________;
(2)写出F+G→H的化学方程式__________________;
(3)写出物质E的用途_________________。(一种即可)
四、实验题
18.某化学小组用下图装置制取氧气。
(1)写出仪器a的名称_____。
(2)用AE装置制取氧气,写出反应的化学方程式_____。
(3)实验室用BC装置制取二氧化碳时,若用铁丝网代替铜网,会有什么后果?_____
19.铁是我国应用最广泛的金属,回答下列问题:
(1)工业上常用的炼铁设备是高炉,冶炼过程中投入的主要原料是铁矿石、______、石灰石、富氧空气;
(2)图①~④是实验室为探究铁、铜、锌活动性设计的实验方案,你认为其中没必要的是______;②中发生的反应方程式为______;
(3)图⑤~⑦可用于探究铁生锈条件,其中⑥中烧杯内的水若用迅速冷却的沸水代替,并在水面上滴加一些植物油更好,理由是______;若观察到______现象,即可说明铁生锈需要与水接触。
20.某氢氧化钠样品中可能含有少量碳酸钠、氯化钠。为测定该氢氧化钠样品的纯度,进行如下实验。
①检验样品成分
实验步骤 实验现象 结论
取样,溶于水中,滴加2滴酚酞试剂; 溶液变为___________色 氢氧化钠样品中含有氯化钠,不含碳酸钠。
向上述溶液中滴加过量稀硝酸,再滴加___________溶液。 ________________
②测定样品纯度。
取1g样品配制成溶液后,滴加稀盐酸,测定相关数据,如下图所示。
I.发生反应的化学方程式是___________。
II.实验开始前应获知的数据是稀盐酸的密度和___________;实验后应选用的数据是___________(选填“a”“b”或“c”)。
五、计算题
21.实验室用20g含氧化铁80%的赤铁矿石进行炼铁,理论上可炼出纯铁的质量是多少?
22.工业上,把铁矿石和石灰石等物质一起加入高炉,通入热空气,经过一系列反应最终可得到生铁。
(1)炼铁的原料除了铁矿石和石灰石外,还需要的一种物质是 。
(2)工业上某厂日产含铁1.4×104t的生铁,至少需含氧化铁80%的赤铁矿的质量为多少?(根据化学方程式计算并写出解题过程)
23.某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
次数 第1次 第2次 第3次 第4次 第5次
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(注:发生反应的化学方程式为 MgCl2+2NaOH = Mg(OH)2↓+2NaCl)
请完成下列各题:
(1)第___________次恰好完全反应。
(2)样品中MgCl2的质量是___________g。
(3)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。
24.现有50g氯化钙溶液与100g碳酸钠溶液恰好完全反应,将反应后的混合液过滤后得到溶液的质量为140g。(反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)生成沉淀的质量是_______g。
(2)求碳酸钠溶液中溶质的质量分数是多少______?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.C
4.C
5.C
6.D
7.C
8.B
9.C
10.B
11.D
12.B
13.(1)将浓硫酸沿烧杯内壁慢慢加入水中,边加边搅拌
(2)刚开始铝片表面有氧化铝薄膜与硫酸反应不能生成氢气,反应一段时间后铝才与硫酸反应生成氢气,有气泡产生
14. Fe3O4+4CO3Fe+4CO2 Fe2O3+6HCl=2FeCl3+3H2O
15.(1)搅拌,加速溶解;(2)使碳酸钠全部转化为沉淀;(3)设该工业纯碱中碳酸钠的质量分数为x,则
解得x≈98.1%>98.0%;该工业纯碱为合格品。
(4)滤纸破损或液面高于滤纸边缘等;偏大
16.(1)
(2)产生白色沉淀或浑浊
(3)
(4)
17. CuO 2NaOH+CuSO4= Na2SO4+Cu(OH)2↓ 改良酸性土壤(合理即可)
18. 酒精灯 2KClO32KCl+3O2↑ 制取的二氧化碳中会混有氢气
19.(1)焦炭
(2) ④
(3) 防止铁丝与氧气接触 ⑤试管中的液面不升高,⑦试管中的液面升高
20. 红 AgNO3 滴加过量稀硝酸溶液除变为无色外无其他明显现象,滴加AgNO3溶液有白色沉淀生成
溶质质量分数 b
解:设1g样品中氢氧化钠的质量是x
x=0.8g
21.解:样品为20g,赤铁矿含80%氧化铁,则其中铁元素质量=
所以理论上20g赤铁矿可提炼出11.2g铁。
答:理论上可炼出纯铁的质量是11.2g。
22.(1)焦炭
(2)解:设至少需含氧化铁80%的赤铁矿的质量为x
x=2.5×104t
答:至少需含氧化铁80%的赤铁矿的质量为2.5×104t。
23.(1) 4 (2) 解:设生成氢氧化镁的质量为y
y=19g。
答:样品中MgCl2的质量是19g。
(3)恰好完全反应后所得溶液溶质质量分数为20%。
24.(1)10;(2)10.6%
答案第1页,共2页
答案第1页,共2页
