第6章常用的金属和盐章末复习题---2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐章末复习题---2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 91.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 09:02:56 | ||
图片预览



文档简介
第6章常用的金属和盐章末复习题2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
2.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
3.下列观点正确的是( )
A.生铁是混合物,钢是很纯的铁是纯净物
B.“真金不怕火炼”说明金具有熔点高的物理性质
C.常见金属的治炼难易程度和应用的先后顺序与金属活动性顺序无关
D.铜在空气中久置后表面生成铜绿[Cu2(OH)2CO3],说明铜的锈蚀可能与空气中的氧气、水蒸气和二氧化碳有关
4.下列归类正确的是
选项 归类 内容
A 化石燃料 煤、酒精、可燃冰
B 常见溶液 碘酒、食盐水、波尔多液
C 合成材料 涤纶、聚乙烯、合成橡胶
D 复合肥料 KNO3、CO(NH2)2、(NH4)2HPO4
A.A B.B C.C D.D
5.线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如右图所示实验,探究铁生锈的条件。下列说法错误的是
A.乙试管中植物油的作用是隔绝空气
B.只有甲试管中的铁钉有明显锈迹
C.乙丙两支试管的实验现象说明铁生锈需要水
D.实验表明铁生锈是铁与空气和水共同作用的结果
6.下列化学反应既是氧化还原反应又是化合反应的是
A.
B.
C.
D.
7.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
8.硝酸铵(NH4NO3)是一种高效化肥,它属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
9.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是
A.定期用清水冲洗,除去灰尘 B.放于体验区,让观众触摸
C.用盐水除去铁剑上的锈斑 D.放在充满氮气的展览柜中
10.科学家发现一种新金属。根据右表信息推测其用途错误的是
熔点 2500℃
密度 3g/cm3
强度 与钢相似
导电性 良好
导热性 良好
抗腐蚀性 优异
A.用于焊接金属 B.制造航天飞机
C.制外科手术刀 D.用于通讯设备
11.不使用其它试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是
A.H2SO4、Na2SO4、BaCl2、FeCl3 B.BaCl2、HCl、NaNO3、AgNO3
C.Na2CO3、HNO3、NaNO3、BaCl2 D.H2SO4、NaOH、MgCl2、Ba(NO3)2
二、简答题
12.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?________________为什么不宜用钢刷、沙等来擦洗铝制品?__________________.
13.“稀土”是我国重要的金属资源,请同学们利用所学知识提出三条保护金属资源的措施。
14.人的胃液里含有适量盐酸。服用含MgCO3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为 ;该抗酸药说明书上标明的食用方法为“嚼食”,将药片嚼碎后服用的优点是 。
三、推断题
15.某同学以盖房子的方式总结出了如下物质间的关系,A、B、C均为初中常见的物质,且上下相邻的物质间均可发生反应。
(1)己知B是空气中含量较多且性质活泼的气体。
①若C与B反应时只有水生成,C物质的化学式为____________;
②若A是金属单质,与B反应的现象为紫红色固体逐渐变成黑色,则A物质是_______。
(2)己知B是一种产生温室效应的主要气体。
①若A是水,往A与B反应后的溶液滴加紫色石蕊试液,溶液变_______色。
②C物质常用来检验是否存在B物质,写出有关化学方程式___________。
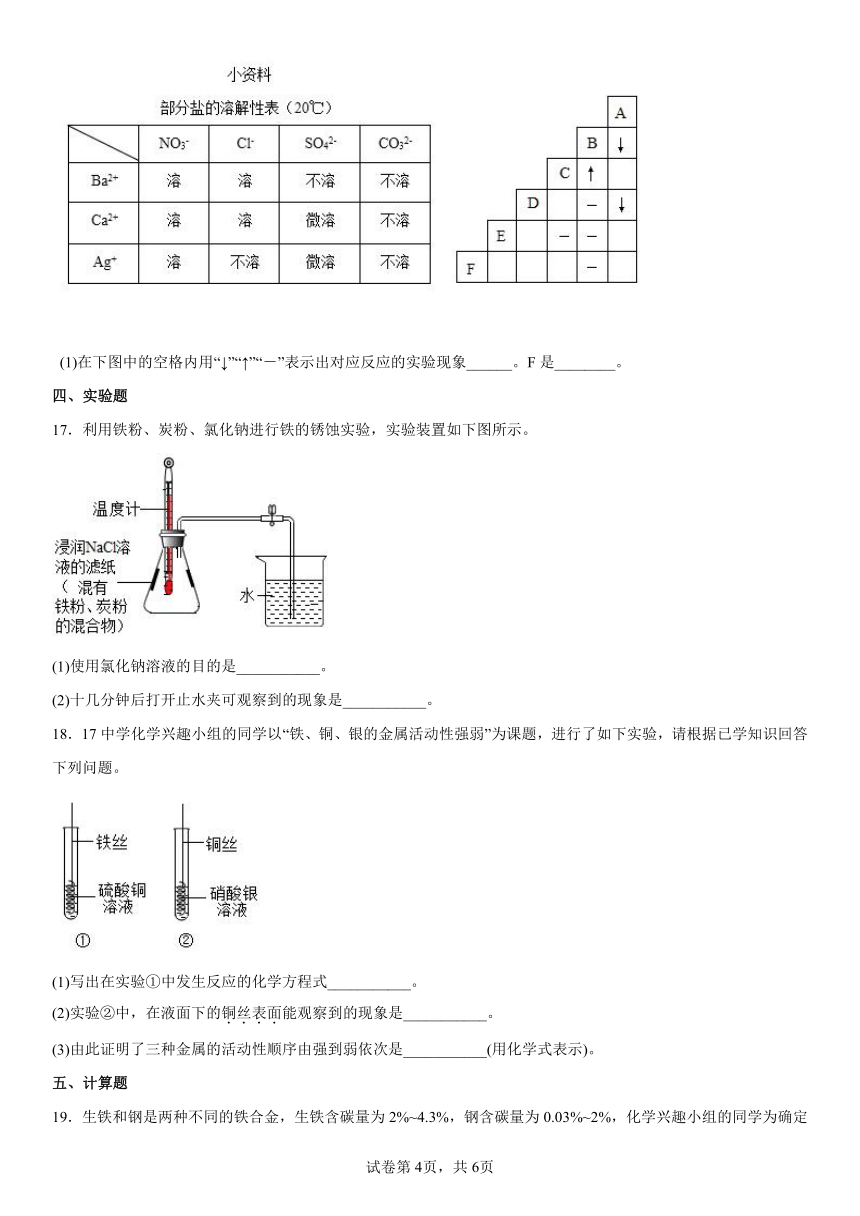
16.有A、B、C、D、E、F六种物质的溶已知它们分别是K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3中的某一种溶液。下图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请回答下列问题
(1)在下图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象______。F是________。
四、实验题
17.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如下图所示。
(1)使用氯化钠溶液的目的是___________。
(2)十几分钟后打开止水夹可观察到的现象是___________。
18.17中学化学兴趣小组的同学以“铁、铜、银的金属活动性强弱”为课题,进行了如下实验,请根据已学知识回答下列问题。
(1)写出在实验①中发生反应的化学方程式___________。
(2)实验②中,在液面下的铜丝表面能观察到的现象是___________。
(3)由此证明了三种金属的活动性顺序由强到弱依次是___________(用化学式表示)。
五、计算题
19.生铁和钢是两种不同的铁合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数 加盐酸前 第1次 第2次 第3次 第4次 第5次
加入稀盐酸质量(g) 0 20 20 20 20 20
锥形瓶内物质的总质量(g) 11.5 31.4 m 71.2 91.1 111.1
【査阅资料】碳及其他杂质不与稀盐酸反应。
请回答下列问题:
(1)实验数据表中m的值为______。
(2)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
20.某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算:
(1)混合物中铁的质量为_______。
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数为_______。
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是_______?
21.某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
次数 第1次 第2次 第3次 第4次 第5次
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(注:发生反应的化学方程式为 MgCl2+2NaOH = Mg(OH)2↓+2NaCl)
请完成下列各题:
(1)第___________次恰好完全反应。
(2)样品中MgCl2的质量是___________g。
(3)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.D
4.C
5.C
6.C
7.C
8.A
9.D
10.A
11.C
12. 铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化 用钢刷、沙等来擦洗铝制品,能使铝的表面生成的致密的氧化铝薄膜除掉,起不到保护作用
13.采取措施防止金属腐蚀、废旧金属回收利用、寻找金属的代用品。
14. MgCO3+2HCl=MgCl2+H2O+CO2↑ 增大接触面积利于吸收
15.(1) H2 Cu 铜
(2) 红
16. 硝酸钙[或Ca(NO3)2]
17.(1)加快反应速率
(2)水倒吸入锥形瓶中
18.(1)Fe+CuSO4=FeSO4+Cu
(2)铜丝表面有白色物质生成
(3)Fe、Cu、Ag
19.(1)51.3
(2)设该合金中铁的质量为x,
合金中碳的质量为:11.5g-11.2g=0.3g,合金中碳的质量分数为:
合金中碳的质量分数介于2%~4.3%之间,该铁合金属于生铁。
20.(1)5.6g;(2)19.6%;(3)160g
21.(1) 4 (2) 样品中MgCl2的质量是19g。
(3)解:设生成氯化钠的质量为x
得x = 23.4 g
恰好完全反应后所得溶液的溶质质量为:100g-19g+23.4g=104.4g
恰好完全反应后所得溶液的质量为:100g+313.6g+4×30g-11.6g=522g
恰好完全反应后所得溶液的溶质质量分数为:
答:恰好完全反应后所得溶液溶质质量分数为20%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列做法不利于绿色城市创建,不利于保护环境的是( )
A.实行垃圾分类回收再利用
B.城市推广使用公共自行车
C.推广秸秆综合利用,杜绝露天焚烧
D.提高农作物产量,大量使用农药化肥物质
2.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
3.下列观点正确的是( )
A.生铁是混合物,钢是很纯的铁是纯净物
B.“真金不怕火炼”说明金具有熔点高的物理性质
C.常见金属的治炼难易程度和应用的先后顺序与金属活动性顺序无关
D.铜在空气中久置后表面生成铜绿[Cu2(OH)2CO3],说明铜的锈蚀可能与空气中的氧气、水蒸气和二氧化碳有关
4.下列归类正确的是
选项 归类 内容
A 化石燃料 煤、酒精、可燃冰
B 常见溶液 碘酒、食盐水、波尔多液
C 合成材料 涤纶、聚乙烯、合成橡胶
D 复合肥料 KNO3、CO(NH2)2、(NH4)2HPO4
A.A B.B C.C D.D
5.线上学习,居家实验。小明用三枚洁净无锈的铁钉,设计如右图所示实验,探究铁生锈的条件。下列说法错误的是
A.乙试管中植物油的作用是隔绝空气
B.只有甲试管中的铁钉有明显锈迹
C.乙丙两支试管的实验现象说明铁生锈需要水
D.实验表明铁生锈是铁与空气和水共同作用的结果
6.下列化学反应既是氧化还原反应又是化合反应的是
A.
B.
C.
D.
7.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
8.硝酸铵(NH4NO3)是一种高效化肥,它属于
A.氮肥 B.磷肥 C.钾肥 D.复合肥
9.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是
A.定期用清水冲洗,除去灰尘 B.放于体验区,让观众触摸
C.用盐水除去铁剑上的锈斑 D.放在充满氮气的展览柜中
10.科学家发现一种新金属。根据右表信息推测其用途错误的是
熔点 2500℃
密度 3g/cm3
强度 与钢相似
导电性 良好
导热性 良好
抗腐蚀性 优异
A.用于焊接金属 B.制造航天飞机
C.制外科手术刀 D.用于通讯设备
11.不使用其它试剂,利用物质间两两混合反应将物质区别开(提供的物质可重复使用),也是物质鉴别的常用方法。下面四组物质利用上述方法可鉴别开的是
A.H2SO4、Na2SO4、BaCl2、FeCl3 B.BaCl2、HCl、NaNO3、AgNO3
C.Na2CO3、HNO3、NaNO3、BaCl2 D.H2SO4、NaOH、MgCl2、Ba(NO3)2
二、简答题
12.铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?________________为什么不宜用钢刷、沙等来擦洗铝制品?__________________.
13.“稀土”是我国重要的金属资源,请同学们利用所学知识提出三条保护金属资源的措施。
14.人的胃液里含有适量盐酸。服用含MgCO3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为 ;该抗酸药说明书上标明的食用方法为“嚼食”,将药片嚼碎后服用的优点是 。
三、推断题
15.某同学以盖房子的方式总结出了如下物质间的关系,A、B、C均为初中常见的物质,且上下相邻的物质间均可发生反应。
(1)己知B是空气中含量较多且性质活泼的气体。
①若C与B反应时只有水生成,C物质的化学式为____________;
②若A是金属单质,与B反应的现象为紫红色固体逐渐变成黑色,则A物质是_______。
(2)己知B是一种产生温室效应的主要气体。
①若A是水,往A与B反应后的溶液滴加紫色石蕊试液,溶液变_______色。
②C物质常用来检验是否存在B物质,写出有关化学方程式___________。
16.有A、B、C、D、E、F六种物质的溶已知它们分别是K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3中的某一种溶液。下图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请回答下列问题
(1)在下图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象______。F是________。
四、实验题
17.利用铁粉、炭粉、氯化钠进行铁的锈蚀实验,实验装置如下图所示。
(1)使用氯化钠溶液的目的是___________。
(2)十几分钟后打开止水夹可观察到的现象是___________。
18.17中学化学兴趣小组的同学以“铁、铜、银的金属活动性强弱”为课题,进行了如下实验,请根据已学知识回答下列问题。
(1)写出在实验①中发生反应的化学方程式___________。
(2)实验②中,在液面下的铜丝表面能观察到的现象是___________。
(3)由此证明了三种金属的活动性顺序由强到弱依次是___________(用化学式表示)。
五、计算题
19.生铁和钢是两种不同的铁合金,生铁含碳量为2%~4.3%,钢含碳量为0.03%~2%,化学兴趣小组的同学为确定该铁合金是生铁还是钢,他们取11.5g铁合金样品放到锥形瓶中,将100g稀盐酸分成5等份,分5次加入锥形瓶,每次待充分反应后记录实验数据。实验数据整理如下表所示:
次数 加盐酸前 第1次 第2次 第3次 第4次 第5次
加入稀盐酸质量(g) 0 20 20 20 20 20
锥形瓶内物质的总质量(g) 11.5 31.4 m 71.2 91.1 111.1
【査阅资料】碳及其他杂质不与稀盐酸反应。
请回答下列问题:
(1)实验数据表中m的值为______。
(2)请通过计算确定该铁合金是生铁还是钢(写出计算过程,计算结果保留到0.1%)。
20.某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算:
(1)混合物中铁的质量为_______。
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数为_______。
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水的质量是_______?
21.某工厂生产的NaCl产品中含有杂质MgCl2,化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
次数 第1次 第2次 第3次 第4次 第5次
加入氢氧化钠溶液的质量/g 30 30 30 30 30
累计生成沉淀的质量/g 2.9 5.8 8.7 11.6 11.6
(注:发生反应的化学方程式为 MgCl2+2NaOH = Mg(OH)2↓+2NaCl)
请完成下列各题:
(1)第___________次恰好完全反应。
(2)样品中MgCl2的质量是___________g。
(3)计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.D
4.C
5.C
6.C
7.C
8.A
9.D
10.A
11.C
12. 铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化 用钢刷、沙等来擦洗铝制品,能使铝的表面生成的致密的氧化铝薄膜除掉,起不到保护作用
13.采取措施防止金属腐蚀、废旧金属回收利用、寻找金属的代用品。
14. MgCO3+2HCl=MgCl2+H2O+CO2↑ 增大接触面积利于吸收
15.(1) H2 Cu 铜
(2) 红
16. 硝酸钙[或Ca(NO3)2]
17.(1)加快反应速率
(2)水倒吸入锥形瓶中
18.(1)Fe+CuSO4=FeSO4+Cu
(2)铜丝表面有白色物质生成
(3)Fe、Cu、Ag
19.(1)51.3
(2)设该合金中铁的质量为x,
合金中碳的质量为:11.5g-11.2g=0.3g,合金中碳的质量分数为:
合金中碳的质量分数介于2%~4.3%之间,该铁合金属于生铁。
20.(1)5.6g;(2)19.6%;(3)160g
21.(1) 4 (2) 样品中MgCl2的质量是19g。
(3)解:设生成氯化钠的质量为x
得x = 23.4 g
恰好完全反应后所得溶液的溶质质量为:100g-19g+23.4g=104.4g
恰好完全反应后所得溶液的质量为:100g+313.6g+4×30g-11.6g=522g
恰好完全反应后所得溶液的溶质质量分数为:
答:恰好完全反应后所得溶液溶质质量分数为20%。
答案第1页,共2页
答案第1页,共2页
