第四章认识化学变化 达标检测卷— 2021-2022学年九年级化学沪教版上册(word版 含答案)
文档属性
| 名称 | 第四章认识化学变化 达标检测卷— 2021-2022学年九年级化学沪教版上册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 425.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 09:13:37 | ||
图片预览



文档简介
《第四章 认识化学变化》达标检测卷
可能用到的相对原子质量:H—1 C—12 O—16 S—32
一、选择题(每题3分,共36分)
1.下列现象不能用质量守恒定律解释的是( )
A.蜡烛燃烧后质量变小
B.镁条燃烧,生成物的质量比镁条的质量大
C.酒精敞口放置一段时间后质量变小
D.纸燃烧化为灰烬,灰烬的质量比纸的质量小
2.下列化学方程式书写正确的是( )
A.S+O2===SO2 B.2Cu+O22CuO
C.2Al+O22AlO D.4Fe+3O22Fe2O3
3.铜能与浓硝酸反应,反应的化学方程式为Cu+4HNO3(浓)===Cu(NO3)2+2X↑+2H2O,则X的化学式是( )
A.N2O4 B.NO2 C.NO D.N2O
4.下列说法不正确的是( )
A.燃烧不一定有火焰产生
B.物质跟氧气的反应就是燃烧
C.物质在有限的空间内燃烧,可能会引起爆炸
D.物质燃烧的剧烈程度与氧气的浓度有关
5.下列四支蜡烛都将熄灭,其中一支熄灭的原因与另外三支不同的是( )
6.下列所采取的安全措施不正确的是( )
A.油锅起火迅速用锅盖盖灭
B.煤气泄漏迅速打开排气扇
C.酒精灯不慎打翻起火,迅速用湿抹布扑盖
D.在森林大火蔓延路线前开辟一条“隔离带”,以控制火灾
7.已知某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量比为( )
A.1:1 B.1:2 C.1:4 D.1:5
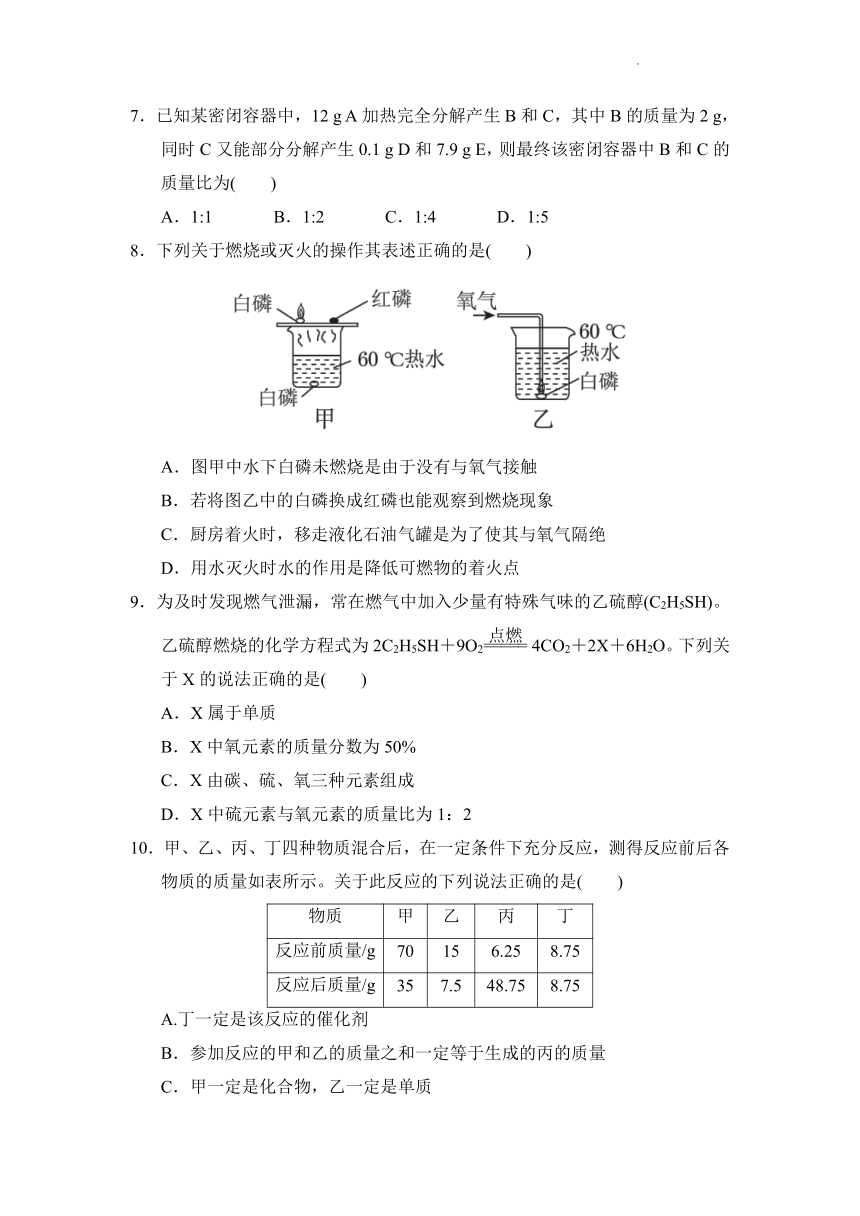
8.下列关于燃烧或灭火的操作其表述正确的是( )
A.图甲中水下白磷未燃烧是由于没有与氧气接触
B.若将图乙中的白磷换成红磷也能观察到燃烧现象
C.厨房着火时,移走液化石油气罐是为了使其与氧气隔绝
D.用水灭火时水的作用是降低可燃物的着火点
9.为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH)。乙硫醇燃烧的化学方程式为2C2H5SH+9O2 4CO2+2X+6H2O。下列关于X的说法正确的是( )
A.X属于单质
B.X中氧元素的质量分数为50%
C.X由碳、硫、氧三种元素组成
D.X中硫元素与氧元素的质量比为1:2
10.甲、乙、丙、丁四种物质混合后,在一定条件下充分反应,测得反应前后各物质的质量如表所示。关于此反应的下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 70 15 6.25 8.75
反应后质量/g 35 7.5 48.75 8.75
A.丁一定是该反应的催化剂
B.参加反应的甲和乙的质量之和一定等于生成的丙的质量
C.甲一定是化合物,乙一定是单质
D.该反应可能是分解反应
11.科研人员制备了一种纳米催化剂,二氧化碳和水在其表面发生反应的微观示意图如图所示。下列说法正确的是( )
A.两种反应物的分子个数比为1:1
B.生成物 的化学式是CH4O
C.催化剂的化学性质在反应前后发生变化
D.原子的种类和数目在反应前后都发生变化
12.某物质1.6 g在空气中充分燃烧共生成4.4 g二氧化碳和3.6 g水。则下列说法正确的是( )
①该物质中一定含有氧元素;②该物质中一定不含氧元素;③该物质中一定含有碳、氢元素;④该物质的一个分子中碳、氢原子的个数比为1:4;⑤该物质中氢元素的质量分数最大。
A.①②③④⑤ B.②③④ C.③④⑤ D.②③④⑤
二、填空题(39分)
13.(10分)写出符合下列要求的化学方程式:
(1)有黑色固体生成的化合反应:_______________________________________。
(2)有两种单质生成的分解反应:_______________________________________。
(3)实验室制取二氧化碳的反应:_______________________________________。
(4)实验室检验二氧化碳的反应:_______________________________________。
(5)加热碳酸氢铵发生的反应:_________________________________________。
14.(5分)科学地利用燃烧反应,对人类生产和生活是非常重要的。
(1)煤的主要成分是碳。请写出碳在氧气不足时燃烧的化学方程式:__________________________________;为使煤充分燃烧,合理的做法是__________________________(写一种做法),这对于节约能源非常重要。
(2)做饭时,锅底出现黑色物质,需要调______(填“大”或“小”)炉具或灶具的进风口,使燃料充分燃烧。
(3)请写出成语“釜底抽薪”体现的灭火原理:____________________________。
(4)如果发现火险或遭遇火灾,应采取的应急措施是__________________(写出一条即可)。
15.(6分)学校运动会上短跑项目“发令枪”里的火药成分为KClO3、MnO2和红磷。当扣动扳机时,①撞针撞击火药,产生热量使KClO3分解产生O2;②并引燃红磷产生白烟。
(1)试分别写出这两步反应的化学方程式。①____________________;②_________________________,基本反应类型是________________。
(2)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X===NaClO+NaCl+H2O,则X的化学式为________。求出NaClO中氯元素化合价并在该化学式中表示出来____________。
(3)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是_______________________________。
16.(10分)我国科学家研制出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120 ℃下发生反应,反应微观模型如图所示。
(1)反应微观模型中,除钼外还有______种元素,有______种单质分子。
(2)该反应前后:①构成催化剂的各原子______(填“有”或“没有”)变化;
②金原子对______(填“CO”或“H2O”)起吸附催化作用;
③反应的化学方程式为_____________________________________________。
17.(8分)质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题:
(1)化学反应前后肯定没有变化的是________(填字母序号)。
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
(2)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为________________________,若固体质量变化用图甲表示,则m2与m1之差表示________________的质量。
(3)实验过程中,镁条点燃后实验现象如图乙所示,镁条完全燃烧后,称量得知石棉网上留下的固体质量反而比反应前的镁条还轻,其原因可能是_______________________________________________________________。
三、探究实验题(18分)
18.质量守恒定律是自然界最普遍、最重要的基本规律之一。某化学课外小组同学用如图1所示实验探究质量守恒定律。
(1)A实验加热细铜丝团一段时间后移走酒精灯,观察到铜丝表面变为黑色(CuO),细铜丝团______(填“上升”或“下沉”)。
(2)B实验中发生反应的化学方程式为____________________________。实验过程中,观察到小气球先变鼓再变瘪。其中“变鼓”的原因是________________________________________________________________。
(3)B、C、D三组实验充分反应并冷却至室温后最终天平不平衡的是________(填字母)。在B实验中,锥形瓶中物质的总质量随时间的变化关系如图2所示,正确的是________(填字母)。
(4)通过上述实验,你得到的启示是有气体参加或生成的反应,在验证质量守恒定律时应在________装置中进行。
四、计算题(7分)
19.实验室常用过氧化氢溶液在二氧化锰催化作用下分解制取氧气。若含6.8 g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
答案
一、1.C 2.B 3.B 4.B 5.B
6.B 点拨:煤气泄漏应迅速关闭煤气阀门,然后开窗通风,切不可打开排气扇,以防产生的电火花将煤气引燃。
7.A 8.A
9.B 点拨:根据质量守恒定律可知,化学反应前后原子种类和个数均不变,反应前各原子数目为4个C,12个H,18个O,2个S,反应后各原子数目为4个C,12个H,14个O,则1个X分子中含有2个O、1个S,可得X的化学式为SO2。X为化合物,不属于单质,A不正确;SO2中氧元素的质量分数为×100%=50%,B正确;X由硫、氧两种元素组成,C不正确;X中硫元素与氧元素的质量比为32:(16×2)=1:1,D不正确。
10.B 点拨:反应后甲的质量减少了70 g-35 g=35 g,所以甲是反应物,参加反应的甲的质量为35 g;乙的质量减少了15 g-7.5 g=7.5 g,所以乙是反应物,参加反应的乙的质量为7.5 g;丙的质量增加了48.75 g-6.25 g=42.5 g;反应前后丁的质量不变。参加反应的甲与乙的质量之和等于生成的丙的质量。反应前后,丙的质量不变,丙可能是催化剂,也可能没有参加反应;该反应可表示为甲+乙→丙,属于化合反应。
11.B 点拨:由反应的微观示意图可知,该反应的化学方程式是2CO2+4H2O2CH3OH+3O2。两种反应物二氧化碳和水的分子个数比为1:2,A错误;由分子的模型图可知,B正确;催化剂的化学性质在反应前后没有发生变化,C错误;由微粒的变化可知,原子的种类和数目在反应前后都没有发生变化,D错误。
12.B 点拨:由该物质在空气中充分燃烧生成二氧化碳和水,根据质量守恒定律可知,该物质中一定含有碳、氢元素,可能含有氧元素;4.4 g二氧化碳中含碳元素的质量为4.4 g×=1.2 g,3.6 g水中含氢元素的质量为3.6 g×=0.4 g,由于1.2 g+0.4 g=1.6 g,因此该物质中不含氧元素,只含C、H元素,①错误,②、③正确;该物质的一个分子中碳、氢原子的个数比为:=1:4,④正确;该物质为CH4,其中氢元素的质量分数最小,⑤错误,综上可知B正确。
二、13.(1)3Fe+2O2Fe3O4 (2)2H2O2H2↑+O2↑
(3)CaCO3+2HCl===CaCl2+H2O+CO2↑
(4)Ca(OH)2+CO2===CaCO3↓+H2O
(5)NH4HCO3NH3↑+H2O+CO2↑
14.(1)2C+O22CO;鼓入大量的空气(或将煤粉碎)
(2)大 (3)移走可燃物
(4)拨打火警电话119(合理答案均可)
15.(1)①2KClO32KCl+3O2↑
②4P+5O22P2O5;化合反应
(2)Cl2;NaO (3)MgH2+2H2O===Mg(OH)2+2H2↑
16.(1)4;1 (2)①没有 ②CO ③CO+H2OCO2+H2
17.(1)B (2)2Mg+O22MgO;参加反应的氧气
(3)部分生成物逸散到空气中去了
三、18.(1)下沉 (2)4P+5O22P2O5;白磷燃烧放热,导致锥形瓶中气压增大 (3)D;b (4)密闭
四、19.解:设最多可制得氧气的质量为x。
2H2O22H2O+O2↑
68 32
6.8 g x
= x=3.2 g
答:最多可制得氧气3.2 g。
可能用到的相对原子质量:H—1 C—12 O—16 S—32
一、选择题(每题3分,共36分)
1.下列现象不能用质量守恒定律解释的是( )
A.蜡烛燃烧后质量变小
B.镁条燃烧,生成物的质量比镁条的质量大
C.酒精敞口放置一段时间后质量变小
D.纸燃烧化为灰烬,灰烬的质量比纸的质量小
2.下列化学方程式书写正确的是( )
A.S+O2===SO2 B.2Cu+O22CuO
C.2Al+O22AlO D.4Fe+3O22Fe2O3
3.铜能与浓硝酸反应,反应的化学方程式为Cu+4HNO3(浓)===Cu(NO3)2+2X↑+2H2O,则X的化学式是( )
A.N2O4 B.NO2 C.NO D.N2O
4.下列说法不正确的是( )
A.燃烧不一定有火焰产生
B.物质跟氧气的反应就是燃烧
C.物质在有限的空间内燃烧,可能会引起爆炸
D.物质燃烧的剧烈程度与氧气的浓度有关
5.下列四支蜡烛都将熄灭,其中一支熄灭的原因与另外三支不同的是( )
6.下列所采取的安全措施不正确的是( )
A.油锅起火迅速用锅盖盖灭
B.煤气泄漏迅速打开排气扇
C.酒精灯不慎打翻起火,迅速用湿抹布扑盖
D.在森林大火蔓延路线前开辟一条“隔离带”,以控制火灾
7.已知某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量比为( )
A.1:1 B.1:2 C.1:4 D.1:5
8.下列关于燃烧或灭火的操作其表述正确的是( )
A.图甲中水下白磷未燃烧是由于没有与氧气接触
B.若将图乙中的白磷换成红磷也能观察到燃烧现象
C.厨房着火时,移走液化石油气罐是为了使其与氧气隔绝
D.用水灭火时水的作用是降低可燃物的着火点
9.为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH)。乙硫醇燃烧的化学方程式为2C2H5SH+9O2 4CO2+2X+6H2O。下列关于X的说法正确的是( )
A.X属于单质
B.X中氧元素的质量分数为50%
C.X由碳、硫、氧三种元素组成
D.X中硫元素与氧元素的质量比为1:2
10.甲、乙、丙、丁四种物质混合后,在一定条件下充分反应,测得反应前后各物质的质量如表所示。关于此反应的下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 70 15 6.25 8.75
反应后质量/g 35 7.5 48.75 8.75
A.丁一定是该反应的催化剂
B.参加反应的甲和乙的质量之和一定等于生成的丙的质量
C.甲一定是化合物,乙一定是单质
D.该反应可能是分解反应
11.科研人员制备了一种纳米催化剂,二氧化碳和水在其表面发生反应的微观示意图如图所示。下列说法正确的是( )
A.两种反应物的分子个数比为1:1
B.生成物 的化学式是CH4O
C.催化剂的化学性质在反应前后发生变化
D.原子的种类和数目在反应前后都发生变化
12.某物质1.6 g在空气中充分燃烧共生成4.4 g二氧化碳和3.6 g水。则下列说法正确的是( )
①该物质中一定含有氧元素;②该物质中一定不含氧元素;③该物质中一定含有碳、氢元素;④该物质的一个分子中碳、氢原子的个数比为1:4;⑤该物质中氢元素的质量分数最大。
A.①②③④⑤ B.②③④ C.③④⑤ D.②③④⑤
二、填空题(39分)
13.(10分)写出符合下列要求的化学方程式:
(1)有黑色固体生成的化合反应:_______________________________________。
(2)有两种单质生成的分解反应:_______________________________________。
(3)实验室制取二氧化碳的反应:_______________________________________。
(4)实验室检验二氧化碳的反应:_______________________________________。
(5)加热碳酸氢铵发生的反应:_________________________________________。
14.(5分)科学地利用燃烧反应,对人类生产和生活是非常重要的。
(1)煤的主要成分是碳。请写出碳在氧气不足时燃烧的化学方程式:__________________________________;为使煤充分燃烧,合理的做法是__________________________(写一种做法),这对于节约能源非常重要。
(2)做饭时,锅底出现黑色物质,需要调______(填“大”或“小”)炉具或灶具的进风口,使燃料充分燃烧。
(3)请写出成语“釜底抽薪”体现的灭火原理:____________________________。
(4)如果发现火险或遭遇火灾,应采取的应急措施是__________________(写出一条即可)。
15.(6分)学校运动会上短跑项目“发令枪”里的火药成分为KClO3、MnO2和红磷。当扣动扳机时,①撞针撞击火药,产生热量使KClO3分解产生O2;②并引燃红磷产生白烟。
(1)试分别写出这两步反应的化学方程式。①____________________;②_________________________,基本反应类型是________________。
(2)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X===NaClO+NaCl+H2O,则X的化学式为________。求出NaClO中氯元素化合价并在该化学式中表示出来____________。
(3)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是_______________________________。
16.(10分)我国科学家研制出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120 ℃下发生反应,反应微观模型如图所示。
(1)反应微观模型中,除钼外还有______种元素,有______种单质分子。
(2)该反应前后:①构成催化剂的各原子______(填“有”或“没有”)变化;
②金原子对______(填“CO”或“H2O”)起吸附催化作用;
③反应的化学方程式为_____________________________________________。
17.(8分)质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题:
(1)化学反应前后肯定没有变化的是________(填字母序号)。
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
(2)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为________________________,若固体质量变化用图甲表示,则m2与m1之差表示________________的质量。
(3)实验过程中,镁条点燃后实验现象如图乙所示,镁条完全燃烧后,称量得知石棉网上留下的固体质量反而比反应前的镁条还轻,其原因可能是_______________________________________________________________。
三、探究实验题(18分)
18.质量守恒定律是自然界最普遍、最重要的基本规律之一。某化学课外小组同学用如图1所示实验探究质量守恒定律。
(1)A实验加热细铜丝团一段时间后移走酒精灯,观察到铜丝表面变为黑色(CuO),细铜丝团______(填“上升”或“下沉”)。
(2)B实验中发生反应的化学方程式为____________________________。实验过程中,观察到小气球先变鼓再变瘪。其中“变鼓”的原因是________________________________________________________________。
(3)B、C、D三组实验充分反应并冷却至室温后最终天平不平衡的是________(填字母)。在B实验中,锥形瓶中物质的总质量随时间的变化关系如图2所示,正确的是________(填字母)。
(4)通过上述实验,你得到的启示是有气体参加或生成的反应,在验证质量守恒定律时应在________装置中进行。
四、计算题(7分)
19.实验室常用过氧化氢溶液在二氧化锰催化作用下分解制取氧气。若含6.8 g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
答案
一、1.C 2.B 3.B 4.B 5.B
6.B 点拨:煤气泄漏应迅速关闭煤气阀门,然后开窗通风,切不可打开排气扇,以防产生的电火花将煤气引燃。
7.A 8.A
9.B 点拨:根据质量守恒定律可知,化学反应前后原子种类和个数均不变,反应前各原子数目为4个C,12个H,18个O,2个S,反应后各原子数目为4个C,12个H,14个O,则1个X分子中含有2个O、1个S,可得X的化学式为SO2。X为化合物,不属于单质,A不正确;SO2中氧元素的质量分数为×100%=50%,B正确;X由硫、氧两种元素组成,C不正确;X中硫元素与氧元素的质量比为32:(16×2)=1:1,D不正确。
10.B 点拨:反应后甲的质量减少了70 g-35 g=35 g,所以甲是反应物,参加反应的甲的质量为35 g;乙的质量减少了15 g-7.5 g=7.5 g,所以乙是反应物,参加反应的乙的质量为7.5 g;丙的质量增加了48.75 g-6.25 g=42.5 g;反应前后丁的质量不变。参加反应的甲与乙的质量之和等于生成的丙的质量。反应前后,丙的质量不变,丙可能是催化剂,也可能没有参加反应;该反应可表示为甲+乙→丙,属于化合反应。
11.B 点拨:由反应的微观示意图可知,该反应的化学方程式是2CO2+4H2O2CH3OH+3O2。两种反应物二氧化碳和水的分子个数比为1:2,A错误;由分子的模型图可知,B正确;催化剂的化学性质在反应前后没有发生变化,C错误;由微粒的变化可知,原子的种类和数目在反应前后都没有发生变化,D错误。
12.B 点拨:由该物质在空气中充分燃烧生成二氧化碳和水,根据质量守恒定律可知,该物质中一定含有碳、氢元素,可能含有氧元素;4.4 g二氧化碳中含碳元素的质量为4.4 g×=1.2 g,3.6 g水中含氢元素的质量为3.6 g×=0.4 g,由于1.2 g+0.4 g=1.6 g,因此该物质中不含氧元素,只含C、H元素,①错误,②、③正确;该物质的一个分子中碳、氢原子的个数比为:=1:4,④正确;该物质为CH4,其中氢元素的质量分数最小,⑤错误,综上可知B正确。
二、13.(1)3Fe+2O2Fe3O4 (2)2H2O2H2↑+O2↑
(3)CaCO3+2HCl===CaCl2+H2O+CO2↑
(4)Ca(OH)2+CO2===CaCO3↓+H2O
(5)NH4HCO3NH3↑+H2O+CO2↑
14.(1)2C+O22CO;鼓入大量的空气(或将煤粉碎)
(2)大 (3)移走可燃物
(4)拨打火警电话119(合理答案均可)
15.(1)①2KClO32KCl+3O2↑
②4P+5O22P2O5;化合反应
(2)Cl2;NaO (3)MgH2+2H2O===Mg(OH)2+2H2↑
16.(1)4;1 (2)①没有 ②CO ③CO+H2OCO2+H2
17.(1)B (2)2Mg+O22MgO;参加反应的氧气
(3)部分生成物逸散到空气中去了
三、18.(1)下沉 (2)4P+5O22P2O5;白磷燃烧放热,导致锥形瓶中气压增大 (3)D;b (4)密闭
四、19.解:设最多可制得氧气的质量为x。
2H2O22H2O+O2↑
68 32
6.8 g x
= x=3.2 g
答:最多可制得氧气3.2 g。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
