第九单元溶液综合训练-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液综合训练-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 222.4KB | ||
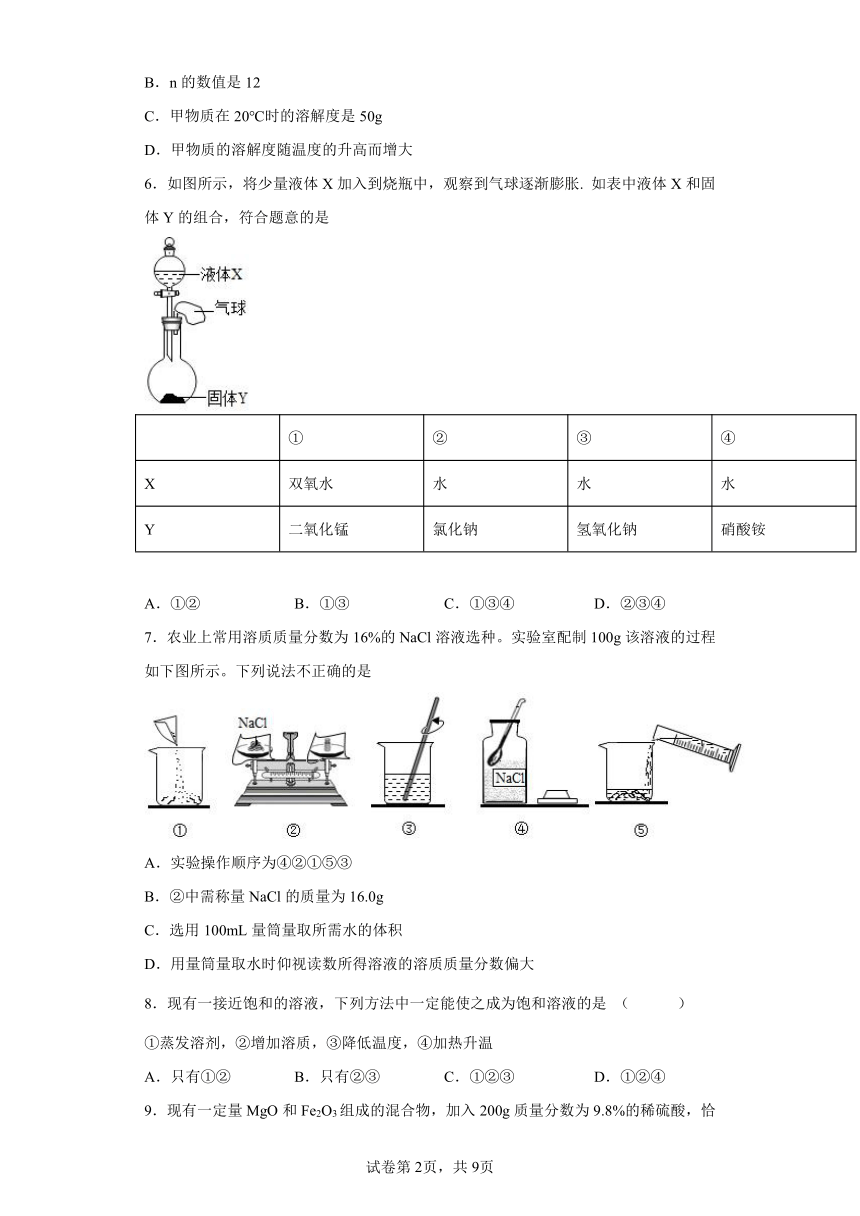
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 09:55:47 | ||
图片预览



文档简介
人教版九下 第九单元 溶液 综合训练
一、单选题
1.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
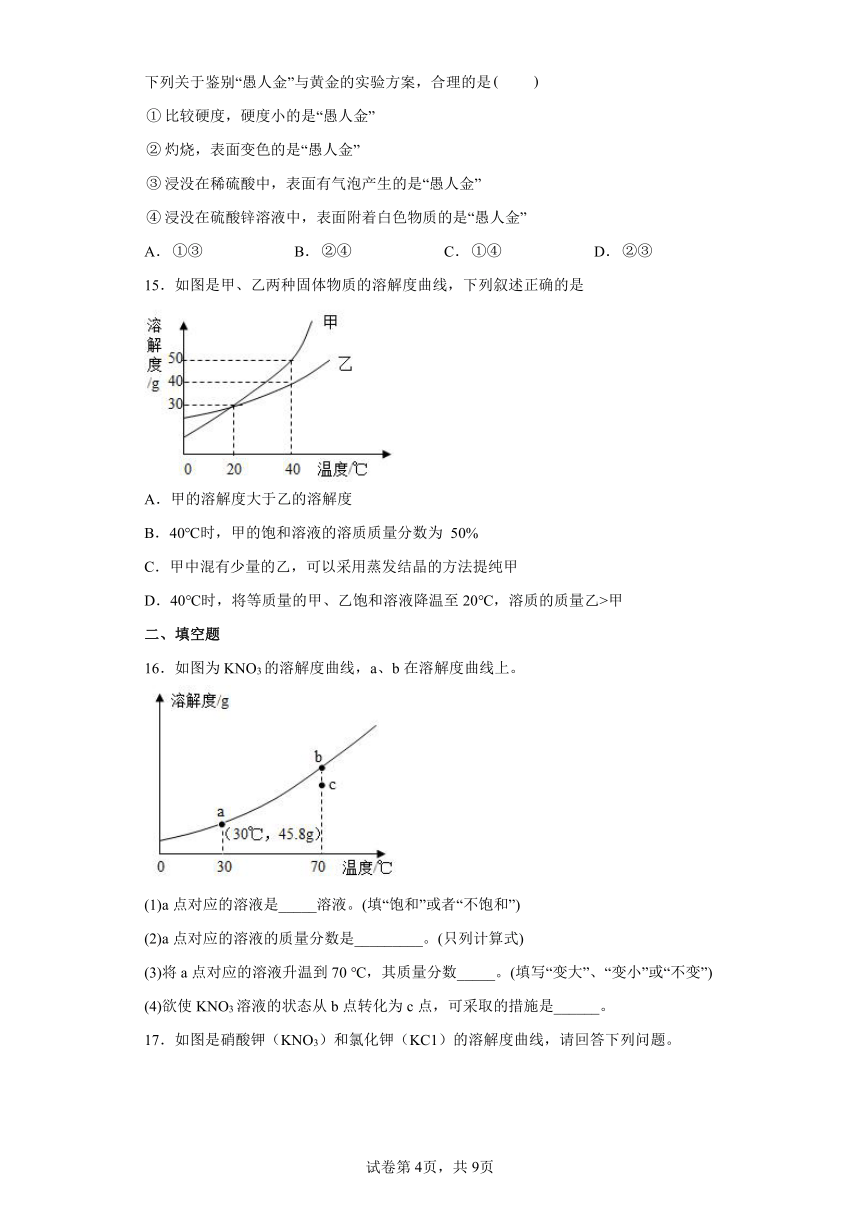
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
2.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
3.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
4.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
5.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
6.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
7.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
8.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
9.现有一定量MgO和Fe2O3组成的混合物,加入200g质量分数为9.8%的稀硫酸,恰好完全反应。下列判断中错误的是
A.上述过程中发生的都是中和反应
B.所加稀硫酸中溶质的质量为19.6g
C.所加稀硫酸中氢元素的质量为0.4g
D.原固体混合物中氧元素的质量为3.2g
10.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
11.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
12.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
13.下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
14.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
15.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
二、填空题
16.如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(1)a点对应的溶液是_____溶液。(填“饱和”或者“不饱和”)
(2)a点对应的溶液的质量分数是_________。(只列计算式)
(3)将a点对应的溶液升温到70 ℃,其质量分数_____。(填写“变大”、“变小”或“不变”)
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是______。
17.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
18.小华在饮用碳酸饮料时。发现有大量气泡溢出。他联系学过的知识从不同角度加以解释。从物理变化的角度解释为_____________________。从化学变化的角度解释为_____________________(化学方程式表示)。
19.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
三、综合应用题
20.实验室中,某化学兴趣小组取石灰石(杂质不反应也不溶于水)研成粉末后,做了如图所示实验:
请根据要求回答下列问题:
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解上述反应过程中生成二氧化碳的质量(x)的比例式为_______。
(3)该石灰石的纯度为____________。
(4)实验所用稀盐酸中溶质的质量分数为_____________。
(5)若用36.5%的盐酸配制实验所用稀盐酸,则需加入水的质量是______________。
(6)工业上煅烧100t该种石灰石可得到含杂质的生石灰的质量是____________。
21.CO2的捕集与资源化利用是化学研究的热点。
(1)控制CO2的排放,是为了减缓______效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中CO2,该方法以CaO捕集CO2,将所得产物在高温下煅烧可重新获得CaO,高温煅烧时反应的化学方程式为______,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的______性。
(3)对CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是______。
(4)CO2可用于食品保鲜,实验测得气体中CO2的体积分数与溶液pH的关系如图-1所示。
①气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中______浓度增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内CO2气体含量的变化,举出一种可通过颜色变化用于该智能化包装的物质______。
(5)已知一定条件下CO2与H2以质量比11:2反应可生成CH4,与该反应类似,不同条件下,CO2与H2反应也能生成甲醇(CH4O)。生成甲醇时参加反应的CO2与H2的质量比为______。
(6)为研究某公园中植物与大气间碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结果见图-2和图-3,通过测量其一年内每天空气中CO2含量等数据,分析所得碳交换的结果见图-4。碳交换以每月每平方米植物吸收或释放CO2的质量表示,正值为净吸收CO2,负值为净释放CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公回中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
22.2020年春节前后,我国大面积爆发新冠肺炎疫情。过氧乙酸是一种医疗上常用的广谱高效消毒剂,对公共场所进行消毒时使用过氧乙酸消毒液。过氧乙酸的分子结构如图所示。通过计算回答:
(1)过氧乙酸的相对分子质量是 ____ ,氧元素的质量分数为 _____ (精确到0.1%)。
(2)过氧乙酸是一种无色的液体,有辛辣味,具有强氧化性,温度稍高即分解放出氧气,并生成醋酸(C2H4O2)。请写出过氧乙酸分解的化学方程式为 ___________________ ,该反应的基本类型为 _________ 。
(3)过氧乙酸能杀灭病毒的主要原理是具有强氧化性,让病毒表面的蛋白质外壳变质,致使病毒死亡。强氧化性属于 ______ (填“物理”或“化学”)性质。
(4)溶质质量分数为0.5%的过氧乙酸溶液常用于空气和地面消毒。某小区要配制0.5%的过氧乙酸消毒溶液200kg,需要10%的过氧乙酸溶液 _____ kg,加水 _____ kg。
23.Ⅰ、水、溶液与人类的生产生活关系紧密。
(1)过氧化氢溶液是生活中常用一种外用消毒液,俗称双氧水,其溶剂是______。
(2)水很难能除去衣服、餐具上的油污,但洗涤剂能除去,是因为其具有______功能。
Ⅱ、下图是利用海水提取粗盐的过程。
(3)图中①是______(填“蒸发”或“冷却”)池。
(4)在①中,海水中氯化钠的质量分数逐渐______(填“变小”或“不变”或“变大”)。
(5)母液为氯化钠的______(填“饱和”或“不饱和”)溶液。
Ⅲ、如图是配制50g溶质质量分数为5%的NaCl溶液的操作示意图
(6)A和F处瓶塞放置正确的是______(填“A”或“F”):B处应称取氯化钠的质量是______g;
(7)E处玻璃棒的作用是______;F处装瓶虽有液体洒落,但对试剂瓶中的溶液的浓度无影响,原因是______;
(8)将已配好的50g质量分数为5%的NaCl溶液变成质量分数为16%的NaCl溶液,用于选种实验。需要再加NaCl的质量是______g(计算结果精确到0.1)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.D
4.B
5.C
6.B
7.D
8.A
9.A
10.D
11.B
12.D
13.D
14.D
15.D
16. 饱和 ×100% 不变 增加溶剂
17. < 210g 冷却结晶 d
18. 气体溶解度随压强减小而减小,打开饮料瓶塞,气压减小,二氧化碳溶解度降低,所以有大量气泡冒出 H2CO3====CO2↑+H2O
19. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
20. 80% 7.3% 320g 64.8t
21. 温室 增大 吸附 分子间隔 H2CO3 石蕊溶液 22:3 气温、光照强度 水分含量
22. 76 63.2% 分解反应 化学 10 190
23.(1)水##H2O
(2)乳化
(3)蒸发
(4)变大
(5)饱和
(6) F 2.5
(7) 搅拌,加快氯化钠的溶解速率 溶液有均一性
(8)6.5
答案第1页,共2页
答案第1页,共2页
一、单选题
1.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
2.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
3.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
4.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
5.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
6.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
7.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
8.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
9.现有一定量MgO和Fe2O3组成的混合物,加入200g质量分数为9.8%的稀硫酸,恰好完全反应。下列判断中错误的是
A.上述过程中发生的都是中和反应
B.所加稀硫酸中溶质的质量为19.6g
C.所加稀硫酸中氢元素的质量为0.4g
D.原固体混合物中氧元素的质量为3.2g
10.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
11.某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中溶液的溶质质量分数不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
12.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
13.下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
14.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
15.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
二、填空题
16.如图为KNO3的溶解度曲线,a、b在溶解度曲线上。
(1)a点对应的溶液是_____溶液。(填“饱和”或者“不饱和”)
(2)a点对应的溶液的质量分数是_________。(只列计算式)
(3)将a点对应的溶液升温到70 ℃,其质量分数_____。(填写“变大”、“变小”或“不变”)
(4)欲使KNO3溶液的状态从b点转化为c点,可采取的措施是______。
17.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
18.小华在饮用碳酸饮料时。发现有大量气泡溢出。他联系学过的知识从不同角度加以解释。从物理变化的角度解释为_____________________。从化学变化的角度解释为_____________________(化学方程式表示)。
19.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
三、综合应用题
20.实验室中,某化学兴趣小组取石灰石(杂质不反应也不溶于水)研成粉末后,做了如图所示实验:
请根据要求回答下列问题:
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解上述反应过程中生成二氧化碳的质量(x)的比例式为_______。
(3)该石灰石的纯度为____________。
(4)实验所用稀盐酸中溶质的质量分数为_____________。
(5)若用36.5%的盐酸配制实验所用稀盐酸,则需加入水的质量是______________。
(6)工业上煅烧100t该种石灰石可得到含杂质的生石灰的质量是____________。
21.CO2的捕集与资源化利用是化学研究的热点。
(1)控制CO2的排放,是为了减缓______效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中CO2,该方法以CaO捕集CO2,将所得产物在高温下煅烧可重新获得CaO,高温煅烧时反应的化学方程式为______,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的______性。
(3)对CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过程主要改变的是______。
(4)CO2可用于食品保鲜,实验测得气体中CO2的体积分数与溶液pH的关系如图-1所示。
①气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中______浓度增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内CO2气体含量的变化,举出一种可通过颜色变化用于该智能化包装的物质______。
(5)已知一定条件下CO2与H2以质量比11:2反应可生成CH4,与该反应类似,不同条件下,CO2与H2反应也能生成甲醇(CH4O)。生成甲醇时参加反应的CO2与H2的质量比为______。
(6)为研究某公园中植物与大气间碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结果见图-2和图-3,通过测量其一年内每天空气中CO2含量等数据,分析所得碳交换的结果见图-4。碳交换以每月每平方米植物吸收或释放CO2的质量表示,正值为净吸收CO2,负值为净释放CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公回中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
22.2020年春节前后,我国大面积爆发新冠肺炎疫情。过氧乙酸是一种医疗上常用的广谱高效消毒剂,对公共场所进行消毒时使用过氧乙酸消毒液。过氧乙酸的分子结构如图所示。通过计算回答:
(1)过氧乙酸的相对分子质量是 ____ ,氧元素的质量分数为 _____ (精确到0.1%)。
(2)过氧乙酸是一种无色的液体,有辛辣味,具有强氧化性,温度稍高即分解放出氧气,并生成醋酸(C2H4O2)。请写出过氧乙酸分解的化学方程式为 ___________________ ,该反应的基本类型为 _________ 。
(3)过氧乙酸能杀灭病毒的主要原理是具有强氧化性,让病毒表面的蛋白质外壳变质,致使病毒死亡。强氧化性属于 ______ (填“物理”或“化学”)性质。
(4)溶质质量分数为0.5%的过氧乙酸溶液常用于空气和地面消毒。某小区要配制0.5%的过氧乙酸消毒溶液200kg,需要10%的过氧乙酸溶液 _____ kg,加水 _____ kg。
23.Ⅰ、水、溶液与人类的生产生活关系紧密。
(1)过氧化氢溶液是生活中常用一种外用消毒液,俗称双氧水,其溶剂是______。
(2)水很难能除去衣服、餐具上的油污,但洗涤剂能除去,是因为其具有______功能。
Ⅱ、下图是利用海水提取粗盐的过程。
(3)图中①是______(填“蒸发”或“冷却”)池。
(4)在①中,海水中氯化钠的质量分数逐渐______(填“变小”或“不变”或“变大”)。
(5)母液为氯化钠的______(填“饱和”或“不饱和”)溶液。
Ⅲ、如图是配制50g溶质质量分数为5%的NaCl溶液的操作示意图
(6)A和F处瓶塞放置正确的是______(填“A”或“F”):B处应称取氯化钠的质量是______g;
(7)E处玻璃棒的作用是______;F处装瓶虽有液体洒落,但对试剂瓶中的溶液的浓度无影响,原因是______;
(8)将已配好的50g质量分数为5%的NaCl溶液变成质量分数为16%的NaCl溶液,用于选种实验。需要再加NaCl的质量是______g(计算结果精确到0.1)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.D
4.B
5.C
6.B
7.D
8.A
9.A
10.D
11.B
12.D
13.D
14.D
15.D
16. 饱和 ×100% 不变 增加溶剂
17. < 210g 冷却结晶 d
18. 气体溶解度随压强减小而减小,打开饮料瓶塞,气压减小,二氧化碳溶解度降低,所以有大量气泡冒出 H2CO3====CO2↑+H2O
19. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
20. 80% 7.3% 320g 64.8t
21. 温室 增大 吸附 分子间隔 H2CO3 石蕊溶液 22:3 气温、光照强度 水分含量
22. 76 63.2% 分解反应 化学 10 190
23.(1)水##H2O
(2)乳化
(3)蒸发
(4)变大
(5)饱和
(6) F 2.5
(7) 搅拌,加快氯化钠的溶解速率 溶液有均一性
(8)6.5
答案第1页,共2页
答案第1页,共2页
同课章节目录
