第5章 初识酸和碱 检测题-2021-2022学年九年级化学沪教版(上海)下册(word 含答案)
文档属性
| 名称 | 第5章 初识酸和碱 检测题-2021-2022学年九年级化学沪教版(上海)下册(word 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 140.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 11:14:33 | ||
图片预览



文档简介
第5章《初识酸和碱》检测题
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
2.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
3.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
4.NaOH可用于造纸和印染工业,NaOH属于
A.单质 B.酸 C.碱 D.盐
5.下列物质属于碱的是
A.NaHCO3 B.H2O C.NH3·H2O D.CH3COOH
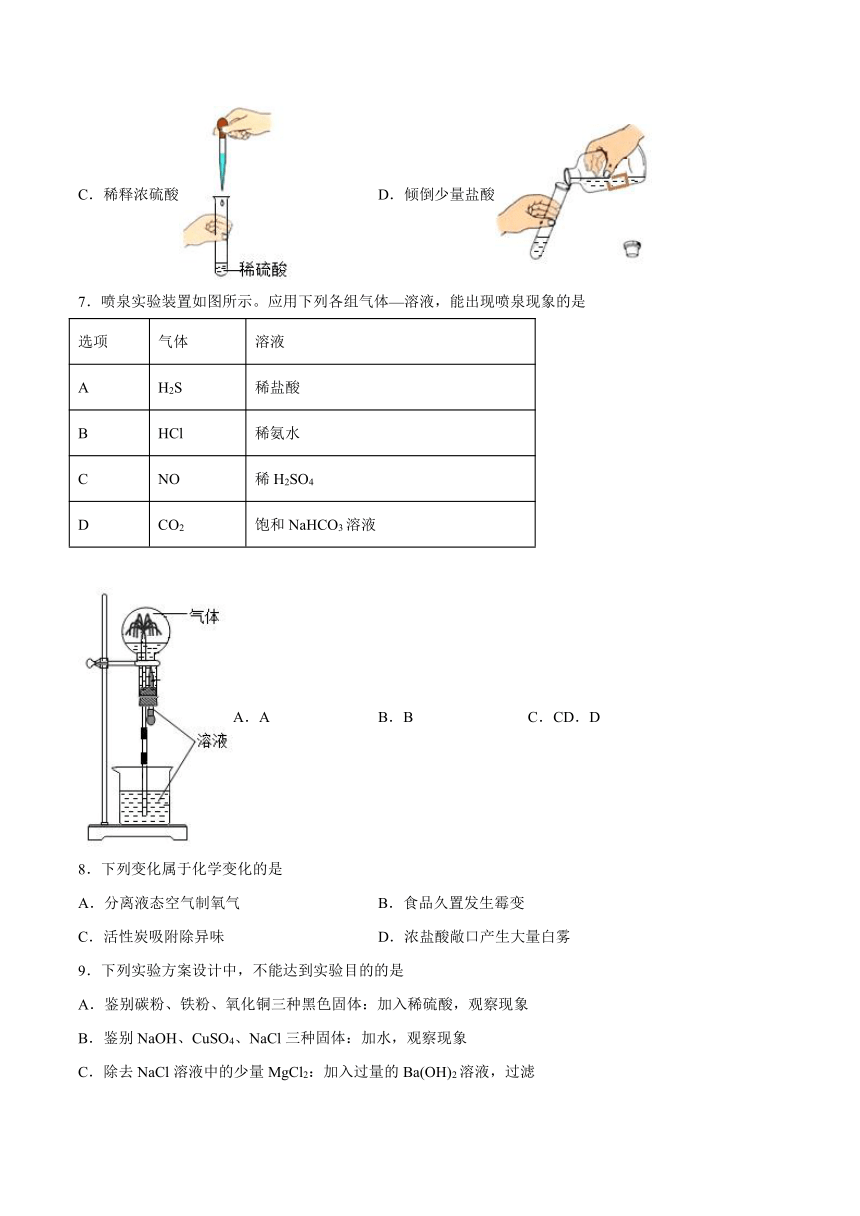
6.下图所示的有关化学实验操作正确的是
A.向试管中加入铁钉 B.检查装置气密性
C.稀释浓硫酸 D.倾倒少量盐酸
7.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
选项 气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
A.A B.B C.C D.D
8.下列变化属于化学变化的是
A.分离液态空气制氧气 B.食品久置发生霉变
C.活性炭吸附除异味 D.浓盐酸敞口产生大量白雾
9.下列实验方案设计中,不能达到实验目的的是
A.鉴别碳粉、铁粉、氧化铜三种黑色固体:加入稀硫酸,观察现象
B.鉴别NaOH、CuSO4、NaCl三种固体:加水,观察现象
C.除去NaCl溶液中的少量MgCl2:加入过量的Ba(OH)2溶液,过滤
D.除去CaCl2溶液中的少量HCl:加入过量的碳酸钙固体,过滤
10.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
11.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
12.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
二、简答题
13.金属镁可与热水反应生成氢氧化镁,所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,溶液变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)溶液红色褪去说明溶液的碱性____________________________________________
(填“增强”或“减弱”)。
(2)据你推测,导致溶液碱性变化的原因可能是________________________。
(3)设计一个实验来验证你的一种推测,简要说明操作、现象及结论:______________________________________________________________。
14.稀硫酸可以使紫色石蕊试液变红,我们已知道,在稀硫酸溶液中存在着水分子、硫酸根离子和氢离子,请你设计一个简单实验,研究下面的问题:可能是由于哪一种粒子,使紫色石蕊试剂变红。(写出简要的实验步骤,观察到的现象,已经由此得到的结论)
三、推断题
15.如图,物质王国中的A~F及X七种物质玩“独木桥”游戏,其中A~F分别是盐酸、氢气、氧化铁、氢氧化钙、碳酸钠、二氧化碳六种物质中的一种。
(1)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及的反应均为常见化学反应)。已知E的俗名为熟石灰。
①E的化学式是____________。
②C与D反应的化学方程式为___________________。
③E与F反应的现象是______________。
(2)过桥:若A~F分别通过一步反应直接转化为X,则X可成功过桥。物质X是_________。
16.A~I是初中化学常见物质。A与B在高温条件下反应生成C和D,该反应在工业上可用于冶炼金属,A和C是组成元素相同的两种气体,D在气体E中燃烧生成黑色固体B.D与F的溶液反应生成G和H,F可用于配制波尔多液。
(1)固态C的俗名是_____,实验室区分气体A和C的液体试剂为_____。
(2)E、F的化学式分别为_____、_____。
(3)A+BC+D的化学方程式为_____,D+F→G+H的反应类型是_____。
(4)向F的溶液中加入一定量的D,充分反应后,过滤,向滤渣中滴加I的稀溶液,有气泡产生,同时生成G,则滤渣的成分是_____,I的化学式为_____。
四、实验题
17.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为______________,分离B中难溶物的操作Ⅰ叫____________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择__________(填序号)进行实验。
①稀盐酸 ②酚酞溶液 ③CO2 ④NaCl溶液
(3)操作Ⅱ是加入NaOH固体后无色澄清液出现白色固体(NaOH固体全部溶解),则白色固体的化学式是_____________。
18.根据下列装置图,回答有关问题:
(1)图1中标号仪器的名称:①_______,②_______。
(2)利用图1中A、D装置的组合可以制取某种气体,实验室制取该气体的化学方程式是_____,验满方法是_______。
(3)实验室通常利用图1中装置B与_____的组合制取二氧化碳(选填字母),该反应的化学方程式为_____。若用C装置代替B装置进行实验,优点为_______。
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如图2)的导管按气流方向连接顺序是____(选填字母)。
A.a→b→d→c B.b→a→c→d C.d→c→a→b D.c→d→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为_______。
五、计算题
19.实验窒常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是______。
(2)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有______(填离子符号)。
②酸性废水中硫酸的质量分数为______(用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数______(写出计算过程,结果用百分数表示,保留到0.l%)。
20.课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀止,经过滤、洗涤,干燥后,称得沉淀物的质量为4.71g
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 第二次 第三次 第四次 第五次
固体质量/g 4.71 4.63 4.64 4.66 4.66
分析实验与表中数据后,回答:
(1)第一次实验测得数据明显偏高,可能的原因是______;
(2)五次测定结果的平均值是______;
(3)请利用(2)中数据计算:未知稀硫酸的质量分数是______。(不要求计算过程,计算结果精确到0.01)
参考答案:
1.D 2.B 3.C 4.C 5.C 6.B 7.B 8.B 9.C 10.D 11.B
12.A
13. 减弱 溶液吸收了空气中的CO2 做对比实验,让上述红色溶液分别在与空气接触、隔绝空气的条件下冷却,若前者褪色后者不褪色,则证明空气中的CO2使溶液碱性减弱,导致红色褪去
14.取少量Na2SO4溶液(内含有水分子、SO42-、Na+)放入一支洁净的试管,然后往其中滴加2~3滴紫色石蕊试剂,结果紫色石蕊试液仍然呈紫色,说明紫色石蕊试剂变红不是由于水分子和硫酸根离子引起的,说明稀硫酸可使紫色石蕊试剂变红,是由于H+的存在。
15. Ca(OH)2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 有白色沉淀产生 H2O
16. 干冰 澄清石灰水 O2 CuSO4 4CO+Fe3O43Fe+4CO2 置换反应 Cu、Fe H2SO4
17. 过滤 ②③ Ca(OH)2
18.(1) 酒精灯 水槽
(2) 用带火星的木条放在集气瓶口,若复燃则集满
(3) D 可以随时控制反应的发生和停止 C
19. 取样,滴入紫色石蕊试液,若变红则呈酸性(或其他合理答案) K+、H+ 5.6%的氢氧化钾溶液100g中氢氧化钾的质量100g×5.6%=5.6g,
设100g 硫酸中溶质的质量为x,生成的硫酸钾的质量为y解得x=4.9g,y=8.7g
酸性废水中硫酸的质量分数为 当废水处理至中性时,溶液中硫酸钾的质量分数为
20.(1)第一次产生的沉淀未充分干燥
(2)五次测定结果的平均值=;
(3)设:未知稀硫酸的质量分数为x。
x=19.60%
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
2.下列有关溶液的说法正确的是( )
A.均一、稳定的液体一定是溶液
B.稀释浓硫酸时,会放出大量的热
C.降低温度,不饱和溶液一定能变成饱和溶液
D.实验室利用氯化钠固体和水配制50g质量分数为6%的氯化钠溶液的步骤是:计算、量取、溶解、贮存
3.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
4.NaOH可用于造纸和印染工业,NaOH属于
A.单质 B.酸 C.碱 D.盐
5.下列物质属于碱的是
A.NaHCO3 B.H2O C.NH3·H2O D.CH3COOH
6.下图所示的有关化学实验操作正确的是
A.向试管中加入铁钉 B.检查装置气密性
C.稀释浓硫酸 D.倾倒少量盐酸
7.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
选项 气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
A.A B.B C.C D.D
8.下列变化属于化学变化的是
A.分离液态空气制氧气 B.食品久置发生霉变
C.活性炭吸附除异味 D.浓盐酸敞口产生大量白雾
9.下列实验方案设计中,不能达到实验目的的是
A.鉴别碳粉、铁粉、氧化铜三种黑色固体:加入稀硫酸,观察现象
B.鉴别NaOH、CuSO4、NaCl三种固体:加水,观察现象
C.除去NaCl溶液中的少量MgCl2:加入过量的Ba(OH)2溶液,过滤
D.除去CaCl2溶液中的少量HCl:加入过量的碳酸钙固体,过滤
10.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
11.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
12.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
二、简答题
13.金属镁可与热水反应生成氢氧化镁,所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,溶液变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)溶液红色褪去说明溶液的碱性____________________________________________
(填“增强”或“减弱”)。
(2)据你推测,导致溶液碱性变化的原因可能是________________________。
(3)设计一个实验来验证你的一种推测,简要说明操作、现象及结论:______________________________________________________________。
14.稀硫酸可以使紫色石蕊试液变红,我们已知道,在稀硫酸溶液中存在着水分子、硫酸根离子和氢离子,请你设计一个简单实验,研究下面的问题:可能是由于哪一种粒子,使紫色石蕊试剂变红。(写出简要的实验步骤,观察到的现象,已经由此得到的结论)
三、推断题
15.如图,物质王国中的A~F及X七种物质玩“独木桥”游戏,其中A~F分别是盐酸、氢气、氧化铁、氢氧化钙、碳酸钠、二氧化碳六种物质中的一种。
(1)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及的反应均为常见化学反应)。已知E的俗名为熟石灰。
①E的化学式是____________。
②C与D反应的化学方程式为___________________。
③E与F反应的现象是______________。
(2)过桥:若A~F分别通过一步反应直接转化为X,则X可成功过桥。物质X是_________。
16.A~I是初中化学常见物质。A与B在高温条件下反应生成C和D,该反应在工业上可用于冶炼金属,A和C是组成元素相同的两种气体,D在气体E中燃烧生成黑色固体B.D与F的溶液反应生成G和H,F可用于配制波尔多液。
(1)固态C的俗名是_____,实验室区分气体A和C的液体试剂为_____。
(2)E、F的化学式分别为_____、_____。
(3)A+BC+D的化学方程式为_____,D+F→G+H的反应类型是_____。
(4)向F的溶液中加入一定量的D,充分反应后,过滤,向滤渣中滴加I的稀溶液,有气泡产生,同时生成G,则滤渣的成分是_____,I的化学式为_____。
四、实验题
17.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为______________,分离B中难溶物的操作Ⅰ叫____________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择__________(填序号)进行实验。
①稀盐酸 ②酚酞溶液 ③CO2 ④NaCl溶液
(3)操作Ⅱ是加入NaOH固体后无色澄清液出现白色固体(NaOH固体全部溶解),则白色固体的化学式是_____________。
18.根据下列装置图,回答有关问题:
(1)图1中标号仪器的名称:①_______,②_______。
(2)利用图1中A、D装置的组合可以制取某种气体,实验室制取该气体的化学方程式是_____,验满方法是_______。
(3)实验室通常利用图1中装置B与_____的组合制取二氧化碳(选填字母),该反应的化学方程式为_____。若用C装置代替B装置进行实验,优点为_______。
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如图2)的导管按气流方向连接顺序是____(选填字母)。
A.a→b→d→c B.b→a→c→d C.d→c→a→b D.c→d→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为_______。
五、计算题
19.实验窒常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是______。
(2)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有______(填离子符号)。
②酸性废水中硫酸的质量分数为______(用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数______(写出计算过程,结果用百分数表示,保留到0.l%)。
20.课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀止,经过滤、洗涤,干燥后,称得沉淀物的质量为4.71g
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 第二次 第三次 第四次 第五次
固体质量/g 4.71 4.63 4.64 4.66 4.66
分析实验与表中数据后,回答:
(1)第一次实验测得数据明显偏高,可能的原因是______;
(2)五次测定结果的平均值是______;
(3)请利用(2)中数据计算:未知稀硫酸的质量分数是______。(不要求计算过程,计算结果精确到0.01)
参考答案:
1.D 2.B 3.C 4.C 5.C 6.B 7.B 8.B 9.C 10.D 11.B
12.A
13. 减弱 溶液吸收了空气中的CO2 做对比实验,让上述红色溶液分别在与空气接触、隔绝空气的条件下冷却,若前者褪色后者不褪色,则证明空气中的CO2使溶液碱性减弱,导致红色褪去
14.取少量Na2SO4溶液(内含有水分子、SO42-、Na+)放入一支洁净的试管,然后往其中滴加2~3滴紫色石蕊试剂,结果紫色石蕊试液仍然呈紫色,说明紫色石蕊试剂变红不是由于水分子和硫酸根离子引起的,说明稀硫酸可使紫色石蕊试剂变红,是由于H+的存在。
15. Ca(OH)2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 有白色沉淀产生 H2O
16. 干冰 澄清石灰水 O2 CuSO4 4CO+Fe3O43Fe+4CO2 置换反应 Cu、Fe H2SO4
17. 过滤 ②③ Ca(OH)2
18.(1) 酒精灯 水槽
(2) 用带火星的木条放在集气瓶口,若复燃则集满
(3) D 可以随时控制反应的发生和停止 C
19. 取样,滴入紫色石蕊试液,若变红则呈酸性(或其他合理答案) K+、H+ 5.6%的氢氧化钾溶液100g中氢氧化钾的质量100g×5.6%=5.6g,
设100g 硫酸中溶质的质量为x,生成的硫酸钾的质量为y解得x=4.9g,y=8.7g
酸性废水中硫酸的质量分数为 当废水处理至中性时,溶液中硫酸钾的质量分数为
20.(1)第一次产生的沉淀未充分干燥
(2)五次测定结果的平均值=;
(3)设:未知稀硫酸的质量分数为x。
x=19.60%
