第八章常见的酸、碱、盐章末综合练—2021~2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 第八章常见的酸、碱、盐章末综合练—2021~2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 164.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 15:54:03 | ||
图片预览



文档简介
科粤版九年级下册 八章 常见的酸、碱、盐 章末综合练
一、单选题
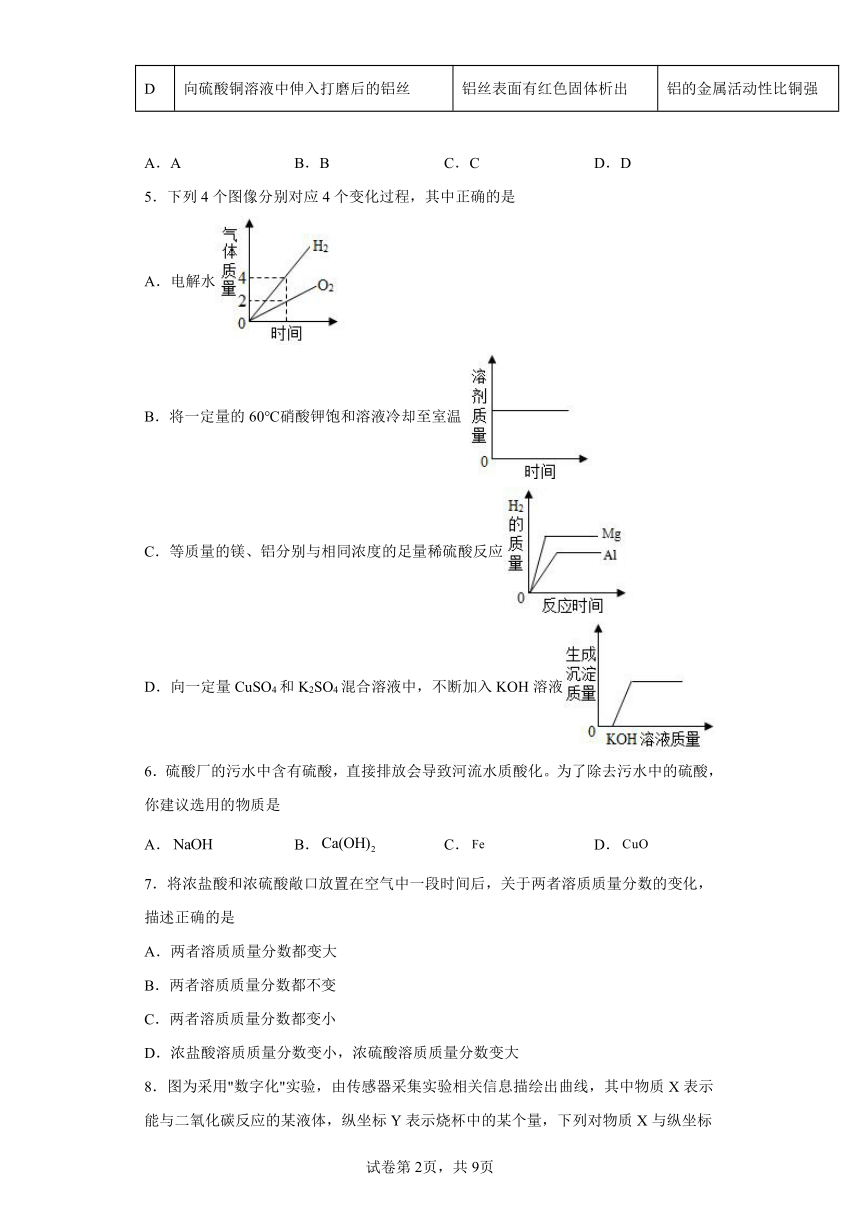
1.为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验。实验I、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色。下列说法不正确的是( )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
2.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
3.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4 B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KOH、Na2SO4、HCl、NaHCO3 D.HCl、NaNO3、K2SO4、NH4Cl
4.下列根据实验操作所得出的现象和结论均正确的是
选项 实验操作 实验现象 结论
A 向盛满二氧化碳的软塑料瓶中加入约三分之一体积的水,拧紧瓶盖振荡 软塑料瓶变瘪 二氧化碳能与水反应
B 用小木条蘸少量浓硫酸 小木条变成黑色 浓硫酸具有吸水性
C 点燃某无色气体,在火焰上方罩一个内壁涂有澄清石灰水的小烧杯 烧杯内壁澄清石灰水变浑浊 该无色气体为一氧化碳
D 向硫酸铜溶液中伸入打磨后的铝丝 铝丝表面有红色固体析出 铝的金属活动性比铜强
A.A B.B C.C D.D
5.下列4个图像分别对应4个变化过程,其中正确的是
A.电解水
B.将一定量的60℃硝酸钾饱和溶液冷却至室温
C.等质量的镁、铝分别与相同浓度的足量稀硫酸反应
D.向一定量CuSO4和K2SO4混合溶液中,不断加入KOH溶液
6.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
7.将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是
A.两者溶质质量分数都变大
B.两者溶质质量分数都不变
C.两者溶质质量分数都变小
D.浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大
8.图为采用"数字化"实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标Y表示烧杯中的某个量,下列对物质X与纵坐标Y的分析正确是
选项 物质X 纵坐标Y
A 水 溶液的质量
B 水 溶液的pH值
C 氢氧化钠溶液 溶质的质量
D 氢氧化钙溶液 溶液中钙元素的质量
A.A B.B C.C D.D
9.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
10.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
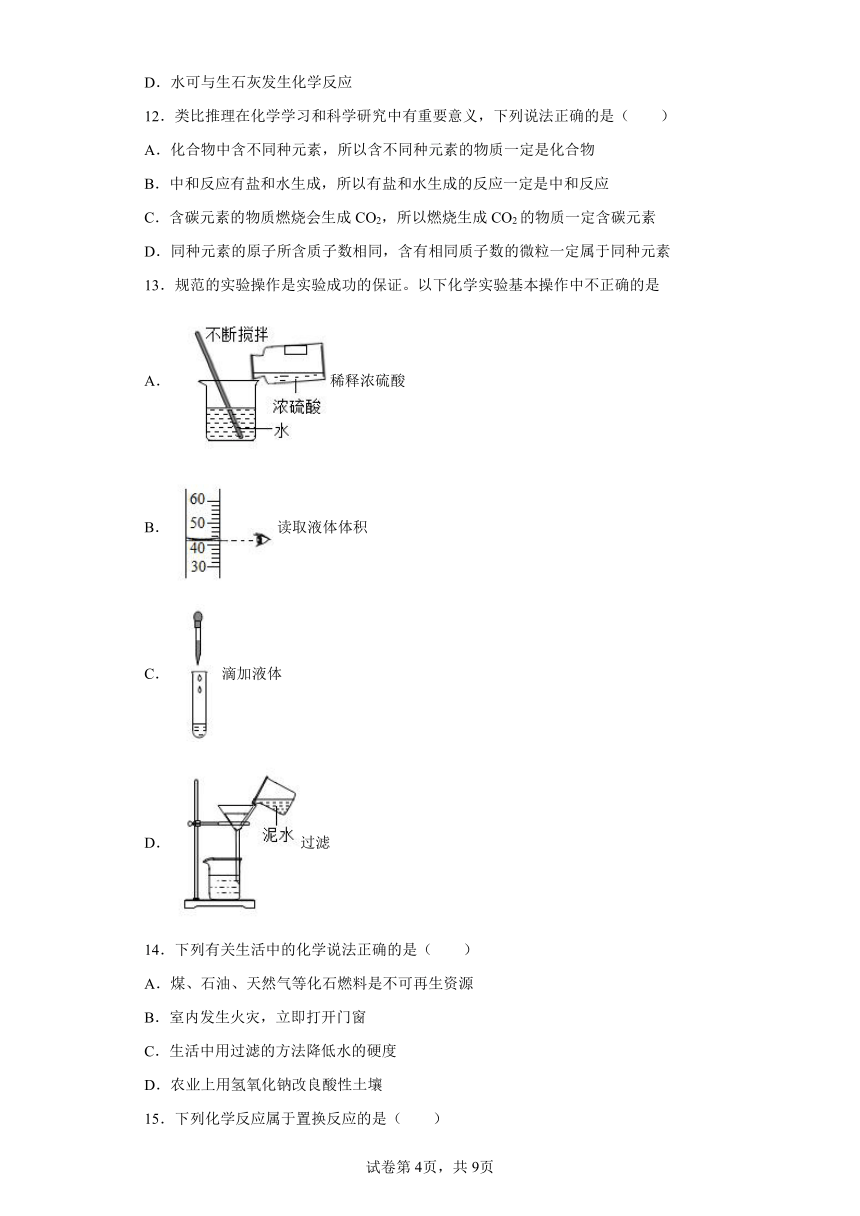
11.通过学习化学,我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙、镁化合物
D.水可与生石灰发生化学反应
12.类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素,所以含不同种元素的物质一定是化合物
B.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应
C.含碳元素的物质燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素
D.同种元素的原子所含质子数相同,含有相同质子数的微粒一定属于同种元素
13.规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
14.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
15.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
二、填空题
16.化学式“NaCl”读作_____,俗称_____,它由Na+和_____(填微粒符号)构成;小魏最近身体不适,经医院检查是胃酸(HCl)过多症,医生给他开了中成药“陈香露白露”(主要成分是碳酸氢钠),食后经常打饱嗝,用化学方程式表示其原理是_____。
17.金属及金属材料在生产、生活中有广泛的应用。
(1)我国自主研制的C919大型客机试飞成功,标志着我国飞机制造技术又有了新的突破。飞机外壳的主要材料是铝合金,“铝合金”属于______________(填“金属材料”或“合成材料”)。
(2)金、银在自然界有单质形式存在,说明他们的化学性质都______________,武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要______________(填“高”或“低”)。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17A112是特殊的储氢材料,完全吸收氢气后得到MgH2和A1,该反应的化学方程式为______________。
(4)向硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈无色,则滤出的固体一定有______________,滤液中含有的金属离子是______________(写离子符号)。
(5)若锌和镁混合物的质量为4.8g,与100g溶质质量分数为9.8%的稀硫酸恰好完全反应,则生成H2的质量为______________g。
18.(2020 郴州) H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH_____7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法_____。
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是_____(填写序号)。
①H2 ②CO2 ③NH3 ④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式:_____。
19.在下列空格中填写物质的名称或化学式,并指出所属的类别(单质、酸、碱、酸性氧化物、碱性氧化物)
名称 _____ 碳酸 _____ 二氧化碳 _____
化学式 He ______ _____ ____ Mg(OH)2
类别 ______ _____ 碱性氧化物 (写出一种即可) ____ ____
三、综合应用题
20.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 硫酸的质量分数 (均取20 mL) 锌的形状 (均取1g) 氢气的体积(mL)
① 20% 锌粒 31.7
② 20% 锌片 50.9
③ 30% 锌粒 61.7
④ 30% 锌片 79.9
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段 第1分钟 第2分钟 第3分钟 第4分钟 第5分钟 第6分钟
H2的体积 3.1mL 16.7mL 11.9mL 9.6mL 7.6mL 6.0mL
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:
①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。
21.如图所示为某些化肥制备的转化关系。A为空气,B为无色液体,是大理石的主要成分,C、F、H、J为气体,且H有刺激性气味。请根据图示回答问题:
(1)反应②的化学方程式为_______________。由此反应可知,在农业生产中施用铵态氮肥时应注意___________。
(2)H的化学式为____________,反应④的化学反应基本类型是______________。
(3)反应⑤的化学方程式为___________________。由于该反应合成的硝铵猛烈撞击易爆炸,在使用时应避免____________。
(4)自然界中普遍存在着F转化为C的反应,名称为____________;工业生产中用反应⑥合成尿素,用反应⑧合成碳铵,60kg的尿素与____________kg的碳铵肥效相当。
(5)试剂X的化学式是____________,图示中属于复合肥料的化学式是____________,反应⑦的化学方程式为______________。
(6)某庄稼呈比较明显的缺少氮、磷两种元素的症状。从化肥的功效和价格(见下表)等方面综合考虑,你认为应该购买的化肥是____________(填化学式)。
化肥 尿素 碳铵 磷矿粉 一铵 重钙
价格/(元/吨) 1200 500 500 1700 700
22.氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
23.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为____________(填“酸性”“碱性”“中性”),而且逐渐________(填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为____________(填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施________________________
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是____________。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为____________t。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.D
4.D
5.B
6.B
7.C
8.B
9.C
10.B
11.A
12.C
13.D
14.A
15.C
16. 氯化钠 食盐 Cl﹣ NaHCO3+HCl=NaCl+H2O+CO2↑
17. 金属材料 稳定 低 Ag、Cu Al3+、Zn2+ 0.2
18. < 用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,读出pH值 ③
19. 氦气 氧化铜 氢氧化镁 H2CO3 CuO CO2 单质 酸 酸性氧化物 碱
20. 根据进入量筒中水的体积,判断生成氢气的体积 f ①③或②④ 由慢到快然后逐渐减慢 反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢 (原因答对一个即可得分) 2NaOH + ZnS2O4 == Zn(OH)2 ↓+Na2S2O4 过滤 Na2S2O4 在碱性溶液中稳定 降低 Na2S2O4 在水中的溶解度 130g
21. 铵态氮肥不能与碱性物质混合使用 化合反应 硝铵接触易燃物(合理均可) 光合作用 158 、
22.(1)分解
(2)A
(3) NaCl、CuCl2 生成蓝色沉淀 设反应生成NaCl的质量为x,Cu(OH)2的质量为y。
解得: x=11.7g
解得: y=9.8g
则此时所得不饱和溶液中溶质的质量分数为:。
23. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
答案第1页,共2页
答案第1页,共2页
一、单选题
1.为探究二氧化碳能否和水反应,用四朵石蕊溶液染成紫色的干燥小花完成下图四个实验。实验I、Ⅳ中小花变红,实验Ⅱ、Ⅲ中小花不变色。下列说法不正确的是( )
A.实验Ⅰ、Ⅱ说明醋酸可以使小花变红
B.实验Ⅲ说明二氧化碳不能使小花变红
C.实验Ⅱ、Ⅲ、Ⅳ说明二氧化碳能与水发生化学反应
D.上述实验说明二氧化碳和醋酸具有相似的化学性质
2.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
3.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4 B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KOH、Na2SO4、HCl、NaHCO3 D.HCl、NaNO3、K2SO4、NH4Cl
4.下列根据实验操作所得出的现象和结论均正确的是
选项 实验操作 实验现象 结论
A 向盛满二氧化碳的软塑料瓶中加入约三分之一体积的水,拧紧瓶盖振荡 软塑料瓶变瘪 二氧化碳能与水反应
B 用小木条蘸少量浓硫酸 小木条变成黑色 浓硫酸具有吸水性
C 点燃某无色气体,在火焰上方罩一个内壁涂有澄清石灰水的小烧杯 烧杯内壁澄清石灰水变浑浊 该无色气体为一氧化碳
D 向硫酸铜溶液中伸入打磨后的铝丝 铝丝表面有红色固体析出 铝的金属活动性比铜强
A.A B.B C.C D.D
5.下列4个图像分别对应4个变化过程,其中正确的是
A.电解水
B.将一定量的60℃硝酸钾饱和溶液冷却至室温
C.等质量的镁、铝分别与相同浓度的足量稀硫酸反应
D.向一定量CuSO4和K2SO4混合溶液中,不断加入KOH溶液
6.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
7.将浓盐酸和浓硫酸敞口放置在空气中一段时间后,关于两者溶质质量分数的变化,描述正确的是
A.两者溶质质量分数都变大
B.两者溶质质量分数都不变
C.两者溶质质量分数都变小
D.浓盐酸溶质质量分数变小,浓硫酸溶质质量分数变大
8.图为采用"数字化"实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某液体,纵坐标Y表示烧杯中的某个量,下列对物质X与纵坐标Y的分析正确是
选项 物质X 纵坐标Y
A 水 溶液的质量
B 水 溶液的pH值
C 氢氧化钠溶液 溶质的质量
D 氢氧化钙溶液 溶液中钙元素的质量
A.A B.B C.C D.D
9.西汉时期,人们就会用石灰水或草木灰水(主要成分是K2CO2)等碱性溶液为丝麻脱胶来造纸。下列物质属于碱的是
A.生石灰 B.水 C.熟石灰 D.草木灰
10.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
11.通过学习化学,我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙、镁化合物
D.水可与生石灰发生化学反应
12.类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素,所以含不同种元素的物质一定是化合物
B.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应
C.含碳元素的物质燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素
D.同种元素的原子所含质子数相同,含有相同质子数的微粒一定属于同种元素
13.规范的实验操作是实验成功的保证。以下化学实验基本操作中不正确的是
A.稀释浓硫酸
B.读取液体体积
C.滴加液体
D.过滤
14.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
15.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
二、填空题
16.化学式“NaCl”读作_____,俗称_____,它由Na+和_____(填微粒符号)构成;小魏最近身体不适,经医院检查是胃酸(HCl)过多症,医生给他开了中成药“陈香露白露”(主要成分是碳酸氢钠),食后经常打饱嗝,用化学方程式表示其原理是_____。
17.金属及金属材料在生产、生活中有广泛的应用。
(1)我国自主研制的C919大型客机试飞成功,标志着我国飞机制造技术又有了新的突破。飞机外壳的主要材料是铝合金,“铝合金”属于______________(填“金属材料”或“合成材料”)。
(2)金、银在自然界有单质形式存在,说明他们的化学性质都______________,武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要______________(填“高”或“低”)。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17A112是特殊的储氢材料,完全吸收氢气后得到MgH2和A1,该反应的化学方程式为______________。
(4)向硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈无色,则滤出的固体一定有______________,滤液中含有的金属离子是______________(写离子符号)。
(5)若锌和镁混合物的质量为4.8g,与100g溶质质量分数为9.8%的稀硫酸恰好完全反应,则生成H2的质量为______________g。
18.(2020 郴州) H2SO4是一种重要的化工原料。
(1)H2SO4溶液的pH_____7(填“>”、“<”或“=”),请写出用pH试纸测定稀硫酸pH的正确方法_____。
(2)浓硫酸有吸水性,常用作某些气体的干燥剂,下列气体不能用浓硫酸干燥的是_____(填写序号)。
①H2 ②CO2 ③NH3 ④HCl
(3)实验室常用亚硫酸钠固体(Na2SO3)和70%左右的硫酸溶液发生复分解反应制取SO2,请写出该反应的化学方程式:_____。
19.在下列空格中填写物质的名称或化学式,并指出所属的类别(单质、酸、碱、酸性氧化物、碱性氧化物)
名称 _____ 碳酸 _____ 二氧化碳 _____
化学式 He ______ _____ ____ Mg(OH)2
类别 ______ _____ 碱性氧化物 (写出一种即可) ____ ____
三、综合应用题
20.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 硫酸的质量分数 (均取20 mL) 锌的形状 (均取1g) 氢气的体积(mL)
① 20% 锌粒 31.7
② 20% 锌片 50.9
③ 30% 锌粒 61.7
④ 30% 锌片 79.9
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段 第1分钟 第2分钟 第3分钟 第4分钟 第5分钟 第6分钟
H2的体积 3.1mL 16.7mL 11.9mL 9.6mL 7.6mL 6.0mL
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:
①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。
21.如图所示为某些化肥制备的转化关系。A为空气,B为无色液体,是大理石的主要成分,C、F、H、J为气体,且H有刺激性气味。请根据图示回答问题:
(1)反应②的化学方程式为_______________。由此反应可知,在农业生产中施用铵态氮肥时应注意___________。
(2)H的化学式为____________,反应④的化学反应基本类型是______________。
(3)反应⑤的化学方程式为___________________。由于该反应合成的硝铵猛烈撞击易爆炸,在使用时应避免____________。
(4)自然界中普遍存在着F转化为C的反应,名称为____________;工业生产中用反应⑥合成尿素,用反应⑧合成碳铵,60kg的尿素与____________kg的碳铵肥效相当。
(5)试剂X的化学式是____________,图示中属于复合肥料的化学式是____________,反应⑦的化学方程式为______________。
(6)某庄稼呈比较明显的缺少氮、磷两种元素的症状。从化肥的功效和价格(见下表)等方面综合考虑,你认为应该购买的化肥是____________(填化学式)。
化肥 尿素 碳铵 磷矿粉 一铵 重钙
价格/(元/吨) 1200 500 500 1700 700
22.氢氧化钠是实验室常用的一种化学药品。
(1)制取少量氢氧化钠可以用下面的流程:
步骤①属于____________反应(填“化合”“分解”“置换”“复分解”之一)。
(2)氢氧化钠有很强的腐蚀性,如果不小心沾到皮肤上,要立即用大量的水冲洗,然后涂上 (填序号)
A.硼酸溶液 B.碳酸氢钠溶液 C.稀硫酸 D.石灰水
(3)室温下,小雪同学将10%的氢氧化钠溶液,逐滴加入到29.8g氯化铜溶液中。
①当滴入氢氧化钠溶液40g时(即图中A点),烧杯中溶液里含有的溶质为(写化学式)____________。该反应过程中,观察到的一个明显反应现象是____________。
②当滴入10%氢氧化钠溶液80g时(即图中B点),恰好完全反应,试通过计算,求此时所得不饱和溶液中溶质的质量分数(计算结果精确到0.1)。__________________________________________。
23.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为____________(填“酸性”“碱性”“中性”),而且逐渐________(填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为____________(填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施________________________
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是____________。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为____________t。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.B
3.D
4.D
5.B
6.B
7.C
8.B
9.C
10.B
11.A
12.C
13.D
14.A
15.C
16. 氯化钠 食盐 Cl﹣ NaHCO3+HCl=NaCl+H2O+CO2↑
17. 金属材料 稳定 低 Ag、Cu Al3+、Zn2+ 0.2
18. < 用干燥、洁净的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,读出pH值 ③
19. 氦气 氧化铜 氢氧化镁 H2CO3 CuO CO2 单质 酸 酸性氧化物 碱
20. 根据进入量筒中水的体积,判断生成氢气的体积 f ①③或②④ 由慢到快然后逐渐减慢 反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢 (原因答对一个即可得分) 2NaOH + ZnS2O4 == Zn(OH)2 ↓+Na2S2O4 过滤 Na2S2O4 在碱性溶液中稳定 降低 Na2S2O4 在水中的溶解度 130g
21. 铵态氮肥不能与碱性物质混合使用 化合反应 硝铵接触易燃物(合理均可) 光合作用 158 、
22.(1)分解
(2)A
(3) NaCl、CuCl2 生成蓝色沉淀 设反应生成NaCl的质量为x,Cu(OH)2的质量为y。
解得: x=11.7g
解得: y=9.8g
则此时所得不饱和溶液中溶质的质量分数为:。
23. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
答案第1页,共2页
答案第1页,共2页
