第12章盐同步练习—2021-2022学年九年级化学京改版(2013)下册(word版 含答案)
文档属性
| 名称 | 第12章盐同步练习—2021-2022学年九年级化学京改版(2013)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 121.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-01 15:58:38 | ||
图片预览



文档简介
第12章盐同步练习2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列物质中,硬度最大的是( )
A.金刚石 B.石墨 C.铁矿石 D.石灰石
2.下列物质间不能发生复分解反应的是
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是
A.NH4HCO3 B.KNO3 C.Ca(H2PO4)2 D.(NH4)3PO4
5.构建元素化合价和物质类别的二维图是学习化学的一种重要方法。如图是小明绘制的硫元素的“价类二维图”,图中各点对应物质正确的是
A.SO2
B.SO3
C.H2SO4
D.Na2SO4
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.下列说法正确的是
A.洗洁精和汽油都能清洗油污,其原理相同
B.不饱和溶液转化为饱和溶液,溶质质量分数一定增大
C.某物质与熟石灰研磨,无刺激性气味,该物质一定不是氮肥
D.合金的硬度一般比各成分金属大,熔点一般比各成分金属低
8.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
9.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
10.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
二、简答题
11.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
12.我国拥有丰富的海洋资源,开发利用这些宝贵资源可有力地促进我国经济的发展。
从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质,下面是粗盐提纯的部分步骤。
请认真分析后,完成下列问题:
①操作1的名称是_____。
②在过滤操作中要用到的玻璃仪器有烧杯、漏斗、_____(填仪器名称)。
③在加热蒸发过程中,当蒸发皿中_____时,停止加热。
④经过以上步骤得到的食盐中还含有 CaCl2、MgCl2、Na2SO4等可溶性杂质,为除去杂质中的Na2SO4,应加入的物质是_____
A.BaCl2溶液
B.NaOH溶液
C.Na2CO3溶液
D.盐酸
13.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有。
(已知:)
方案甲:
方案乙:
方案丙:
试评价上述各种方案是否严密,并分别说明理由。
(1)方案甲:______;
(2)方案乙:______;
(3)方案丙:______;
三、推断题
14.2022年第24届冬季奥运会将在北京市和张家口市联合举行。如图所示,“五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是HCl、CuO、H2、CuSO4中的一种。
(1)物质A的化学式______。
(2)写出B与C发生反应的化学方程式______。NaOH与D发生的反应属于______反应(填写基本类型)。
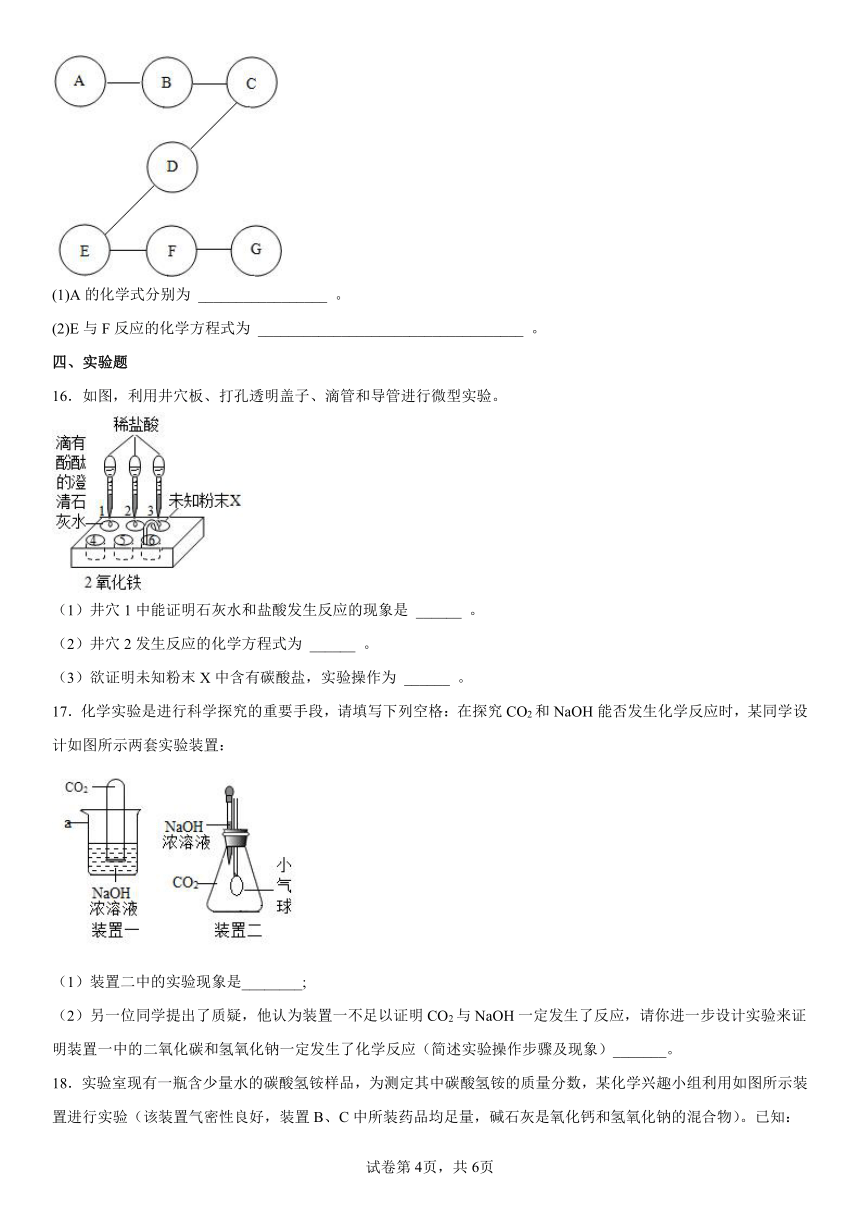
15.某智能手机屏幕解锁图形如图所示,若A、B、C、D、E、F、G分别是炭粉、水、二氧化碳、氧化铁、盐酸、氢氧化钙溶液、氯化铁溶液中的一种,其中B常用来改良酸性土壤,C是人体胃液中的主要成分。图中“——”表示两物质能发生反应。请完成下列各题:
(1)A的化学式分别为 _________________ 。
(2)E与F反应的化学方程式为 ___________________________________ 。
四、实验题
16.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
17.化学实验是进行科学探究的重要手段,请填写下列空格:在探究CO2和NaOH能否发生化学反应时,某同学设计如图所示两套实验装置:
(1)装置二中的实验现象是________;
(2)另一位同学提出了质疑,他认为装置一不足以证明CO2与NaOH一定发生了反应,请你进一步设计实验来证明装置一中的二氧化碳和氢氧化钠一定发生了化学反应(简述实验操作步骤及现象)_______。
18.实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:NH3能被酸溶液吸收。
部分实验步骤如下:
Ⅰ、打开弹簧夹,通入一段时间的氮气;
Ⅱ、关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ、当样品反应完全,…,再停止加热,直到玻璃管冷却;
Ⅳ、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)氨气溶于水显_____(填“酸性”、“中性”或“碱性”)。NH4HCO3属于_____(选填“氮肥”“磷肥”“钾肥”或“复合肥”),该物质中氮元素的化合价为_____。
(2)装置B中盛放的液体是_____。装置C中发生反应的化学方程式为_____,装置D的作用是_____。
(3)步骤Ⅲ中,当样品反应完全时的现象是_____,停止加热前应进行的操作是_____。
(4)该样品中碳酸氢铵的质量分数的表达式为_____(用m1、m2的代数式表示)。
五、计算题
19.某化肥由(NH4)2SO4,K2SO4、KCl混合而成,对提高农作物产量有重要作用。
(1)该化肥施用后,能使植物_____(填序号)
A.茎叶生长茂盛 B.增强抗寒抗旱能力 C.增强抗倒伏,抗虫害能力
(2)(NH4)2SO4中N、O两元素的质量比为_____(化成最简比)
(3)为测定该化肥样品中氮元素的质量分数,小民和小青分别按自己设计的方案进行了实验。
方案1:小民取10.0g样品溶于水,加入足量的BaCl2溶液,充分反应后,过滤、洗涤、干燥、称量得固体质量为16.5g
方案2:小青另取等质量的样品,加入足量的Ca(OH)2加热,将气体通过氢氧化钠固体和浓硫酸,氢氧化钠固体增重1.8g,浓硫酸增重1.7g(假设气体全部吸收)。
用方案1计算出的氮元素的质量分数偏大,简述理由_____。
用方案2计算该化肥样品中氮元素的质量分数数(请在答题纸上写出计算过程)。___________
20.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
21.某混合物由氯化钾和碳酸钾组成,取该混合物28g,其中含氧元素4.8g,向其中加入100g水全部溶解,然后滴加一定质量和溶质质量分数的氯化钡溶液,恰好完全反应,过滤得213.3g的滤液。计算:
(1)原混合物中氯化钾的质量;
(2)过滤后所得滤渣的质量;
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.B
5.D
6.C
7.D
8.C
9.B
10.D
11. 蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
12. 溶解 玻璃棒 出现较多固体 A
13. 不严密,因为含有而不含的无色溶液也会出现此方案的现象 严密,因为只有含有的无色溶液才会出现此方案的现象 不严密,因为含有而不含的无色溶液也会出现此方案的现象
14. H2 复分解
15. FeCl3 CO2+C2CO
16. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
17. 气球胀大 取少量装置一中的溶液于试管中,滴加足量稀盐酸,有气泡产生,说明二氧化碳与氢氧化钠发生反应生成了碳酸钠(是要合理即可)
18. 碱性 氮肥 -3 浓硫酸 CO2+2NaOH=Na2CO3+H2O 防止空气中的二氧化碳进入装置C 玻璃管中样品完全消失 打开弹簧夹,通入一段时间的氮气
19.(1)AC(2)7:16(3)硫酸钾也能与氯化钡反应生成硫酸钡沉淀,所以计算出硫酸铵的质量偏大,所以氮元素的质量偏大;4%
20.7.3%
21.(1)14.2g
(2)碳酸钾与氯化钡反应生成碳酸钡和氯化钾,故过滤后所得滤渣为碳酸钡,设生成碳酸钡的质量为x,反应生成氯化钾的质量为y
x=19.7g
y=14.9g
答:过滤后所得滤渣的质量为19.7g
(3)反应后所得溶液中溶质的质量分数:
答:反应后所得溶液中溶质的质量分数为13.6%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,硬度最大的是( )
A.金刚石 B.石墨 C.铁矿石 D.石灰石
2.下列物质间不能发生复分解反应的是
A.碳酸钠溶液和氯化钙溶液 B.氢氧化钠溶液和氯化钾溶液
C.碳酸钾溶液和盐酸 D.硫酸铜溶液和氯化钡溶液
3.下列各组物质的溶液中,不另加试剂则无法鉴别出来的是
A.H2SO4 NaOH CuSO4
B.HCl NaOH NaCl
C.H2SO4 Ca(OH)2 FeCl3
D.HCl Ca(OH)2 Na2CO3
4.公园里部分植物的枝叶枯黄,茎也比较纤细。建议工作人员最好给这些植物施用的一种化肥是
A.NH4HCO3 B.KNO3 C.Ca(H2PO4)2 D.(NH4)3PO4
5.构建元素化合价和物质类别的二维图是学习化学的一种重要方法。如图是小明绘制的硫元素的“价类二维图”,图中各点对应物质正确的是
A.SO2
B.SO3
C.H2SO4
D.Na2SO4
6.下列物质既可以做治疗胃酸的胃药,又可以做面点发酵剂的是
A.NaCl
B.NaOH
C.NaHCO3
D.Na2SO4
7.下列说法正确的是
A.洗洁精和汽油都能清洗油污,其原理相同
B.不饱和溶液转化为饱和溶液,溶质质量分数一定增大
C.某物质与熟石灰研磨,无刺激性气味,该物质一定不是氮肥
D.合金的硬度一般比各成分金属大,熔点一般比各成分金属低
8.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
9.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
10.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
二、简答题
11.在硫酸铜溶液中滴加石灰水,可以看到_____________,发生反应的方程式为_______________农业上用此配成_________液对农作物有很好的杀虫作用。
12.我国拥有丰富的海洋资源,开发利用这些宝贵资源可有力地促进我国经济的发展。
从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质,下面是粗盐提纯的部分步骤。
请认真分析后,完成下列问题:
①操作1的名称是_____。
②在过滤操作中要用到的玻璃仪器有烧杯、漏斗、_____(填仪器名称)。
③在加热蒸发过程中,当蒸发皿中_____时,停止加热。
④经过以上步骤得到的食盐中还含有 CaCl2、MgCl2、Na2SO4等可溶性杂质,为除去杂质中的Na2SO4,应加入的物质是_____
A.BaCl2溶液
B.NaOH溶液
C.Na2CO3溶液
D.盐酸
13.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有。
(已知:)
方案甲:
方案乙:
方案丙:
试评价上述各种方案是否严密,并分别说明理由。
(1)方案甲:______;
(2)方案乙:______;
(3)方案丙:______;
三、推断题
14.2022年第24届冬季奥运会将在北京市和张家口市联合举行。如图所示,“五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是HCl、CuO、H2、CuSO4中的一种。
(1)物质A的化学式______。
(2)写出B与C发生反应的化学方程式______。NaOH与D发生的反应属于______反应(填写基本类型)。
15.某智能手机屏幕解锁图形如图所示,若A、B、C、D、E、F、G分别是炭粉、水、二氧化碳、氧化铁、盐酸、氢氧化钙溶液、氯化铁溶液中的一种,其中B常用来改良酸性土壤,C是人体胃液中的主要成分。图中“——”表示两物质能发生反应。请完成下列各题:
(1)A的化学式分别为 _________________ 。
(2)E与F反应的化学方程式为 ___________________________________ 。
四、实验题
16.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
17.化学实验是进行科学探究的重要手段,请填写下列空格:在探究CO2和NaOH能否发生化学反应时,某同学设计如图所示两套实验装置:
(1)装置二中的实验现象是________;
(2)另一位同学提出了质疑,他认为装置一不足以证明CO2与NaOH一定发生了反应,请你进一步设计实验来证明装置一中的二氧化碳和氢氧化钠一定发生了化学反应(简述实验操作步骤及现象)_______。
18.实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:NH3能被酸溶液吸收。
部分实验步骤如下:
Ⅰ、打开弹簧夹,通入一段时间的氮气;
Ⅱ、关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ、当样品反应完全,…,再停止加热,直到玻璃管冷却;
Ⅳ、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)氨气溶于水显_____(填“酸性”、“中性”或“碱性”)。NH4HCO3属于_____(选填“氮肥”“磷肥”“钾肥”或“复合肥”),该物质中氮元素的化合价为_____。
(2)装置B中盛放的液体是_____。装置C中发生反应的化学方程式为_____,装置D的作用是_____。
(3)步骤Ⅲ中,当样品反应完全时的现象是_____,停止加热前应进行的操作是_____。
(4)该样品中碳酸氢铵的质量分数的表达式为_____(用m1、m2的代数式表示)。
五、计算题
19.某化肥由(NH4)2SO4,K2SO4、KCl混合而成,对提高农作物产量有重要作用。
(1)该化肥施用后,能使植物_____(填序号)
A.茎叶生长茂盛 B.增强抗寒抗旱能力 C.增强抗倒伏,抗虫害能力
(2)(NH4)2SO4中N、O两元素的质量比为_____(化成最简比)
(3)为测定该化肥样品中氮元素的质量分数,小民和小青分别按自己设计的方案进行了实验。
方案1:小民取10.0g样品溶于水,加入足量的BaCl2溶液,充分反应后,过滤、洗涤、干燥、称量得固体质量为16.5g
方案2:小青另取等质量的样品,加入足量的Ca(OH)2加热,将气体通过氢氧化钠固体和浓硫酸,氢氧化钠固体增重1.8g,浓硫酸增重1.7g(假设气体全部吸收)。
用方案1计算出的氮元素的质量分数偏大,简述理由_____。
用方案2计算该化肥样品中氮元素的质量分数数(请在答题纸上写出计算过程)。___________
20.在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7 g的AgCl沉淀,求盐酸的溶质质量分数。
21.某混合物由氯化钾和碳酸钾组成,取该混合物28g,其中含氧元素4.8g,向其中加入100g水全部溶解,然后滴加一定质量和溶质质量分数的氯化钡溶液,恰好完全反应,过滤得213.3g的滤液。计算:
(1)原混合物中氯化钾的质量;
(2)过滤后所得滤渣的质量;
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.B
5.D
6.C
7.D
8.C
9.B
10.D
11. 蓝色沉淀生成 CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 波尔多
12. 溶解 玻璃棒 出现较多固体 A
13. 不严密,因为含有而不含的无色溶液也会出现此方案的现象 严密,因为只有含有的无色溶液才会出现此方案的现象 不严密,因为含有而不含的无色溶液也会出现此方案的现象
14. H2 复分解
15. FeCl3 CO2+C2CO
16. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
17. 气球胀大 取少量装置一中的溶液于试管中,滴加足量稀盐酸,有气泡产生,说明二氧化碳与氢氧化钠发生反应生成了碳酸钠(是要合理即可)
18. 碱性 氮肥 -3 浓硫酸 CO2+2NaOH=Na2CO3+H2O 防止空气中的二氧化碳进入装置C 玻璃管中样品完全消失 打开弹簧夹,通入一段时间的氮气
19.(1)AC(2)7:16(3)硫酸钾也能与氯化钡反应生成硫酸钡沉淀,所以计算出硫酸铵的质量偏大,所以氮元素的质量偏大;4%
20.7.3%
21.(1)14.2g
(2)碳酸钾与氯化钡反应生成碳酸钡和氯化钾,故过滤后所得滤渣为碳酸钡,设生成碳酸钡的质量为x,反应生成氯化钾的质量为y
x=19.7g
y=14.9g
答:过滤后所得滤渣的质量为19.7g
(3)反应后所得溶液中溶质的质量分数:
答:反应后所得溶液中溶质的质量分数为13.6%。
答案第1页,共2页
答案第1页,共2页
