2021-2022学年下学期高二化学人教版(2019)选择性必修2第三章第四节配合物与超分子课件(25张ppt)
文档属性
| 名称 | 2021-2022学年下学期高二化学人教版(2019)选择性必修2第三章第四节配合物与超分子课件(25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-03 18:06:19 | ||
图片预览





文档简介
(共25张PPT)
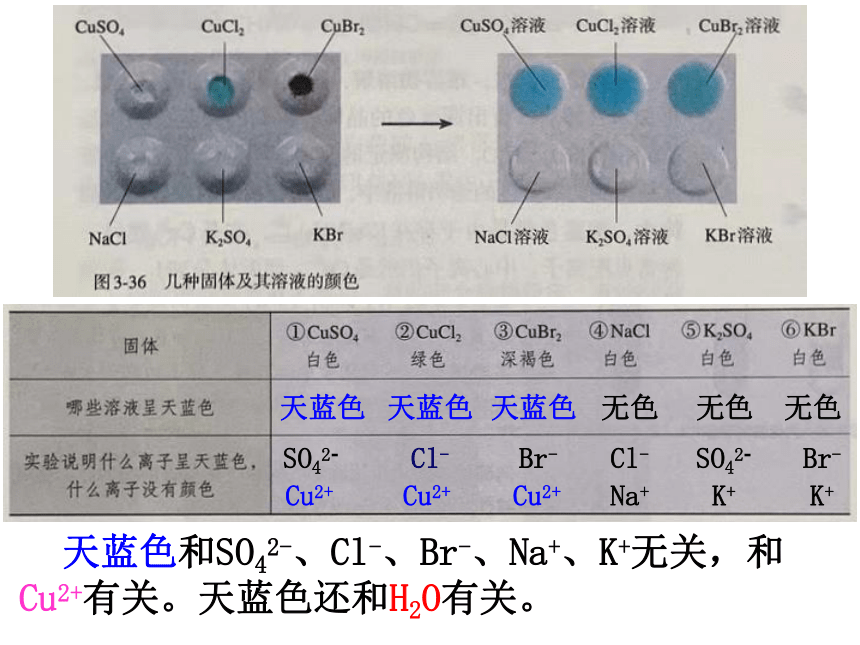
无水硫酸铜是白色的,但CuSO4·5H2O晶体却是蓝色的,这是为什么呢?
第四节 配合物与超分子
固体药品 ①CuSO4 ②CuCl2 ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
实验3-2 铜离子在水溶液中的颜色.mp4
天蓝色
天蓝色
天蓝色
无色
无色
无色
天蓝色和SO42-、Cl-、Br-、Na+、K+无关,和 Cu2+有关。天蓝色还和H2O有关。
SO42-
Cu2+
Cl-
Cu2+
Br-
Cu2+
Cl-
Na+
SO42-
K+
Br-
K+
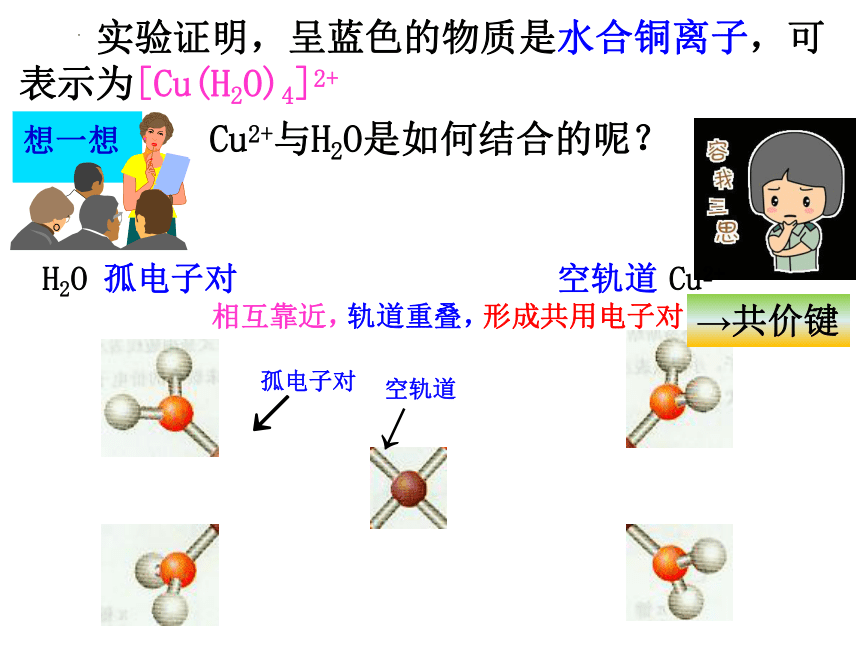
实验证明,呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+
想一想
Cu2+与H2O是如何结合的呢?
H2O
孤电子对
Cu2+
空轨道
相互靠近,
↙
孤电子对
↓
空轨道
轨道重叠,
形成共用电子对
→共价键
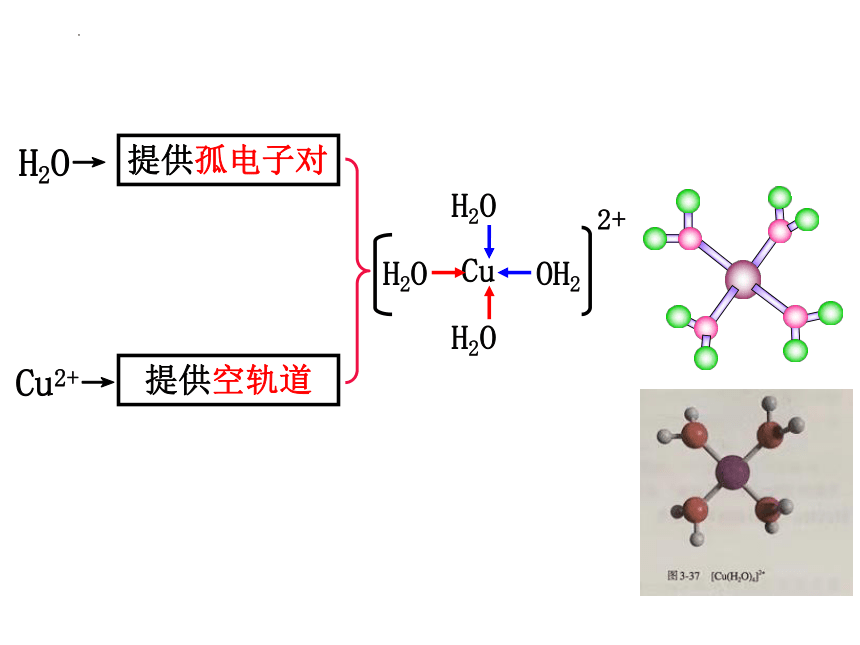
Cu2+→
提供空轨道
H2O→
提供孤电子对
H2O
Cu
H2O
H2O
OH2
2+
一、配合物
⒈配位键
⑴概念:
由一个原子单方面提供孤电子对,而另一个原子或离子提供空轨道而形成的化学键,即“电子对给予—接受”键,是一类特殊的共价键。
提供空轨道的原子或离子称为中心原子或离子,提供孤电子对的原子对应的分子或离子称为配体或配位体。
⑵表示方法:
(电子对给予体)A→B(电子对接受体)或A—B表示
H
O
H
H
例如:H3O+的结构式为:
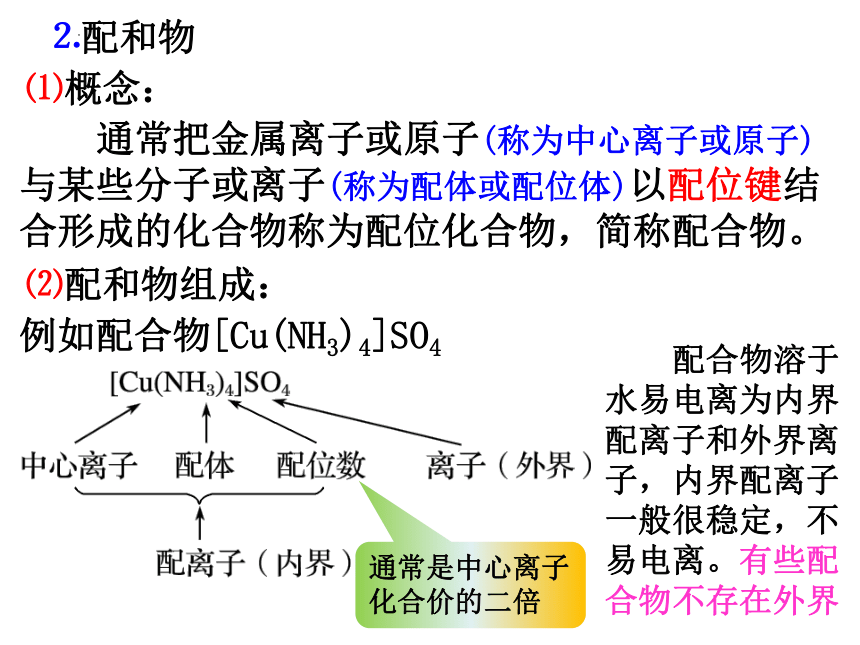
⒉配和物
⑴概念:
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
⑵配和物组成:
例如配合物[Cu(NH3)4]SO4
通常是中心离子化合价的二倍
配合物溶于水易电离为内界配离子和外界离子,内界配离子一般很稳定,不易电离。有些配合物不存在外界
⑶形成条件
①中心原子或离子要有空轨道
Ⅰ主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金属元素的离子;
Ⅱ具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
Ⅲ不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子,
Ⅳ碱金属、碱土金属等可作为螯合物的形成体。
Cl
C
N
孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。
含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、
(一方提供孤电子对,另一方提供空轨道)
②配体中的原子要有孤电子对
⑷配位数
与中心离子直接以配位键结合的配位原子个数。
例:[AlF6]3- 配位数6 、[Cu(NH3)4]SO4 配位数4
①配位阴离子配合物--配位阴离子“酸”外界
K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾
②配位阳离子配合物——“某化某”或“某酸某”
[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)
⑸配和物的命名
③中性配合物
[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0)
⑸常见配合物的形成实验
实验3-3四氨合铜离子的生成.mp4
现象:
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
乙醇
Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Cu(OH)2
[Cu(NH3)4]SO4 H2O
↘
↗
↘
配位键的稳定性不一样
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
现象:
Fe3+ + 3SCN- = Fe(SCN)3
实验3-4 铁离子与硫氰根离子的反应.mp4
实验3-5 银氨离子的生成.mp4
现象:
Ag+ + Cl- = AgCl↓
AgCl + 2NH3 = [Ag(NH3)2]Cl
⑹配合物形成时对性质的影响
①对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或溶解于含过量能与金属离子形成可溶性配合物的离子的溶液中,导致溶解性增强。
②颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
③稳定性增强
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
①在生命体中的应用
叶绿素
血红蛋白
酶→含锌的配合物80多种
维生素B12(钴配合物)
⑺配和物的应用:
②在医药中的应用
③配合物与生物固氮
④在生产生活中的应用
王水溶金
抗癌药物
固氮酶
照相技术的定影
电解氧化铝的助熔剂Na3[AlF6]
热水瓶胆镀银
H[AuCl4]
⒈配合物中可能只有配位键,如 Fe(CO)5;可能含有离子键,如[Cu(H2O)4]SO4中含有离子键。
⒉配合物中内界的配体一般比较稳定,很难发生电离。如[CoC1(NH3)5]Cl2·NH3中内界的Cl-无法与Ag+反应生成AgCl沉淀
水和其他电子给予体,与中心原子或离子的
结合能力一样吗?
拓展延伸!
配位键的稳定性
Cu(OH)2
[Cu(NH3)4]SO4 H2O
↘
↗
↘
配位键的稳定性不一样
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
实验3-3
配位键的稳定性:
向实验[3—3]深蓝色溶液中滴加硫酸,观察实验现象,由此现象变化说明了什么
深蓝色溶液
Cu
H3N
2+
NH3
NH3
NH3
H2O
Cu
H2O
H2O
OH2
2+
天蓝色溶液
+硫酸
天蓝色溶液
H2O
Cu
H2O
H2O
OH2
2+
H
N
H
H
H
Cu2+
H2O
<
Cu2+
NH3
<
H+ NH3
NH3 + H+ = NH4+
+
H+ >过渡金属 >主族金属
思维启迪
确定配合物化学式的基本步骤
二、超分子
⒈概念
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
超分子定义中的分子是广义的,包括离子。超分子有的是有限的,有的是无限伸展的。
⒉特征
⑴分子识别
如C60和C70的分离。
⑵自组装
如人体细胞和细胞器的双分子膜是由大量两性分子组装而成的。
⒊应用实例
⑴“杯酚”分离C60和C70
“杯酚”分子中含有苯环结构
⑵冠醚识别碱金属离子
不同大小空穴的冠醚可以识别不同大小的碱金属离子。
1.冠醚与碱金属离子之间的配位键属于离子键、共价键、氢键还是分子间作用力?
深度思考
2.冠醚与碱金属离子形成配合物得到的晶体里还有什么粒子,这类晶体是离子晶体、共价晶体还是分子晶体?
无水硫酸铜是白色的,但CuSO4·5H2O晶体却是蓝色的,这是为什么呢?
第四节 配合物与超分子
固体药品 ①CuSO4 ②CuCl2 ③CuBr2 ④NaCl ⑤K2SO4 ⑥KBr
颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
实验3-2 铜离子在水溶液中的颜色.mp4
天蓝色
天蓝色
天蓝色
无色
无色
无色
天蓝色和SO42-、Cl-、Br-、Na+、K+无关,和 Cu2+有关。天蓝色还和H2O有关。
SO42-
Cu2+
Cl-
Cu2+
Br-
Cu2+
Cl-
Na+
SO42-
K+
Br-
K+
实验证明,呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+
想一想
Cu2+与H2O是如何结合的呢?
H2O
孤电子对
Cu2+
空轨道
相互靠近,
↙
孤电子对
↓
空轨道
轨道重叠,
形成共用电子对
→共价键
Cu2+→
提供空轨道
H2O→
提供孤电子对
H2O
Cu
H2O
H2O
OH2
2+
一、配合物
⒈配位键
⑴概念:
由一个原子单方面提供孤电子对,而另一个原子或离子提供空轨道而形成的化学键,即“电子对给予—接受”键,是一类特殊的共价键。
提供空轨道的原子或离子称为中心原子或离子,提供孤电子对的原子对应的分子或离子称为配体或配位体。
⑵表示方法:
(电子对给予体)A→B(电子对接受体)或A—B表示
H
O
H
H
例如:H3O+的结构式为:
⒉配和物
⑴概念:
通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
⑵配和物组成:
例如配合物[Cu(NH3)4]SO4
通常是中心离子化合价的二倍
配合物溶于水易电离为内界配离子和外界离子,内界配离子一般很稳定,不易电离。有些配合物不存在外界
⑶形成条件
①中心原子或离子要有空轨道
Ⅰ主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金属元素的离子;
Ⅱ具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
Ⅲ不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子,
Ⅳ碱金属、碱土金属等可作为螯合物的形成体。
Cl
C
N
孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。
含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、
(一方提供孤电子对,另一方提供空轨道)
②配体中的原子要有孤电子对
⑷配位数
与中心离子直接以配位键结合的配位原子个数。
例:[AlF6]3- 配位数6 、[Cu(NH3)4]SO4 配位数4
①配位阴离子配合物--配位阴离子“酸”外界
K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾
②配位阳离子配合物——“某化某”或“某酸某”
[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)
⑸配和物的命名
③中性配合物
[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0)
⑸常见配合物的形成实验
实验3-3四氨合铜离子的生成.mp4
现象:
[Cu(NH3)4]2+ + SO42- + H2O = [Cu(NH3)4]SO4·H2O↓
乙醇
Cu2+ + 2NH3·H2O = Cu(OH)2↓+ 2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Cu(OH)2
[Cu(NH3)4]SO4 H2O
↘
↗
↘
配位键的稳定性不一样
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
现象:
Fe3+ + 3SCN- = Fe(SCN)3
实验3-4 铁离子与硫氰根离子的反应.mp4
实验3-5 银氨离子的生成.mp4
现象:
Ag+ + Cl- = AgCl↓
AgCl + 2NH3 = [Ag(NH3)2]Cl
⑹配合物形成时对性质的影响
①对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或溶解于含过量能与金属离子形成可溶性配合物的离子的溶液中,导致溶解性增强。
②颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
③稳定性增强
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
①在生命体中的应用
叶绿素
血红蛋白
酶→含锌的配合物80多种
维生素B12(钴配合物)
⑺配和物的应用:
②在医药中的应用
③配合物与生物固氮
④在生产生活中的应用
王水溶金
抗癌药物
固氮酶
照相技术的定影
电解氧化铝的助熔剂Na3[AlF6]
热水瓶胆镀银
H[AuCl4]
⒈配合物中可能只有配位键,如 Fe(CO)5;可能含有离子键,如[Cu(H2O)4]SO4中含有离子键。
⒉配合物中内界的配体一般比较稳定,很难发生电离。如[CoC1(NH3)5]Cl2·NH3中内界的Cl-无法与Ag+反应生成AgCl沉淀
水和其他电子给予体,与中心原子或离子的
结合能力一样吗?
拓展延伸!
配位键的稳定性
Cu(OH)2
[Cu(NH3)4]SO4 H2O
↘
↗
↘
配位键的稳定性不一样
H2O
Cu
H2O
H2O
OH2
2+
NH3
Cu
NH3
H3N
NH3
2+
实验3-3
配位键的稳定性:
向实验[3—3]深蓝色溶液中滴加硫酸,观察实验现象,由此现象变化说明了什么
深蓝色溶液
Cu
H3N
2+
NH3
NH3
NH3
H2O
Cu
H2O
H2O
OH2
2+
天蓝色溶液
+硫酸
天蓝色溶液
H2O
Cu
H2O
H2O
OH2
2+
H
N
H
H
H
Cu2+
H2O
<
Cu2+
NH3
<
H+ NH3
NH3 + H+ = NH4+
+
H+ >过渡金属 >主族金属
思维启迪
确定配合物化学式的基本步骤
二、超分子
⒈概念
由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
超分子定义中的分子是广义的,包括离子。超分子有的是有限的,有的是无限伸展的。
⒉特征
⑴分子识别
如C60和C70的分离。
⑵自组装
如人体细胞和细胞器的双分子膜是由大量两性分子组装而成的。
⒊应用实例
⑴“杯酚”分离C60和C70
“杯酚”分子中含有苯环结构
⑵冠醚识别碱金属离子
不同大小空穴的冠醚可以识别不同大小的碱金属离子。
1.冠醚与碱金属离子之间的配位键属于离子键、共价键、氢键还是分子间作用力?
深度思考
2.冠醚与碱金属离子形成配合物得到的晶体里还有什么粒子,这类晶体是离子晶体、共价晶体还是分子晶体?
