人教版九年级化学下册单元习题检测--第九单元-溶液 (word版无答案)
文档属性
| 名称 | 人教版九年级化学下册单元习题检测--第九单元-溶液 (word版无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 372.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-02 20:22:21 | ||
图片预览


文档简介
人教版九年级化学下册单元习题检测
第九单元 溶液(二)
考点一 溶解度曲线综合计算
例 1. 甲乙丙三种物质的溶解度曲线如右图所示, 据此回答下列问题.
(1)p点的的意义是
(2)t1°C 时甲、乙、丙溶解度由大到小的顺序
从甲溶液中获取甲晶体可用 的方法获取晶体;乙溶液中混
有少量的物质甲,用 的方法获取乙晶体。
(4)t2℃C时, 向 30g 甲物质中加入 50g 水,充分溶解后,所得溶液质量为 , 将其升高到 t3°C 时, 所得溶液中溶质和溶液质量比为 。
(5)t4℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序
将 t4℃时甲、乙、丙三种物质的饱和溶液降温至 t1℃,所得溶液的溶质质量为 , 质量分数由大到小的顺序为 。
例 2. I.根据 KN03 和 NaCl 溶解度曲线(如图), 回答下列问题:
(1)l0°C时 KN03的溶解度NaCl 的溶解度(选填 "> ”“ < ”“ =") ;
(2)t°C时, 将 mg KN03 、ng NaCl 分别溶解在 20mL 水中恰好饱和, 则 m n
( 选 填 “> ”、“ < ”、“ =”) ;
(3)20°C时, KN03饱和溶液中溶质的质量分数约为
打开可乐瓶, 溢出大量气体,由此可见, 压强越小, CO2 的溶解度越 。
若要加大二氧化碳溶解的量可采用的一种方法是
II.不同温度下,氧气的溶解度随压强的变化如图 2 所示,图中 tl 对应的温度 40°C ,
则 t2 对应的温度 (填序号).
a.大于 40°C b. 小于 40°C C. 无法确定
练 1. 在 t1°C 时, 将等质量的硝酸钾和氯化钾分别加入到各盛有 100g 水的两个烧杯中, 充分搅拌后现象如图甲所示, 硝酸钾和氯化钾的溶解度曲线如图乙所示.下列说法错误( )
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯②中溶液质量比烧杯①中溶液质量大
D.将温度升高到 t °C , 烧杯②中的固体全部溶解
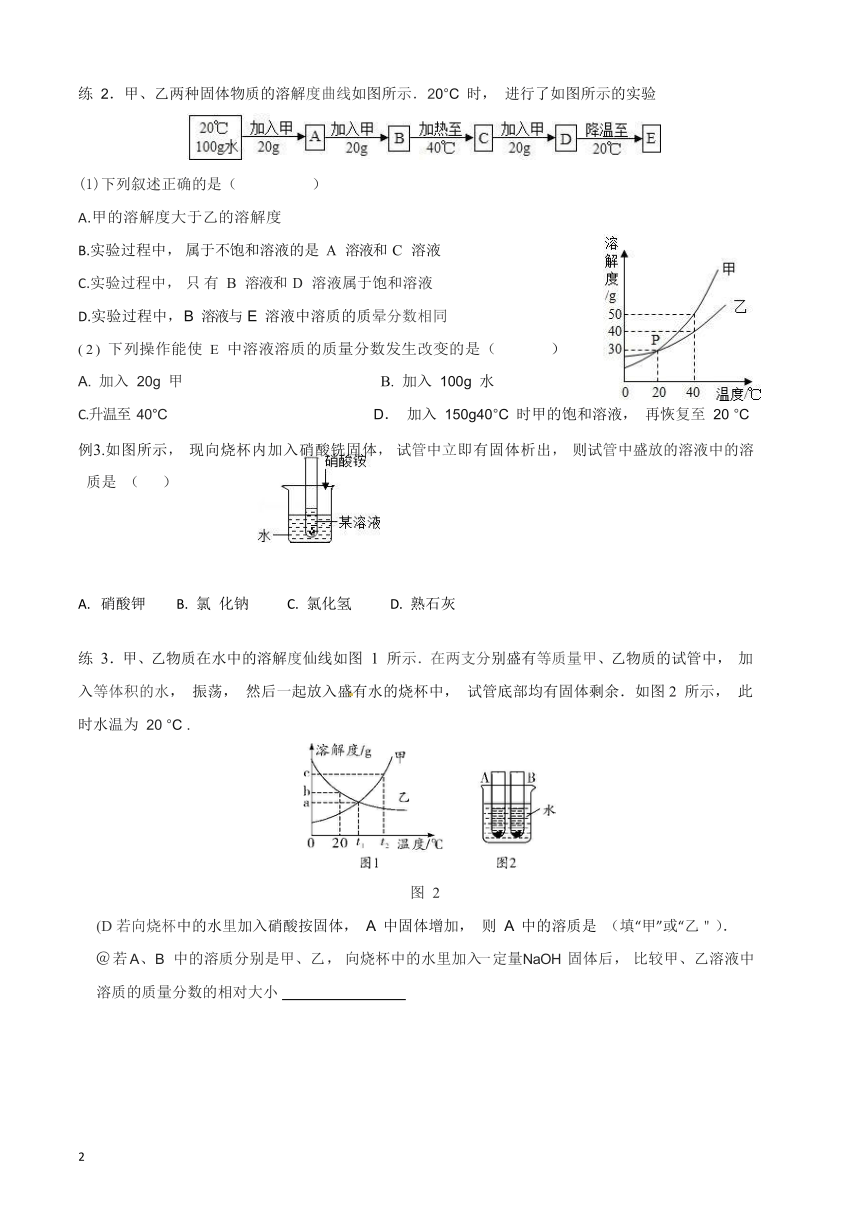
练 2.甲、乙两种固体物质的溶解度曲线如图所示.20°C 时, 进行了如图所示的实验
(1)下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.实验过程中, 属于不饱和溶液的是 A 溶液和 C 溶液
C.实验过程中, 只有B 溶液和 D 溶液属于饱和溶液
D.实验过程中, B 溶液与 E 溶液中溶质的质晕分数相同
( 2 ) 下列操作能使 E 中溶液溶质的质量分数发生改变的是( )
A. 加入 20g 甲 B. 加入 100g 水
C.升温至 40°C D. 加入 150g40°C 时甲的饱和溶液, 再恢复至 20 °C
例 3.如图所示, 现向烧杯内加入硝酸铣固体, 试管中立即有固体析出, 则试管中盛放的溶液中的溶
质是 ( )
硝酸钾 B. 氯 化钠 C. 氯化氢 D. 熟石灰
练 3.甲、乙物质在水中的溶解度仙线如图 1 所示.在两支分别盛有等质量甲、乙物质的试管中, 加入等体积的水, 振荡, 然后一起放入盛有水的烧杯中, 试管底部均有固体剩余.如图2 所示, 此时水温为 20 °C .
图 2
(D若向烧杯中的水里加入硝酸按固体, A 中固体增加, 则 A 中的溶质是 (填“甲”或“乙").
@ 若 A、 B 中的溶质分别是甲、乙, 向烧杯中的水里加入一定量 NaOH 固体后, 比较甲、乙溶液中溶质的质量分数的相对大小
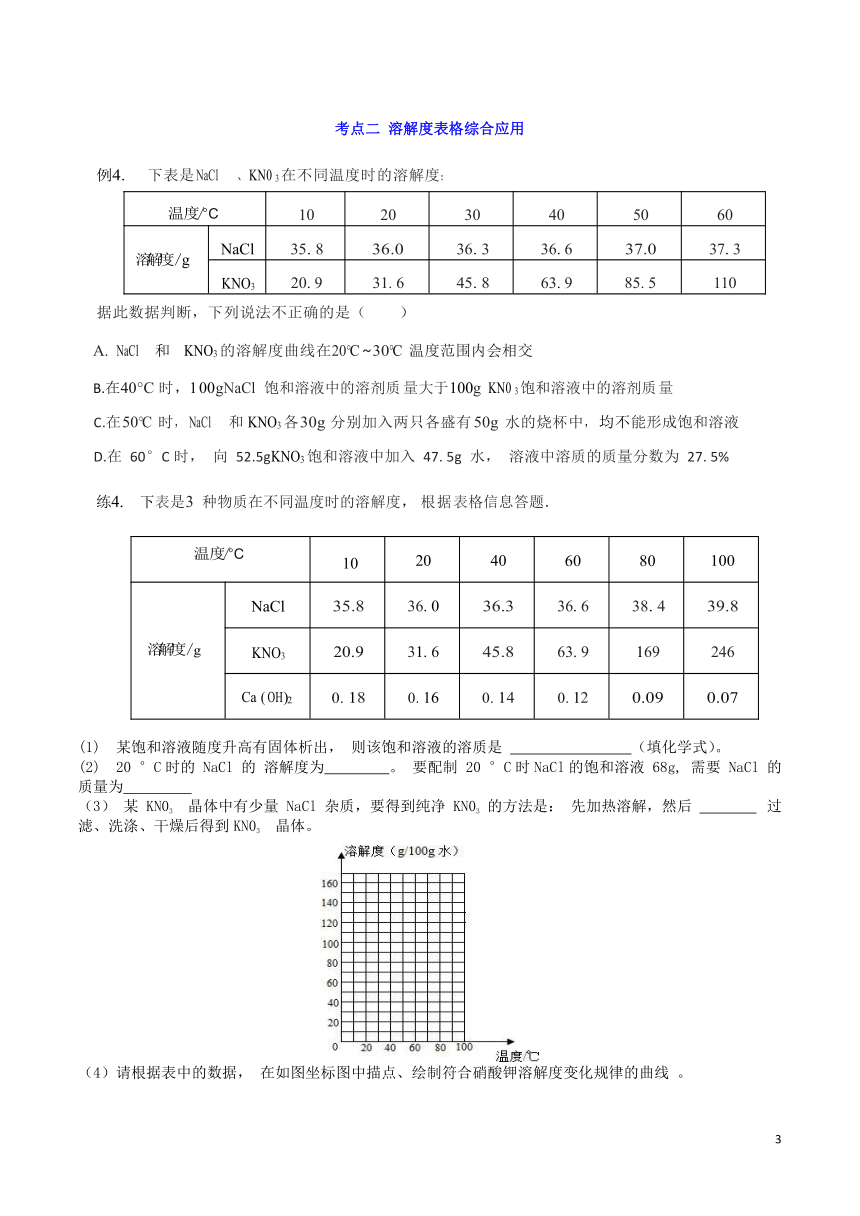
考点二 溶解度表格综合应用
例 4. 下表是 NaCl 、 KN0 3在不同温度时的溶解度:
温 度/°C 10 20 30 40 50 60
溶解度/g NaCl 35. 8 36.0 36. 3 36. 6 37.0 37. 3
KNO3 20. 9 31. 6 45. 8 63. 9 85. 5 110
据此数据判断,下列说法不正确的是( )
NaCl 和KNO3的溶解度曲线在 20°C~30°C温度范围内会相交
B.在 40°C时, 1 00gNaCl 饱和溶液中的溶剂质量大于 100g KN0 3饱和溶液中的溶剂质量
C.在 50°C时, NaCl 和KNO3各 30g 分别加入两只各盛有 50g 水的烧杯中, 均不能形成饱和溶液
D.在 60°C时, 向 52.5gKNO3饱和溶液中加入 47. 5g 水, 溶液中溶质的质量分数为 27. 5%
练 4. 下表是 3 种物质在不同温度时的溶解度, 根据表格信息答题.
温 度/°C 10 20 40 60 80 100
溶解度/g NaCl 35.8 36. 0 36.3 36. 6 38. 4 39.8
KNO3 20.9 31. 6 45.8 63. 9 169 246
Ca ( OH) 2 0. 18 0. 16 0. 14 0. 12 0.09 0.07
(1) 某饱和溶液随度升高有固体析出, 则该饱和溶液的溶质是 (填化学式)。
(2) 20 °C时的 NaCl 的 溶解度为 。 要配制 20 °C时NaCl的饱和溶液 68g, 需要 NaCl 的质量为
(3) 某 KN03 晶体中有少量 NaCl 杂质,要得到纯净 KN03 的方法是: 先加热溶解,然后 过滤、洗涤、干燥后得到KN03 晶体。
(4)请根据表中的数据, 在如图坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线 。
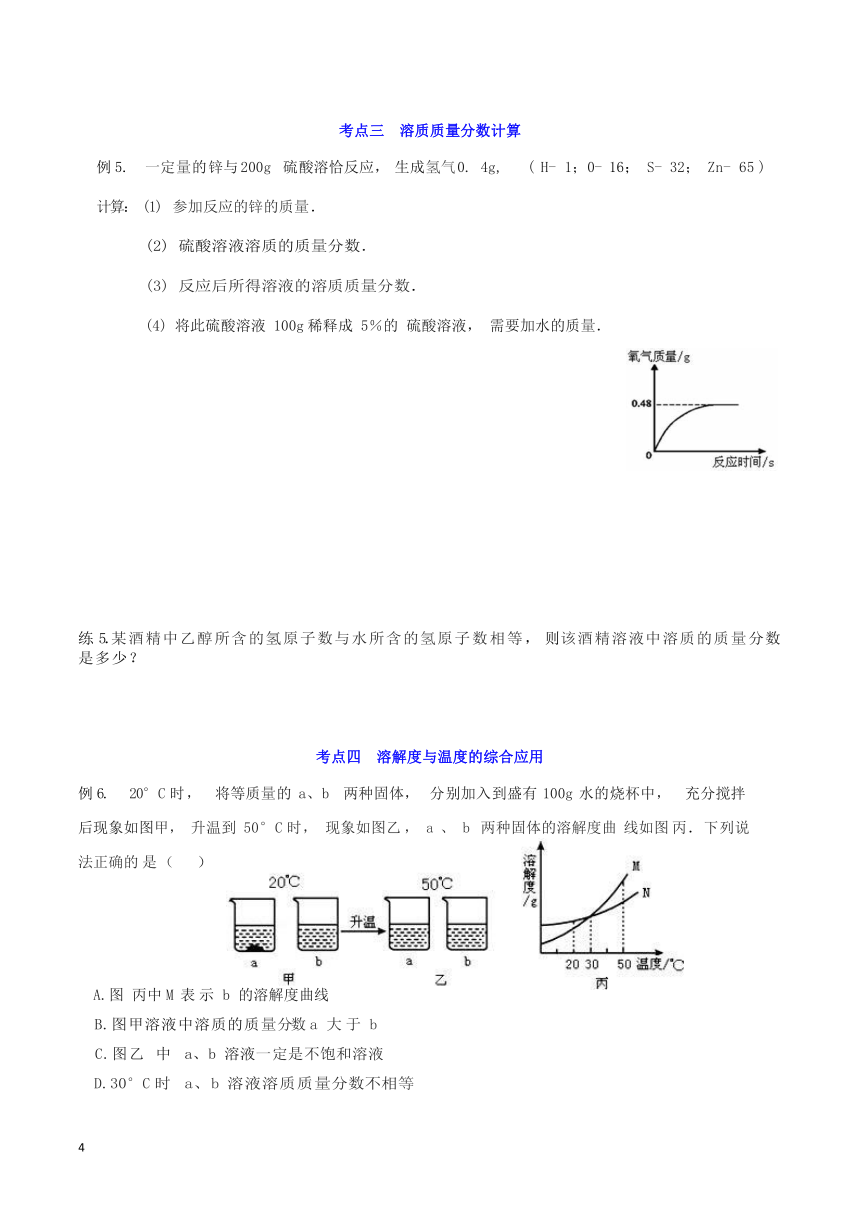
考点三 溶质质量分数计算
例 5. 一定量的锌与 200g 硫酸溶恰反应, 生成氢气 0. 4g, ( H- 1;0- 16; S- 32; Zn- 65 )
计算: (1) 参加反应的锌的质量.
(2) 硫酸溶液溶质的质量分数.
(3) 反应后所得溶液的溶质质量分数.
(4) 将此硫酸溶液 100g稀释成 5%的 硫酸溶液, 需要加水的质量.
练 5.某酒精中乙醇所含的氢原子数与水所含的氢原子数相等, 则该酒精溶液中溶质的质量分数是多少?
考点四 溶解度与温度的综合应用
例6. 20°C时, 将等质量的 a、b 两种固体, 分别加入到盛有 100g 水的烧杯中, 充分搅拌后现象如图甲, 升温到 50°C时, 现象如图乙, a 、 b 两种固体的溶解度曲 线如图丙.下列说法正确的是( )
A.图 丙中M 表示b 的溶解度曲线
B.图甲溶液中溶质的质量分数 a 大于b
C.图乙 中a、b 溶液一定是不饱和溶液
D.30°C时a、b 溶液溶质质量分数不相等
练 6. 右图是 A、 B、 C 三种物质的溶解度曲线.现将等质量的 A、 B、 C 三种物质的饱和溶液,从 t 1°C升温到 t 2°C 下列有关 t 2°C时的溶液说法正确的是( )
A.溶液中C 所含的溶剂最多
B.三种溶液都是饱和溶液
C.溶液中溶质的质量分数最大
D.t 2°C时 A 和C 的溶液中溶质的质量分数相等
【中考模拟】
在配制 80 克 10%的氯化钠溶液过程中,导致溶液中氯化钠质量分数小于 10%的可能原因是( )
①用量筒取水时俯视读数
②配制溶液的烧杯用少量蒸熘水润洗
③在托盘天平的左盘称取氯化钠时, 游码不在零位置就调节天平平衡后将游码移动得到读数
④盛装溶液的试剂瓶用蒸熘水润洗
⑤氯化钠晶体不纯
只有①②③ B.只有①②④⑤ C .只有②③④⑤ D. ①②③④⑤
2.如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述正确的是( )
A.t1 °C时, 等质量的甲、乙溶液 中所含溶质的质量为乙>甲
B.t2°C时, 20g 丙能溶解于 50g 水中形成 70g 溶液
C.若要将N 点的甲溶液转变为M 点的甲溶液, 可恒温蒸发溶剂
D.t3°C 时, 将甲、乙、丙的饱和溶液降温至 t2 °C , 所得溶液溶质质量分数的大小关系为乙>甲=丙
3.甲、乙、丙三种固体物质的溶解度曲线如图所示.下列说法不正确的是( )
A.T2°C 时, 取等质量的甲、乙分别配制成饱和溶液, 所需水的质量: 甲>乙
B.T2°C 时, 将甲、乙的饱和溶液均降温到 T1 °C, 得到的溶液仍饱和
C.若甲中混有少量的丙, 可采用降温结晶的方法提纯甲
D.Tl °C 时, 甲、乙各 30g 分别加入 100g 水中, 均形成饱和溶液
4.取 70g 某温度下的氯化钾饱和溶液, 将其恒温蒸发 10g 水, 析出 4g 氯化钾固体, 则剩余溶液中所含溶质质量为( )
A. 16g B. 20g C. 40g D. 56g
5.如图中图一为四种物质的溶解度曲线, 在图二中分别向两支试管内滴加一定量的水后, X 和 Y 的饱和溶液均变浑浊,则下列说法错误的是( )
10°C时, 物质溶解度大小关系为:①> ③ >②> ④
X 为 Ce2( S04 ) 3, Y 不一定是 NH4H2P04
若 NH4H2P04中混有少量的 NaCl 杂质, 可在较高温度配成饱和溶液, 再降温结晶除去
20 °C时, 将 40g NaCl 加入到 100g 水中, 所得溶液中溶质和溶剂的质量比是 2: 5
6. 如图中的直线表示 t °C时某物质在不同质量的水中溶解达到饱和状态时所溶解的质量.a、b、c 、d
四点分别 表示该物质在 t °C时的溶解情况 ,则下列有关 a、b、c、d 四点对应 溶液的说法,正确的是( )
溶质质量分数大小为: a =b > c=d
溶质质量分数大小为: a =b > d > c
b 点代表的溶液不可能是饱和溶液
d 点代表的溶液在 t °C时已经不能再溶解溶质
7.已知氯化钾、硝酸钾在不同温度时的溶解度如下表:依据上表数据和溶解度曲线判断,下列说法错误的是( )
温度/°C 0 20 40 60
溶解度/g 氯化钾 27.6 34. 0 40. 0 45.5
硝酸钾 13. 3 31. 6 63.9 110. 0
A.能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B. t1°C时, 氯化钾和硝酸钾的溶解度相等, 在 34. 0g 至 35. 0g 之间
C. t 2°C时, 将接近饱和的丙物质的溶液升高温度, 可使其变成饱和溶液
D. 氯化钾中混有少量的硝酸钾, 可采用降温结晶的方法提纯
8.三种固体物质 a、b、c 的溶解度曲线如图所示, 则下列说法不正确的是( )
t1 °C时三种物质的饱和溶液中溶质的质量分数大小为 b > a =c
a、b、c 三种物质的饱和溶液从 t2 °C降温到 t1 °C时都有晶体析出
t2 °C时, 将 50g a 物质加入到 100g 水中完全溶解形成饱和溶液
a 中混有少量b 时可采取降温结晶的方法提纯得到 a
20°C 时, 取甲、乙、丙、丁四种纯净物各 40 g, 分别加入到四个各盛有 100g 水的烧杯中, 充分溶解,其溶解情况如下表:
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20°C 时四种物质溶解度的关系为: 丁>甲>乙>丙
D.四杯溶液中各加入 20 °C的 100 g 水后,溶液质量相等,且均为不饱和溶液
10.“题图”是的溶解度曲线,下列说法正确的是( )
A.溶液从点降温到点,有晶体析出
B.时,、点对应的都是饱和溶液
C.将点的饱和溶液从升温到时仍是饱和溶液
D.时,向水中加入,形成不饱和溶液
11.把t°C时 50 克 20%的 KN0 3 溶液在恒温下蒸发掉 10 克水, 有 1 克 KN0 3 固体析出,则K N0 3 在
t°C时的溶解度为( )
A. 1 0 克 B. 22.5克 C. 25 克 D. 30 克
根据表中内容回答下列问题.
(1 ) 随温度升高, 硝酸钾溶解度的变化趋势是 (填“增大”“减小”或“不变”).
( 2 ) 根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是
( 3 ) 取 KN03 、NaCl 两种固体各 36g 分别放入 20 °C时的 100g 水中充分溶解, 20 °C时有
如图1 所示的实验现象, 烧杯b 中溶解的物质
( 4 ) 如图 2 所示, 若向烧杯中加入足量的硝酸按使之充分溶解, 可观察到的现象是
( 5 ) 如图 2 所示, 若向试管中加入少量的硝酸钾固体, 再向烧杯中加入足量的生石灰, 可观察到的现象是
( 6 ) 根据下表中氯化钠和硝酸钾部分溶解度数据分析 , 回答下列问题.
温度/°C 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35. 8 36.0 36.3 36.6 37.0 37.3
KN03 1 3 . 3 20. 9 31.6 45.8 63.9 85.5 110
①20°C时, 在 100g 水中加入 40g 硝酸钾, 充分搅拌后, 将溶液温度升高到 30°C (不考虑水分蒸发), 所得溶液是 (选填“饱和溶液” 或“不饱和溶液”) ;
②在 20 °C ~30°C的某温度时, 氯化钠和硝酸钾的溶解度( x ) 相同, x 的取值范围是
【思维扩展】
50 °C时, 将质量都为 m 的a、b 两种固体, 分别加入到盛有 100g 水的烧杯中, 充分搅拌后, 现象如图甲; 降温到 20°C时, 现象如图乙.已知 a、b 两种固体分别是氯化钠或硝酸钾 , 它们在不同温度下的溶解度如表.下列有关说法中,正确的是( )
温度/·c 溶解度g 1o 20 30 40 so
氯化钠 35. 8 36. 0 36. 3 36. 6 37. 0
硝酸钾 20. 9 31.6 45. 8 63. 9 85. 5
A.图甲中, a 溶液的溶质质量分数比 b 溶液的大
B.图乙中, a 、 b 溶液一定都是饱和溶液
C.固体是硝酸钾, b 固体是氯化钠
D. 据实验现象可知, 31.6 克2. 小王同学用某固体物质进行了如图所示的 实验(实验中水 的损失忽略不计, 操作M 过程中未发生化学变化且温度没有变化), 请回答下列问题:
(1) 在 10°C~ 40°C时, 该物质的溶解度随温度的升高而 (填“增大”或“减小”).
(2)实验所得的溶液中肯定不饱和的有 (填溶液编号)
(3)实验所得的溶液中溶质质量分数相同的有 和 ; 和 (均填溶液编号).
(4) 溶液 c 到溶液 d 的转化过程中, 最多可能析出晶体(不带结晶水) g.
(5) 操作M 的名称是
3 . 如图是对 20°C一定质量 a 的溶液进行恒温蒸发结晶的实验过程, 请回答:
(1) 蒸发前原溶液是 (填"饱和” 或“不饱和")溶液, x 的数值是
(2) 依据上述实验, 你认为 a 的溶解度随温度变化的趋势是 (填字母).
随温度升高而增大 B. 随温度升高而减小 C. 无法判断
20°C时, a 溶液的溶解度为 克, 共析出 ll ga 后溶液的溶质质量分数为 (精确到0. 1%).
第九单元 溶液(二)
考点一 溶解度曲线综合计算
例 1. 甲乙丙三种物质的溶解度曲线如右图所示, 据此回答下列问题.
(1)p点的的意义是
(2)t1°C 时甲、乙、丙溶解度由大到小的顺序
从甲溶液中获取甲晶体可用 的方法获取晶体;乙溶液中混
有少量的物质甲,用 的方法获取乙晶体。
(4)t2℃C时, 向 30g 甲物质中加入 50g 水,充分溶解后,所得溶液质量为 , 将其升高到 t3°C 时, 所得溶液中溶质和溶液质量比为 。
(5)t4℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序
将 t4℃时甲、乙、丙三种物质的饱和溶液降温至 t1℃,所得溶液的溶质质量为 , 质量分数由大到小的顺序为 。
例 2. I.根据 KN03 和 NaCl 溶解度曲线(如图), 回答下列问题:
(1)l0°C时 KN03的溶解度NaCl 的溶解度(选填 "> ”“ < ”“ =") ;
(2)t°C时, 将 mg KN03 、ng NaCl 分别溶解在 20mL 水中恰好饱和, 则 m n
( 选 填 “> ”、“ < ”、“ =”) ;
(3)20°C时, KN03饱和溶液中溶质的质量分数约为
打开可乐瓶, 溢出大量气体,由此可见, 压强越小, CO2 的溶解度越 。
若要加大二氧化碳溶解的量可采用的一种方法是
II.不同温度下,氧气的溶解度随压强的变化如图 2 所示,图中 tl 对应的温度 40°C ,
则 t2 对应的温度 (填序号).
a.大于 40°C b. 小于 40°C C. 无法确定
练 1. 在 t1°C 时, 将等质量的硝酸钾和氯化钾分别加入到各盛有 100g 水的两个烧杯中, 充分搅拌后现象如图甲所示, 硝酸钾和氯化钾的溶解度曲线如图乙所示.下列说法错误( )
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯②中溶液质量比烧杯①中溶液质量大
D.将温度升高到 t °C , 烧杯②中的固体全部溶解
练 2.甲、乙两种固体物质的溶解度曲线如图所示.20°C 时, 进行了如图所示的实验
(1)下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.实验过程中, 属于不饱和溶液的是 A 溶液和 C 溶液
C.实验过程中, 只有B 溶液和 D 溶液属于饱和溶液
D.实验过程中, B 溶液与 E 溶液中溶质的质晕分数相同
( 2 ) 下列操作能使 E 中溶液溶质的质量分数发生改变的是( )
A. 加入 20g 甲 B. 加入 100g 水
C.升温至 40°C D. 加入 150g40°C 时甲的饱和溶液, 再恢复至 20 °C
例 3.如图所示, 现向烧杯内加入硝酸铣固体, 试管中立即有固体析出, 则试管中盛放的溶液中的溶
质是 ( )
硝酸钾 B. 氯 化钠 C. 氯化氢 D. 熟石灰
练 3.甲、乙物质在水中的溶解度仙线如图 1 所示.在两支分别盛有等质量甲、乙物质的试管中, 加入等体积的水, 振荡, 然后一起放入盛有水的烧杯中, 试管底部均有固体剩余.如图2 所示, 此时水温为 20 °C .
图 2
(D若向烧杯中的水里加入硝酸按固体, A 中固体增加, 则 A 中的溶质是 (填“甲”或“乙").
@ 若 A、 B 中的溶质分别是甲、乙, 向烧杯中的水里加入一定量 NaOH 固体后, 比较甲、乙溶液中溶质的质量分数的相对大小
考点二 溶解度表格综合应用
例 4. 下表是 NaCl 、 KN0 3在不同温度时的溶解度:
温 度/°C 10 20 30 40 50 60
溶解度/g NaCl 35. 8 36.0 36. 3 36. 6 37.0 37. 3
KNO3 20. 9 31. 6 45. 8 63. 9 85. 5 110
据此数据判断,下列说法不正确的是( )
NaCl 和KNO3的溶解度曲线在 20°C~30°C温度范围内会相交
B.在 40°C时, 1 00gNaCl 饱和溶液中的溶剂质量大于 100g KN0 3饱和溶液中的溶剂质量
C.在 50°C时, NaCl 和KNO3各 30g 分别加入两只各盛有 50g 水的烧杯中, 均不能形成饱和溶液
D.在 60°C时, 向 52.5gKNO3饱和溶液中加入 47. 5g 水, 溶液中溶质的质量分数为 27. 5%
练 4. 下表是 3 种物质在不同温度时的溶解度, 根据表格信息答题.
温 度/°C 10 20 40 60 80 100
溶解度/g NaCl 35.8 36. 0 36.3 36. 6 38. 4 39.8
KNO3 20.9 31. 6 45.8 63. 9 169 246
Ca ( OH) 2 0. 18 0. 16 0. 14 0. 12 0.09 0.07
(1) 某饱和溶液随度升高有固体析出, 则该饱和溶液的溶质是 (填化学式)。
(2) 20 °C时的 NaCl 的 溶解度为 。 要配制 20 °C时NaCl的饱和溶液 68g, 需要 NaCl 的质量为
(3) 某 KN03 晶体中有少量 NaCl 杂质,要得到纯净 KN03 的方法是: 先加热溶解,然后 过滤、洗涤、干燥后得到KN03 晶体。
(4)请根据表中的数据, 在如图坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线 。
考点三 溶质质量分数计算
例 5. 一定量的锌与 200g 硫酸溶恰反应, 生成氢气 0. 4g, ( H- 1;0- 16; S- 32; Zn- 65 )
计算: (1) 参加反应的锌的质量.
(2) 硫酸溶液溶质的质量分数.
(3) 反应后所得溶液的溶质质量分数.
(4) 将此硫酸溶液 100g稀释成 5%的 硫酸溶液, 需要加水的质量.
练 5.某酒精中乙醇所含的氢原子数与水所含的氢原子数相等, 则该酒精溶液中溶质的质量分数是多少?
考点四 溶解度与温度的综合应用
例6. 20°C时, 将等质量的 a、b 两种固体, 分别加入到盛有 100g 水的烧杯中, 充分搅拌后现象如图甲, 升温到 50°C时, 现象如图乙, a 、 b 两种固体的溶解度曲 线如图丙.下列说法正确的是( )
A.图 丙中M 表示b 的溶解度曲线
B.图甲溶液中溶质的质量分数 a 大于b
C.图乙 中a、b 溶液一定是不饱和溶液
D.30°C时a、b 溶液溶质质量分数不相等
练 6. 右图是 A、 B、 C 三种物质的溶解度曲线.现将等质量的 A、 B、 C 三种物质的饱和溶液,从 t 1°C升温到 t 2°C 下列有关 t 2°C时的溶液说法正确的是( )
A.溶液中C 所含的溶剂最多
B.三种溶液都是饱和溶液
C.溶液中溶质的质量分数最大
D.t 2°C时 A 和C 的溶液中溶质的质量分数相等
【中考模拟】
在配制 80 克 10%的氯化钠溶液过程中,导致溶液中氯化钠质量分数小于 10%的可能原因是( )
①用量筒取水时俯视读数
②配制溶液的烧杯用少量蒸熘水润洗
③在托盘天平的左盘称取氯化钠时, 游码不在零位置就调节天平平衡后将游码移动得到读数
④盛装溶液的试剂瓶用蒸熘水润洗
⑤氯化钠晶体不纯
只有①②③ B.只有①②④⑤ C .只有②③④⑤ D. ①②③④⑤
2.如图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述正确的是( )
A.t1 °C时, 等质量的甲、乙溶液 中所含溶质的质量为乙>甲
B.t2°C时, 20g 丙能溶解于 50g 水中形成 70g 溶液
C.若要将N 点的甲溶液转变为M 点的甲溶液, 可恒温蒸发溶剂
D.t3°C 时, 将甲、乙、丙的饱和溶液降温至 t2 °C , 所得溶液溶质质量分数的大小关系为乙>甲=丙
3.甲、乙、丙三种固体物质的溶解度曲线如图所示.下列说法不正确的是( )
A.T2°C 时, 取等质量的甲、乙分别配制成饱和溶液, 所需水的质量: 甲>乙
B.T2°C 时, 将甲、乙的饱和溶液均降温到 T1 °C, 得到的溶液仍饱和
C.若甲中混有少量的丙, 可采用降温结晶的方法提纯甲
D.Tl °C 时, 甲、乙各 30g 分别加入 100g 水中, 均形成饱和溶液
4.取 70g 某温度下的氯化钾饱和溶液, 将其恒温蒸发 10g 水, 析出 4g 氯化钾固体, 则剩余溶液中所含溶质质量为( )
A. 16g B. 20g C. 40g D. 56g
5.如图中图一为四种物质的溶解度曲线, 在图二中分别向两支试管内滴加一定量的水后, X 和 Y 的饱和溶液均变浑浊,则下列说法错误的是( )
10°C时, 物质溶解度大小关系为:①> ③ >②> ④
X 为 Ce2( S04 ) 3, Y 不一定是 NH4H2P04
若 NH4H2P04中混有少量的 NaCl 杂质, 可在较高温度配成饱和溶液, 再降温结晶除去
20 °C时, 将 40g NaCl 加入到 100g 水中, 所得溶液中溶质和溶剂的质量比是 2: 5
6. 如图中的直线表示 t °C时某物质在不同质量的水中溶解达到饱和状态时所溶解的质量.a、b、c 、d
四点分别 表示该物质在 t °C时的溶解情况 ,则下列有关 a、b、c、d 四点对应 溶液的说法,正确的是( )
溶质质量分数大小为: a =b > c=d
溶质质量分数大小为: a =b > d > c
b 点代表的溶液不可能是饱和溶液
d 点代表的溶液在 t °C时已经不能再溶解溶质
7.已知氯化钾、硝酸钾在不同温度时的溶解度如下表:依据上表数据和溶解度曲线判断,下列说法错误的是( )
温度/°C 0 20 40 60
溶解度/g 氯化钾 27.6 34. 0 40. 0 45.5
硝酸钾 13. 3 31. 6 63.9 110. 0
A.能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B. t1°C时, 氯化钾和硝酸钾的溶解度相等, 在 34. 0g 至 35. 0g 之间
C. t 2°C时, 将接近饱和的丙物质的溶液升高温度, 可使其变成饱和溶液
D. 氯化钾中混有少量的硝酸钾, 可采用降温结晶的方法提纯
8.三种固体物质 a、b、c 的溶解度曲线如图所示, 则下列说法不正确的是( )
t1 °C时三种物质的饱和溶液中溶质的质量分数大小为 b > a =c
a、b、c 三种物质的饱和溶液从 t2 °C降温到 t1 °C时都有晶体析出
t2 °C时, 将 50g a 物质加入到 100g 水中完全溶解形成饱和溶液
a 中混有少量b 时可采取降温结晶的方法提纯得到 a
20°C 时, 取甲、乙、丙、丁四种纯净物各 40 g, 分别加入到四个各盛有 100g 水的烧杯中, 充分溶解,其溶解情况如下表:
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20°C 时四种物质溶解度的关系为: 丁>甲>乙>丙
D.四杯溶液中各加入 20 °C的 100 g 水后,溶液质量相等,且均为不饱和溶液
10.“题图”是的溶解度曲线,下列说法正确的是( )
A.溶液从点降温到点,有晶体析出
B.时,、点对应的都是饱和溶液
C.将点的饱和溶液从升温到时仍是饱和溶液
D.时,向水中加入,形成不饱和溶液
11.把t°C时 50 克 20%的 KN0 3 溶液在恒温下蒸发掉 10 克水, 有 1 克 KN0 3 固体析出,则K N0 3 在
t°C时的溶解度为( )
A. 1 0 克 B. 22.5克 C. 25 克 D. 30 克
根据表中内容回答下列问题.
(1 ) 随温度升高, 硝酸钾溶解度的变化趋势是 (填“增大”“减小”或“不变”).
( 2 ) 根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是
( 3 ) 取 KN03 、NaCl 两种固体各 36g 分别放入 20 °C时的 100g 水中充分溶解, 20 °C时有
如图1 所示的实验现象, 烧杯b 中溶解的物质
( 4 ) 如图 2 所示, 若向烧杯中加入足量的硝酸按使之充分溶解, 可观察到的现象是
( 5 ) 如图 2 所示, 若向试管中加入少量的硝酸钾固体, 再向烧杯中加入足量的生石灰, 可观察到的现象是
( 6 ) 根据下表中氯化钠和硝酸钾部分溶解度数据分析 , 回答下列问题.
温度/°C 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35. 8 36.0 36.3 36.6 37.0 37.3
KN03 1 3 . 3 20. 9 31.6 45.8 63.9 85.5 110
①20°C时, 在 100g 水中加入 40g 硝酸钾, 充分搅拌后, 将溶液温度升高到 30°C (不考虑水分蒸发), 所得溶液是 (选填“饱和溶液” 或“不饱和溶液”) ;
②在 20 °C ~30°C的某温度时, 氯化钠和硝酸钾的溶解度( x ) 相同, x 的取值范围是
【思维扩展】
50 °C时, 将质量都为 m 的a、b 两种固体, 分别加入到盛有 100g 水的烧杯中, 充分搅拌后, 现象如图甲; 降温到 20°C时, 现象如图乙.已知 a、b 两种固体分别是氯化钠或硝酸钾 , 它们在不同温度下的溶解度如表.下列有关说法中,正确的是( )
温度/·c 溶解度g 1o 20 30 40 so
氯化钠 35. 8 36. 0 36. 3 36. 6 37. 0
硝酸钾 20. 9 31.6 45. 8 63. 9 85. 5
A.图甲中, a 溶液的溶质质量分数比 b 溶液的大
B.图乙中, a 、 b 溶液一定都是饱和溶液
C.固体是硝酸钾, b 固体是氯化钠
D. 据实验现象可知, 31.6 克
(1) 在 10°C~ 40°C时, 该物质的溶解度随温度的升高而 (填“增大”或“减小”).
(2)实验所得的溶液中肯定不饱和的有 (填溶液编号)
(3)实验所得的溶液中溶质质量分数相同的有 和 ; 和 (均填溶液编号).
(4) 溶液 c 到溶液 d 的转化过程中, 最多可能析出晶体(不带结晶水) g.
(5) 操作M 的名称是
3 . 如图是对 20°C一定质量 a 的溶液进行恒温蒸发结晶的实验过程, 请回答:
(1) 蒸发前原溶液是 (填"饱和” 或“不饱和")溶液, x 的数值是
(2) 依据上述实验, 你认为 a 的溶解度随温度变化的趋势是 (填字母).
随温度升高而增大 B. 随温度升高而减小 C. 无法判断
20°C时, a 溶液的溶解度为 克, 共析出 ll ga 后溶液的溶质质量分数为 (精确到0. 1%).
同课章节目录
