浙江省2022年中考科学二轮复习专题:15化学解答题(含答案)
文档属性
| 名称 | 浙江省2022年中考科学二轮复习专题:15化学解答题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 509.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-04-06 17:12:43 | ||
图片预览



文档简介
初中科学2022年中考二轮复习专题:15化学解答题
一、解答题
1.乙炔俗称电石气,是因为电石(CaC2)遇水可产生乙炔(C2H2)气体,反应的化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑某桶电石标签的部分内容如图所示.计算:
(1)在C2H2分子中,C原子H原子的个数比为 .
(2)在CaC2中Ca元素C元素的质量比为 .
(3)在CaC2中,C元素的质量分数为 %.
(4)在该桶电石中,纯CaC2的质量为 kg.
2.很多人都喜欢一道美食——香椿煎鸡蛋。中国是唯一把香椿当作蔬菜的国家,它不仅营养丰富,而且具有极高的药用价值,如香椿中含有的皂甙,具有抗菌、防癌的作用,皂甙的化学式为C27H42O3,请回答:
(1)皂甙属于 (选填“单质”或“化合物”)。
(2)皂甙的相对分子质量是 。
(3)41.4g皂甙中碳元素的质量为 g。
3.人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1004。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g。那么一盒牛奶含钙至少 g(保留到0.01g)。
(2)求羟基磷酸钙中钙元素的质量分数(保留为0.1%)。
(3)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝多少盒牛奶?
4.2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的四类。
(1)以下四种物品中属于垃圾分类中可回收物的是
A.破碗瓷片 B.过期药物 C.废旧报纸 D.枯枝落叶
(2)易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式 。
(3)沼气发电时,能量转化形式是 转化为电能。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属 (选填“元素"或“单质”)。
(5)“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是 。
5.钙元素具有壮骨、健牙、消炎、镇痛的功效。缺钙易导致少年儿童厌食、偏食;不易入睡、易惊醒、易感冒;头发稀疏;智力发育迟缓;学步晚、出牙晚或出牙不整齐;缺钙导致老年人脚后跟疼,腰椎颈椎疼痛,牙齿松动、脱落等。
(1)钙片的化学式中 x 的值为 ;
(2)钙片中钙和碳的原子个数比为 ;
(3)若一个成年人每天需摄入 900mg 的钙元素,则其一日需服几次。(请通过计算说明)
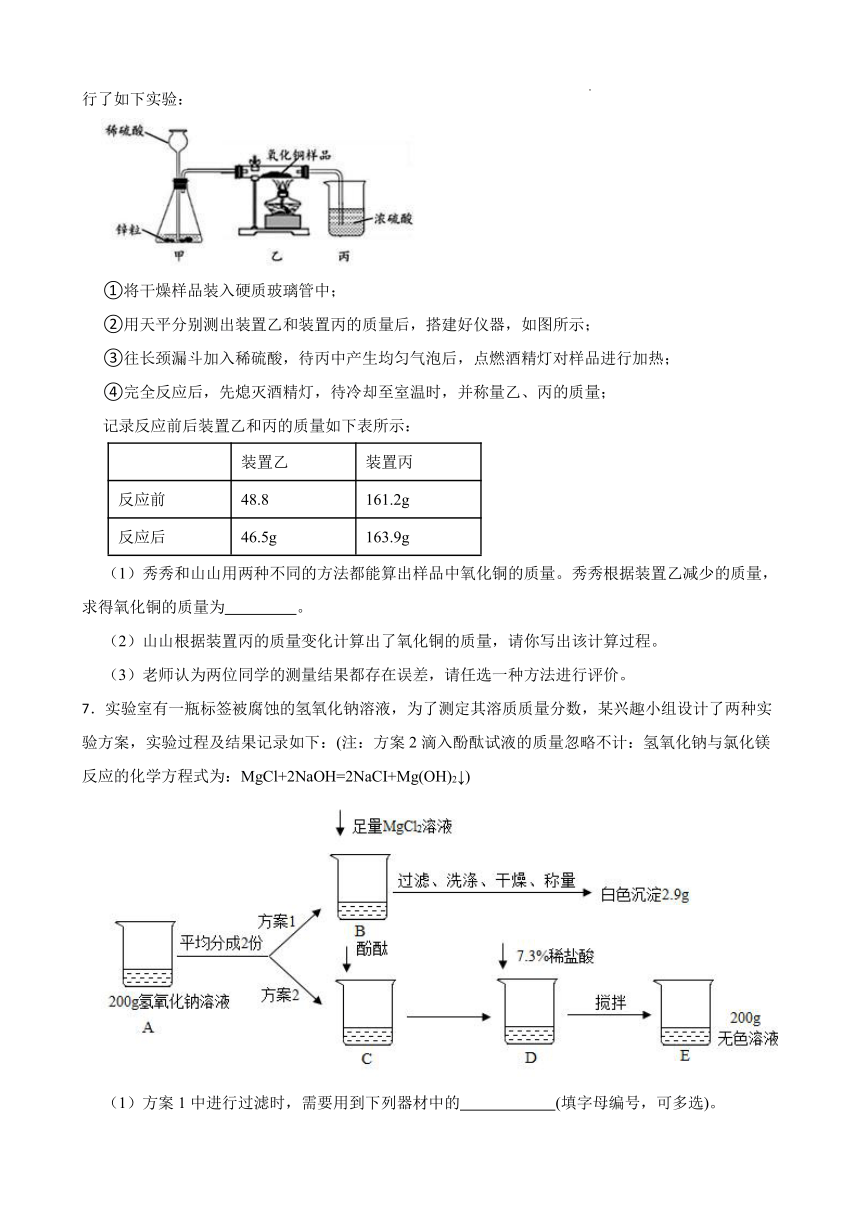
6.秀秀和山山利用氢气还原氧化铜的方法测出某样品中氧化铜的质量(样品中杂质不与氢气反应),进行了如下实验:
①将干燥样品装入硬质玻璃管中;
②用天平分别测出装置乙和装置丙的质量后,搭建好仪器,如图所示;
③往长颈漏斗加入稀硫酸,待丙中产生均匀气泡后,点燃酒精灯对样品进行加热;
④完全反应后,先熄灭酒精灯,待冷却至室温时,并称量乙、丙的质量;
记录反应前后装置乙和丙的质量如下表所示:
装置乙 装置丙
反应前 48.8 161.2g
反应后 46.5g 163.9g
(1)秀秀和山山用两种不同的方法都能算出样品中氧化铜的质量。秀秀根据装置乙减少的质量,求得氧化铜的质量为 。
(2)山山根据装置丙的质量变化计算出了氧化铜的质量,请你写出该计算过程。
(3)老师认为两位同学的测量结果都存在误差,请任选一种方法进行评价。
7.实验室有一瓶标签被腐蚀的氢氧化钠溶液,为了测定其溶质质量分数,某兴趣小组设计了两种实验方案,实验过程及结果记录如下:(注:方案2滴入酚酞试液的质量忽略不计:氢氧化钠与氯化镁反应的化学方程式为:MgCl+2NaOH=2NaCI+Mg(OH)2↓)
(1)方案1中进行过滤时,需要用到下列器材中的 (填字母编号,可多选)。
(2)根据方案1中的数据,计算该氢氧化钠溶液中溶质的质量分数。
(3)根据方案2中的数据,算得氢氧化钠溶液的溶质质量分数,发现与事实严重不符,小明分析造成这种情况的原因可能是加入的稀盐酸过量,为证明稀盐酸确实过量需要进行的实验是 (写出实验操作与相应现象)。
8.海洋水是地球上最庞大的水体,在水循环中海洋水和陆地水有着密切的联系。
(1)某兴趣小组通过图甲装置,开展了自然界的水循环模拟实验。装置烧瓶中的水主要代表 (填序号)
①地下水 ②海洋水 ③冰川
(2)海上航行缺乏饮用水时可用蒸馏法获得淡水。用图乙装置将25kg含氯化钠0.3%的海水暴晒4小时后,剩余海水中氧化钠的质量分数为0.4%,则收集到的淡水有多少千克 (不考虑收集过程中的水分散失)
9.近几年,诺如病毒日趋严重,并出现了许多变种,尤其是教室内空气流通不畅,学生比较容易感染。最有效的预防方法之一就是用消毒液对教室空气消毒。学校采用的二氧化氯消毒液是国际上公认的新一代强力、广谱、安全、高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂。二氧化氯消毒液能够迅速,彻底杀灭各种细菌(大肠杆菌,白色念珠菌等)和病毒(肝炎病毒,流感病毒等)。
小科同学观察到瓶上的标签如下表所示。
二氧化氯(ClO2)1000 毫升
溶质质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这 1000 毫升二氧化氯消毒液中含溶质二氧化氯多少克;
(2)若将这 1000 毫升二氧化氯消毒液与 5000 克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少;(保留小数点后一位)
(3)我校欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这样的二氧化氯消毒液和多少升水?
10.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用如图方法可进行粗盐提纯,其中操作②的名称为 。
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电的条件下分解,获得镁和氯气(Cl2)。此反应前后,各原子的质量是 (选填“发生变化”或“保持不变”)。
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。现有10kg溶质质量分数为25%的食盐水,若要将其稀释到20%,需加水多少千克?
11.将200g石灰石与足量的盐酸反应,共收集二氧化碳66g.求:该石灰石中CaCO3的质量分数多少?
12.为积极营造安全有序的交通环境。近年来我市严格执行许多安全措施,这些安全措施中都蕴含着许多科学知识。试分析回答:
(1)有关部门规定;不允许电动自行车安装图甲所示的遮阳棚,因为骑行时会出现遮阳棚往上掀翻的情况。请你解释现象
(2)图乙是酒精测试仪工作原理电路图,电源电压为 6V; R1为气敏电阻。它的阻值随气体中酒精含量变化的情況如图丙所示。使用前通过调节滑动变阻器R2对测试仪进行调零,此时电压表示数为5V。调零后 R2的滑片位置保持不变。
①当气体中酒精含量为0时,电压表示数为 5V。则此时电流表的示数为多少安?②对某位驾驶员进行检测时,电流表示数为 0.2A,请通过计算,判斯此时该驾驶员属于洒驾还是醉驾?(气体中酒精含量大于 0 且小于 80mg/100ml.为酒驾,达到或者超过80mg/100mL为醉驾.)
13.某兴趣小组设计如下实验探究质量守恒定律。
甲 乙 丙
(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取下烧杯把铁钉放入试管中,一段时间后,再把烧杯放回天平左盘,最后天平是否平衡? 。反应后试管内溶液的质量 (填“增加”“减少”或“不变”)。
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平左盘,发现天平不再平衡,其原因是 。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,装置气密性良好)。你认为能否验证质量守恒定律并阐述理由: 。
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应,结果精确到0.1%)。
14.小科发现暖水瓶中有一层淡黄色的水垢。据悉,该地区的水垢中除碳酸钙外,无其它盐类。他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取 2.5g 水垢按图甲中的 A 装置高温加热充分反应(已知 CaCO3 CaO+CO2↑),产 生的气体依次通过 B、C 装置,实验后发现 C 装置中氢氧化钠溶液增加了 0.88g。
①写出 C 装置中发生化学反应方程式 。
②B 装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 。
15.20℃时氯化钠的溶解度为36克。该温度下,某氯化钠溶液的组成模型如图所示,请回答:
(1)该溶液的溶质是 。
(2)保持温度不变蒸发l0克水后,氯化钠溶液中溶质的质量分数 (填“变大”“变小”或“不变”)。
16.2020年10月22日,美国食品与药品管理局(FDA)为美国吉利德科学公司的瑞德西韦(分子式:C27H35N6O8P)开绿灯,批准该药物用于治疗住院的新冠肺炎患者。瑞德西韦也成为美国首个获准用于治疗新冠患者的药物。
(1)瑞德西韦属于 (选填“有机物”或“无机物”)。
(2)瑞德西韦分子中碳、氢、氧三种原子的个数比为 。
(3)30.1 g 瑞德西韦中含氮元素 g。
17.实验室用 38%的浓盐酸 配制 10%的盐酸溶液 500 毫升,需要加水多少毫升?溶液中溶质质量为多少?(已知 10%盐酸密度为 1.05g/cm3,38%盐酸密度是 1.2g/cm 3 )(保留一位小数)
18.国王给金匠一块纯金属,要求金匠用这块金属为他制一顶王冠。虽然做好的王冠的质量与原来的金属块一样,都是2400克,但国王怀疑王冠中掺入了其他金属。国王让科学家调查王冠的制作材料。
(1)科学家找来一块跟原来完全相同的金属块,测出这块金属的长、宽、高都是5厘米,则这块金属的密度是多大?金属块最可能是哪种金属?
金属 铂 金 银 铜
密度(克/厘米3) 21.4 19.3 10.5 8.9
(2)为了测王冠的密度,科学家先测出王冠的体积,根据测量结果计算出了王冠的密度。下表是科学家五次测量王冠的体积和计算出的密度:
测试次数 202 2 3 4 5
王冠的体积(厘米3) 202 200 201 198 199
王冠的密度(克/厘米3) 11.88 12.00 11. 94 12.12 12.06
①科学家为什么要五次测量王冠的体积?
②科学家向国王报告王冠的密度是12.0克/厘米3。请说明科学家是怎样利用他们的测量结果获得这一密度值的。
③科学家会向国王报告王冠可能是用哪种金属或金属的混合物制成的?
19.有一瓶未贴标签的粉末状常见金属R,为了测定R的相对原子质量,准确称取一定量的金属粉末,在坩埚内加强热使其完全反应,冷却后再称重,重复实验、,获得如表数据。请回答下列问题(已知金属与氧元素结合形成的化合物称为金属氧化物)。
实验次数 金属质量(g) 金属氧化物质量(g)
1 45.0 84.9
2 45.0 85.1
3 45.0 85.0
平均值 45.0 m
(1)表格中m= 。
(2)求该金属氧化物中,R元素和氧元素的质量比。
(3)已知R元素的化合价为+3,求R的相对原子质量。
20.乙醇(C2H5OH)俗称酒精,是一种能替代汽油等燃料的清洁能源,但在氧气不足时燃烧除生成二氧化碳和水外,还会生成一氧化碳.现有69 g乙醇与一定量的氧气点燃后发生如下反应:xC2H5OH + 8O2yCO2 + zCO + 9H2O.
(1)判断系数x的值是 .
(2)计算反应后生成一氧化碳的质量.
21.“84消毒液”广泛应用于物体表面的消毒,其有效成分是次氯酸钠。
(1)配制50g溶质质量分数为12%的次氯酸钠溶液中,需要固体次氯酸钠多少克?
(2)可将上述溶液稀释成溶质质量分数为0.2%的次氯酸钠溶液多少克?
22. 由如图所示实验中观察到的数据,计算相应的物理量.(g=9.8N/kg,ρ水=1.0×103kg/m3)
(1)物体受到的浮力为 N.
(2)物体排开水的体积是 m3.
(3)物体排开的水重为 N.
23.小明做了下面两个实验,请解释其中的科学道理:
(1)准备了一杯60℃的恰好饱和的硝酸钾溶液,悬浮着一只新鲜鸡蛋。如图,放在室温下,一段时间后,发现鸡蛋下沉,请用学过的知识解释这一现象。
(2)他在一个空矿泉水瓶里面套一个气球,在矿泉水瓶外用绳子扎紧气球的口,然后小明对着气球吹气,可是,小明用了很大的力气也只能吹大一点点,可是矿泉水瓶里还有很大的空间,小明觉得很纳闷,请你来帮忙解释这个现象。
24.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是 克;
(2)参加反应的氯酸钾的质量是多少克
(3)氯化钾溶液的质量是多少克
25.中国是把香椿当做蔬菜的唯一国家。它不仅营养丰富,而且具有极高的药用价值,如香椿中含有的皂甙(dài),具有抗菌、防癌的作用,皂甙的化学式为C27H42O3,请你计算:
(1)皂甙由 种元素组成。
(2)皂甙中碳、氢、氧元素的原子个数之比是 。
(3)皂甙的相对分子质量(写出计算过程)。
26.疫情期间,某小区居民用酒精(C2H5OH)消毒发生火灾,后被消防队员扑灭。
(1)酒精中含有 种元素,碳元素、氢元素、氧元素的质量比是 ;
(2)230克酒精中碳元素的质量为 。
27.若冶炼200吨含杂质的质量分数为2%的生铁,需要含氧化铁的质量分数为80%的赤铁矿石多少吨?
28.右下图是某药厂生产的葡萄糖注射液的标签。其溶质葡萄糖的化学式为C6H12O6。试计算(写出计算过程):
(1)葡萄糖的相对分子质量是多少?
(2)葡萄糖中C、H、O三种元素的质量比为多少?
(3)200g该葡萄糖注射液含多少g葡萄糖?
(4)90g葡萄糖中所含碳元素的质量与多少g麦芽糖(C12H22O11)中所含碳元素的质量相等。
29.表中是四种常见的食品添加剂:
名称 亚硝酸钠 阿斯巴甜 β一胡萝卜素 环七糊精
化学式 NaNO2 C14H18O5N2 C40H56 (C6H10O5)7
类别 防腐剂护色剂 甜味剂 着色剂营养强化剂 增稠剂
最大使用量(每1kg食物中) 腊肉中0.15g 膨化食品中0.5g 淡奶油中0.02g 胶基糖果中20.0g
根据信息,请回答下列问题:
(1)NaNO2中氮元素的化合价为 。
(2)阿斯巴甜中含有 种元素。
(3)β一胡萝卜素分子中碳原子和氢原子的个数比是 。(最简整数比)
(4)测得1kg某胶基糖果中含环七糊精11.0g, (填“符合”或“不符合”)其使用标准。
(5)“我国应该禁止使用所有的食品添加剂”,这种说法是否正确并说明理由: 。(写出一条即可)
30.某科学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
(1)配制100g质量分数为8%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g.
(2)如图表示用上述配制的氢氧化钠溶液与20g某稀盐酸发生反应后溶液pH值的变化情况.当加入25g氢氧化钠溶液时,所得溶液中的溶质为 、 (写化学式).
(3)试计算该稀盐酸中溶质的质量分数(请写出计算过程)
31.人体注射葡萄糖溶液可以补充能量,葡萄糖(C6H12O6)在体内经缓慢氧化生成二氧化碳和水,释放出能量。若1 000克5%葡萄糖注射液中的葡萄糖完全氧化,计算:
(1)理论上至少消耗O2多少克?
(2)多少升空气中含有这些质量的氧气?(氧气密度为1.43克/升)
32.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH。反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。(忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。)
(1)m点的数值是 。
(2)a→b段表示碳酸钠与混合溶液中的 反应。
(3)参加反应的碳酸钠溶液的溶质的质量分数是?
(4)请计算原混合溶液中CaCl2的质量分数为?(写计算过程)。
33. 人体所需的维生素C(化学式为C6H8O6)主要从蔬菜、水果中摄取.请计算:
(1)维生素C中碳元素、氢元素、氧元素的质量的最简整数比为 .
(2)若要配制溶质质量分数为0.3%的维生素C溶液1000g,需要维生素C的质量为 g,水的质量为 g.
答案解析部分
1.(1)1:1
(2)5:3
(3)37.5
(4)40
分析:(1)根据1个乙炔分子的构成进行分析解答.(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数= ×100%,进行分析解答.(4)根据题意,一桶电石的质量为50kg,CaC2的质量分数为80%,据此进行分析解答.
解答:解:(1)1个乙炔分子是由2个碳原子和2个氢原子构成的,则在C2H2分子中,C原子H原子的个数比为1:1.(2)在CaC2中Ca元素C元素的质量比为40:(12×2)=5:3.(3)在CaC2中,C元素的质量分数为 100%=37.5%.(4)一桶电石的质量为50kg,CaC2的质量分数为80%,在该桶电石中纯CaC2的质量为50kg×80%=40kg.
故答案为:(1)1:1;(2)5:3;(3)37.5;(4)40.
2.(1)化合物
(2)414
(3)32.4
分析:(1)只由一种元素组成的纯净物叫单质;由多种元素组成的纯净物叫化合物。
(2)相对分子质量等于相对原子质量和个数的乘积之和。
(3)碳元素的质量=皂甙的质量×碳元素的质量分数。
解答:(1)根据化学式 C27H42O3 可知,皂甙由C、H、O三种元素组成,为化合物。
(2)皂甙的相对分子质量是:12×27+1×42+16×3=414;
(3)41.4g皂甙中碳元素的质量为:。
3.(1)0.28
(2)羟基磷酸钙中钙元素的质量分数=,即39.8%。
(3)人体每天至少需要来自牛奶的钙=0.6g×90%÷0.28g≈2盒
答:一个人每天至少要喝2盒牛奶。
分析:(1)通过分析题目信息“包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g”,结合一盒牛奶含量求解。
(2)化合物中元素的质量分数等于该元素相对原子质量的总和除以相对分子质量。
(1)先求出人体每天需要的来自牛奶的钙的质量,在结合每盒牛奶的含钙量求出盒数。
解答:(1)因为“包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g”,那么“包装标签上钙≥0.11g,是指100mL牛奶中含钙的质量至少0.11g”,所以一盒牛奶至少含钙为=250ml×0.11g/100ml=0,28g。
(2)化合物中元素的质量分数等于该元素相对原子质量的总和除以相对分子质量,所以羟基磷酸钙中钙元素的质量分数=。
(3)先求出人体每天需要的来自牛奶的钙的质量=0.6g×90%=0.54g,牛奶的盒数=0.54g÷0.28g≈2盒。
故答案为:(1)0.28;(2)39.8%;(3)2盒
4.(1)C
(2)CH4+2O2=CO2+2H2O
(3)化学能
(4)元素
(5)熔化和凝固
分析:(1)根据可回收物的定义判断;
(2)确定反应物、反应条件和生成物,据此写出反应的方程式;
(3)根据能量转化的知识判断;
(4)元素是具有相同核电荷数的同一类原子的统称;
(5)确定初始态和终末态,从而确定物态变化的名称。
解答:(1)可回收物指适宜回收利用和资源化利用的生活废弃物,包括废纸、废塑料、废金属、废包装物、废旧纺织物、废弃电器电子产品、废玻璃、废纸塑铝复合包装等,故C符合题意,而A、B、D不合题意。
故选C。
(2)甲烷与氧气在点燃的条件下反应,生成二氧化碳和水,反应的方程式为: CH4+2O2=CO2+2H2O 。
(3)沼气发电时,能量转化形式是化学能转化为电能。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属元素。
(5)易拉罐原来为固态,后来变成液态,这个过程叫熔化;液态的铝变成固态的铝块,这个过程叫凝固。
5.(1)11
(2)1:12
(3)Ca%=40/430=9.3%mCa=3.3×9.3%=0.3g=300mg每天需要=900/300=3粒服三次每次1粒
分析:考查有关化学式的简单计算。
解答:(1)已知相对分子质量为430=40+2×(12×6+X+16×7),解方程得X=11.
(2)化学式为 :右下角的数值就是其中各原子的个数,Ca:C=1:12;
(3)题目中已知每片钙总的3.3g,其中钙元素质量分数为 Ca%=40/430=9.3%
每一片钙含量为: mCa=3.3×9.3%=0.3g=300mg ,每天需要900mg,则需要每天服三片。
答案为:(1)11 (2)1:12
6.(1)11.5g
(2)解:m水=163.9g-161.2g =2.7g
CuO+H2 Cu+ H2O
80 18
X 2.7g
X=12g
(3)解:①山山的方案因为装置丙中浓硫酸敞口放置,会吸收空气中的水分,使质量偏重;
②秀秀的方案因为在装置甲的反应过程中,会有水蒸气逸出到硬质玻璃管中,使装置乙的质量偏大;装置乙中的CuO没有平铺,无法被氢气完全还原成Cu
分析:(1)根据乙乙减少质量为参加反应的氧化铜中氧元素质量结合化学式中元素质量计算方法分析;
(2)根据生成水的质量代入方程式中,利用方程式计算氧化铜质量分析;
(3)根据两实验方案中空气中水蒸气及氢气中的水蒸气对实验的影响分析。
解答:(1)乙减少质量为参加反应的氧化铜中氧元素质量,为48.8-46.5=2.3g,则氧化铜质量为;
(2)丙质量变化为反应后生成水的质量,由水的质量利用方程式计算氧化铜质量;
故答案为:(1)11.5g;(2)12g;(3)①山山的方案因为装置丙中浓硫酸敞口放置,会吸收空气中的水分,使质量偏重;②秀秀的方案因为在装置甲的反应过程中,会有水蒸气逸出到硬质玻璃管中,使装置乙的质量偏大;装置乙中的CuO没有平铺,无法被氢气完全还原成Cu。
7.(1)B、D、E
(2)解:设100g氢氧化钠溶液中含溶质的质量为x。
MgCl2+ 2NaOH=2NaCl+ Mg(OH)2↓
80 58
x 2.9g
解得:x=4g
NaOH溶液的溶质质量分数: ×100%=4%
(3)滴加紫色石蕊试液,溶液呈红色;加入适量的碳酸钙粉末,产生大量气泡;加入适量的金属锌,锌的表面产生气泡
分析:(1)结合实验方案图,实验过程对照实验器材解答。
(2)根据氯化镁和氢氧化钠反应的化学方程式计算。
(3)紫色石蕊溶液遇到酸变为红色;碳酸钙和稀盐酸反应产生气泡;锌和稀盐酸反应产生气泡。
解答:(1)、过滤需要用到玻璃仪器为烧杯、漏斗、玻璃棒;
(2)、根据化学方程,已知白色测定质量,可以求得氢氧化钠的质量;
(3)、检验盐酸是否过量,可以用指示剂、活动金属、大理石等。
(2)、 解:设100g氢氧化钠溶液中含溶质的质量为x。
MgCl2+ 2NaOH=2NaCl+ Mg(OH)2↓
80 58
x 2.9g
解得:x=4g
NaOH溶液的溶质质量分数: ×100%=4%
(3)、 滴加紫色石蕊试液,溶液呈红色;加入适量的碳酸钙粉末,产生大量气泡;加入适量的金属锌,锌的表面产生气泡。
8.(1)②
(2)解:设收集到的淡水的质量为m
(25000g-m)ⅹ0.4%=25000gⅹ0.3% 解得:m=6.25kg
答:可以收集到6.25kg淡水。
分析:(1)据图分析,烧瓶中的水受热蒸发,形成水蒸气,通过玻璃导管输送到玻璃板下方,遇冷凝结形成降水,降水落到托盘形成径流。
(2)由暴晒前后溶质的质量不发生改变及m暴晒后=m暴晒前-m水可列等式进行计算。
解答:(1)水循环中海洋水和陆地水有着密切的联系。根据图示可知:装置烧瓶中的水主要代表②海洋水。
(2)根据m暴晒后=m暴晒前-m水列等式进行计算。
解:设收集到的淡水的质量为m
(25000g-m)ⅹ0.4%=25000gⅹ0.3%
解得:m=6.25kg
答:可以收集到6.25kg淡水。
9.(1)1000mL×1.2克/厘米3=1200g,1200x80%=960g。
(2),因此所得稀二氧化氯消毒液中二氧化氯的质量分数是15.5%。
(3)设需要二氧化氯消毒液的质量为x,根据溶液稀释前后,溶质的质量不变,则30kg×20%=x×80%,x=7.5kg,
需要水的质量为30kg-7.5kg=22.5kg,22.5kg的水是22.5L。
分析:(1)溶质质量=溶液质量×溶质的质量分数。
(2)根据溶质质量分数计算公式分析。
(3)溶液稀释前后,溶质的质量不变。
10.(1)过滤
(2)保持不变
(3)设需加水的质量为x,
10kg×25%=(10kg+x)×20%,x=2.5kg。
分析:(1)过滤操作用于分离液体和不溶于液体的固态物质;
(2)根据质量守恒定律可知,反应前后原子的种类、个数和质量保持不变;
(3)稀释前后溶质的质量保持不变,以此为等量关系,根据溶质质量=溶液质量×溶质质量分数列出方程,然后计算即可。
解答:(1)对粗盐进行提纯,其实就是将其中的泥沙和滤液分开,因此操作②的名称为过滤;
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电的条件下分解,获得镁和氯气(Cl2)。此反应前后,各原子的质量是保持不变的。
(3)设需加水的质量为x,
10kg×25%=(10kg+x)×20%;
解得:x=2.5kg。
11.解:设该石灰石中CaCO3的质量分数为xCaCO3+2HCl═CaCl2+H2O+CO2↑100 44200g x66gx=75%
分析:根据反应的化学方程式,由生成二氧化碳的质量可计算石灰石中碳酸钙的质量,即可求得该石灰石中CaCO3的质量分数.
12.(1)骑行时,遮阳棚上方空气流动速度比下方流速快。大气压强产生一个向上的力,使遮阳棚掀翻
(2)0.1A 酒驾
分析:(1)根据流体压强和流速的关系分析;
(2)①从丙图中确定酒精含量为0时气敏电阻R1的阻值,然后根据计算电流表的示数;再根据U变=U总-U1计算出变阻器R2的电压,根据计算变阻器的阻值;
②首先根据计算出此时的总电阻,再根据R1'=R总'-R2计算出气敏电阻的阻值,最后根据丙图确定驾驶员的状态即可。
解答:(1)有关部门规定;不允许电动自行车安装图甲所示的遮阳棚,因为骑行时会出现遮阳棚往上掀翻的情况,理由是:骑行时,遮阳棚上方空气流动速度比下方流速快,大气压强产生一个向上的力,使遮阳棚掀翻。
(2)①根据图乙可知,气敏电阻R1与变阻器串联,电压表测R1的电压,电流表测总电流。
根据丙图可知,酒精含量为0时气敏电阻R1=50Ω,
那么此时电流表的示数为:;
变阻器R2的电压U变=U总-U1=6V-5V=1V;
那么此时变阻器的电阻;
②当电流表的示数为0.2A时,总电阻;
此时气敏电阻的阻值:R1'=R总'-R2=30Ω-10Ω=20Ω;
根据丙图可知,此时酒精含量肯定小于80mg/100mL,
那么该驾驶员为酒驾。
13.(1)平衡;减少
(2)盐酸和碳酸钙反应生成的二氧化碳气体逸出,使总质量减小;不能;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小
(3)解:由质量守恒定律可知,生成二氧化碳的质量为2.2克。 设参加反应的碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+ CO2↑
100 44
x 2.2克
x=5克
石灰石中碳酸钙的质量分数为 ×100%=83.3%。 答:石灰石中碳酸钙的质量分数为83.3%。
分析:探究质量守恒定律,要考虑有没有气体释放到空气中,还要考虑大气压的影响。
解答:(1)铁钉放入试管,发生反应,有化学方程式 Fe+CuSO4=FeSO4+Cu 可以看出无气体释放,故质量没变;由质量守恒定律,反应前后固体质量增加,对应液体质量减少;
(2) 盐酸与石灰石粉末混合 ,由于烧杯敞口,生成的二氧化碳气体释放到空气中,使总质量减少,天平指针向左偏转; 把烧杯换成锥形瓶(如图丙,装置气密性良好) ,虽然生成的二氧化碳气体在整个装置,但气球体积变大, 受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;
(3) 解:由质量守恒定律可知,生成二氧化碳的质量为2.2克。
设参加反应的碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+ CO2↑
100 44
x 2.2克
x=5克
石灰石中碳酸钙的质量分数为 ×100%=83.3%。
答:石灰石中碳酸钙的质量分数为83.3%。
故答案为:(1)平衡;减少; (2) 盐酸和碳酸钙反应生成的二氧化碳气体逸出,使总质量减小 ; 不能;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;(3)如上。
14.(1)CO2+2NaOH═Na2CO3+H2O;吸水
(2)浓盐酸具有很强挥发性,挥发出来的氯化氢会优先与氢氧化钙反应,而且氢氧化钙在常温下溶解度非常小很容易被氯化氢消耗完
分析:(1)①C装置中的氢氧化钠溶液是吸收二氧化碳的,氢氧化钠与二氧化碳反应生成碳酸钠和水,据此写出化学方程式;
②浓硫酸具有吸水性;
(2)浓盐酸具有强烈的挥发性,挥发出来的HCl气体会与含量极少的氢氧化钙反应生成氯化钙,进而不能再与二氧化碳气体反应生成碳酸钙沉淀。
解答:(1)①C 装置中 氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式为: CO2+2NaOH═Na2CO3+H2O ;
②B 装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的吸水性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是:浓盐酸具有很强挥发性,挥发出来的氯化氢会优先与氢氧化钙反应,而且氢氧化钙在常温下溶解度非常小很容易被氯化氢消耗完。
15.(1)氯化钠
(2)不变
分析:主要考查你对 固体溶解度,关于溶液的计算,溶液的定义、组成及特征 等考点的理解。
解答:(1)氯化钠溶液是氯化钠溶于水形成的,因此溶质是氯化钠;
(2)恒温下,物质的溶解度不变,根据饱和溶液中溶质的质量分数=×100%可知,保持温度不变蒸发10克水后,氯化钠溶液的溶质质量分数不变;
故答案为:(1)氯化钠;(2)不变。
16.(1)有机物
(2)27∶35∶8
(3)4.2
分析:(1)有机物即有机化合物,含碳化合物(一氧化碳、二氧化碳、碳酸盐、金属碳化物等少数简单含碳化合物除外)或碳氢化合物及其衍生物的总称。
(2)在化学式中,元素符号右下角的数字就是该原子的个数,据此计算;
(3)氮元素质量=瑞德西韦质量×氮的质量分数。
解答:(1)根据瑞德西韦的化学式 C27H35N6O8P 可知,它含有碳元素,属于有机物。
(2)根据瑞德西韦的化学式 C27H35N6O8P 可知,其中碳、氢、氧的原子个数之比为:27:35:8;
(3)30.1 g 瑞德西韦中含氮元素:。
17.溶液中溶质的质量为:1.05g/cm3×500cm3×10%=52.5g;
需要38%的浓盐酸质量为x,
38%x=52.5g;
解得:x=138.18g;
需要加水的质量:1.05g/cm3×500cm3-138.18g=386.82g;
需要加水的体积:。
分析:稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程计算即可。稀释前后溶液的质量之差就是需要加水的质量,最后根据密度公式计算需要加水的体积。
18.(1)这块金属的体积为:V=a3=(5cm)3=125cm3;
这块金属的密度:;
与表格数据比较可知,这块金属可能是金。
(2)①科学家要五次测量王冠的体积的原因:多次测量取平均值,可以减小误差;
②科学家获知这一密度值的方法为:计算5次测量出的密度的平均值;
③学家会向国王报告王冠可能是用金和铜的混合物制成的。
分析:(1)首先根据V=a3计算出金属块的体积,再根据公式计算出金属的密度,最后与表格数据进行比较即可;
(2)①对同一个物理量进行多次测量,然后计算出所有结果的平均值,可以在一定程度上减小实验误差;
②根据①中的分析解答;
③计算出王冠的密度小于纯金的密度,那么它应该是由黄金和密度小于黄金的金属混合而成的,据此分析解答。
19.(1)85.0
(2)解: 该氧化物中,R与氧元素的质量之比:45g:(85g-45g)=9:8;
(3)解:已知R元素的化合价为+3,其氧化物化学式为R2O3,2M(R):(3×16)=9: 8,则R的相对原子质量为27。
分析:(1)将三次结果相加,然后除以实验次数,从而得到平均值;
(2)氧元素的质量等于氧化物质量减去R元素质量,然后两个质量作比;
(3)在化学式中,正负化合价代数和为零,据此推算出氧化物的化学式,再根据“元素质量之比等于相对原子质量与个数的乘积之比”计算出它的相对原子质量。
解答:(1)表格中的平均值:m= ;
(2)该氧化物中,R与氧元素的质量之比:45g:(85g-45g)=9:8;
(3)设氧化物的化学式为RxOy,根据正负化合价代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3;
则氧化物的化学式为R2O3;
则2M:(16×3)=9:8;
解得:M=27。
20.(1)3
(2)设反应后生成一氧化碳的质量为x
3C2H5OH+8O2 4CO2+ 2CO+9H2O
138 56
69g x
x=28g
答:反应后生成一氧化碳的质量为28g
分析:(1)根据质量守恒可确定化学方程式中化学式前的系数;(2)根据乙醇与氧气反应的化学方程式可以由69g乙醇的量确定生成CO的量.
解答:(1)根据质量守恒定律,化学反应前后原子种类和数量保持不变.根据生成物水中氢原子的个数18可以确定反应物中氢原子的个数也是18,因为一个乙醇分子中含有6个氢原子所以应该有3个氢原子,x的值是3.
故答案为:(1)3
21.(1)需要固体次氯酸钠6克,水44毫升
(2)稀释成0.2%的次氯酸钠溶液的质量:6g÷0.2%=3000g。
分析:(1)根据溶质质量=溶液质量×溶质质量分数计算固体次氯酸钠的质量;
(2)根据溶液质量=计算稀释成0.2%的次氯酸钠溶液的质量。
解答:(1)需要固体次氯酸钠的质量:50g×12%=6g;
(2)稀释成0.2%的次氯酸钠溶液的质量:6g÷0.2%=3000g。
22.(1)0.98
(2)1×10﹣4
(3)0.98
解答:解:物体浸没在水中:
(1)物重就是在空气中弹簧秤的示数:1.96N,即G=1.96N,物体在水中弹簧秤的示数F=0.98N,
利用称重法得:F浮=G﹣F=1.96N﹣0.98N=0.98N,
(2)根据阿基米德原理F浮=ρ水gV排得:V排===1×10﹣4m3;
(3)根据阿基米德原理,排开的水重,G排=F浮=0.98N.
故答案为:(1)0.98;(2)1×10﹣4;(3)0.98.
分析:(1)看图示,弹簧称的示数即是物体重1.96N,放在水中其示数变为0.98N,由称重法知二者之差即是浮力;
(2)根据F浮=ρgV排可求得物体排开水的体积;
(3)物体排开的水重应该是物体受到的浮力.
23.(1))60℃的饱和硝酸钾溶液在室温下放置一段时间后,温度降低,溶解度下降,有一部分硝酸钾晶体析出,溶液的密度减小。鸡蛋受到的浮力减小,小于它自身的重力,所以下沉
(2)在吹气球时,气球变大,瓶内气球外的空间变小,气压变大。当瓶内气球外的气压等于人吹气球时气球内压强时,气球就无法变大了
分析:(1)首先根据温度降低,利用硝酸钾的溶解度和温度的变化规律分析溶液密度的变化,然后根据阿基米德原理F浮=ρ液gV排分析鸡蛋受到的浮力变化,最后根据浮沉条件分析鸡蛋的状态即可。
(2)当气体的质量和温度一定时,体积越小,压强越大,据此分析瓶内气体压强的变化即可。
解答:(1)60℃的饱和硝酸钾溶液在室温下放置一段时间后,温度降低,溶解度下降,有一部分硝酸钾晶体析出,溶液的密度减小。鸡蛋受到的浮力减小,小于它自身的重力,所以下沉;
(2)在吹气球时,气球变大,瓶内气球外的空间变小,气压变大。当瓶内气球外的气压等于人吹气球时气球内压强时,气球就无法变大了。
24.(1)4.8
(2)解:设氯酸钾的质量为x,生成氯化钾的质量为y,
+
245 149 96
x y 4.8g
解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:
分析:(1)氯酸钾和二氧化锰加热,二氧化锰做催化剂,生成氯化钾和氧气。
(2)由氧气的质量,利用化学方程式即可求出参加反应的氯酸钾的质量。
(3)由氧气的质量,利用化学方程式即可求出生成的氯化钾的质量,再结合溶液质量分数求出溶液的质量。
解答:(1)生成氧气的质量就是固体减少的质量=13g-8.2g=4.8g
(2)解:设氯酸钾的质量为x
2KClO3 2KCl +3O2↑
245 96
X 4.8g
X=12.25g
(3)解:设氯生成氯化钾的质量为y
2KClO3 2KCl +3O2↑
149 96
y 4.8g
y=7.45g
氯化钾溶液的质量=7.45g ÷10% = 74.5g
故答案为:(1)4.8g;(2)12.25g;(3)74.5g
25.(1)三
(2)9:14:1
(3)根据化学式C27H42O3可知,皂甙的相对分子质量为:12×27+1×42+16×3=414。
分析:(1)在化学式中,一种符号代表一种元素;
(2)在化学式中,元素符号右下角的数字就是该原子的个数;
(3)相对分子质量等于相对原子质量与个数的乘积之和。
解答:(1)根据化学式C27H42O3可知,皂甙由C、H、O三种元素组成;
(2)根据化学式C27H42O3可知,皂甙中碳、氢、氧三种原子的个数之比:27:42:3=9:14:1。
(3)根据化学式C27H42O3可知,皂甙的相对分子质量为:12×27+1×42+16×3=414。
26.(1)3;C:H:O =12:3:8
(2)120g
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
解答:(1)酒精中含有3种元素,碳元素、氢元素、氧元素的质量比是C:H:O =12:3:8;
(2)230克酒精中碳元素的质量为:,230g×52%=120g。
故答案为:(1)3;C:H:O =12:3:8(2)120g
27.设需要赤铁矿石的质量为x,
200t×(1-2%)=x××80%;
解得:x=350t。
分析:生铁的质量等于赤铁矿石中铁元素的质量,据此列出方程计算即可。
28.(1)C6H12O6的相对分子质量=12×6+12×1+16×6=180,因此葡萄糖的相对分子质量是180。
(2)(12×6):12:(16×6)=6:1:8,葡萄糖中C、H、O三种元素的质量比为6:1:8。
(3)200g×5%=10g,因此200g该葡萄糖注射液含10g葡萄糖。
(4)设需要麦芽糖的质量为x,
则,x=85.5g
分析: (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
29.(1)+3
(2)4
(3)5:7
(4)符合
(5)不正确。按标准适量使用
分析:(1)根据化合物中元素化合价代数和为0分析;
(2)根据化学式确定物质的元素组成分析;
(3)根据化学式右下角数字即为原子个数比分析;
(4)根据表中所给食品中各添加剂的最大使用量分析;
(5)根据食品添加剂可按标准使用量使用分析。
解答:(1) NaNO2中钠元素为+1价,氧元素为-2价,根据化合物中元素化合价代数和为0可知氮元素的化合价为 +3价;
(2) 阿斯巴甜中含有碳、氢、氧、氮四种元素;
(3) β一胡萝卜素分子中碳原子和氢原子的个数比是5:7;
(4) 由所给信息可知胶基糖果中含环七糊精 1kg食物中 最大使用量为20克, 1kg某胶基糖果中含环七糊精11.0g, 符合使用标准 ;
(5) 食品添加剂不能禁止使用,可按标准适量使用。
故答案为:(1)+3;(2)4;(3)5:7;(4)符合;(5)不正确;按标准适量使用。’
30.(1)8
(2)NaCl;NaOH
(3)解:20g氢氧化钠溶液中NaOH的质量=20g×8%=1.6g
设该稀盐酸中HCl的质量为x
HCl+NaOH═NaCl+H2O
36.5 40
x
1.6g
x=1.46g
稀盐酸的质量分数= ×100%=7.3%.
答:该稀盐酸中HCl的质量分数为7.3%
分析:溶质质量分数=×100%.
解答:(1)氢氧化钠固体质量为:100g×8%=8g.
(2)据图示得氢氧化钠加入20g时恰好完全反应,加入25g已经过量,则溶液溶质应该为中和反应生的成的氯化钠和过量的氢氧化钠。
31.(1)解:设理论上消耗氧气的质量为x。
C6H12O6+ 6O2===6CO2+6H2O
180 192
1 000克×5% x
x≈53克
答:理论上至少消耗氧气的质量为53克
(2)解:53克氧气的体积是53克÷1.43克/升≈37升
由于氧气在空气中的体积约占 ,则需空气的体积是37升÷ =185升。
答:185升空气中含有53克质量的氧气。
分析:根据化学方程式计算过程解答。
解答: (1)解:设理论上消耗氧气的质量为x。
C6H12O6+ 6O2===6CO2+6H2O
180 192
1 000克×5% x
x≈53克
答:理论上至少消耗氧气的质量为53克
(2)解:53克氧气的体积是53克÷1.43克/升≈37升
由于氧气在空气中的体积约占 ,则需空气的体积是37升÷ =185升。
答:185升空气中含有53克质量的氧气。
故答案为:(1)53克;(2)185升。
32.(1)7
(2)稀盐酸
(3)所以生成的二氧化碳的质量为100g+50g-147.8g=2.2g;
设参加反应的碳酸钠溶液的溶质的质量分数为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
50gx 2.2g
解得:x=10.6%
(4)根据图二可知,和氯化钙反应的碳酸钠溶液的质量为247.8g-147.8g=100g;
设原混合溶液中CaCl2的质量分数为y
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
100gy 100g×10.6%
;
解得:y=11.1%
分析:根据图二可知,碳酸钠先和盐酸反应,这个过程中溶液的pH不断增大。当稀盐酸完全反应时,溶液呈中性,即pH=7。然后碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,这个过程溶液的pH保持7不变;当氯化钙完全反应后,随着碳酸钠的滴入,溶液的pH不断增大。
(1)b点时碳酸钠和稀盐酸的反应结束,据此判断m的值;
(2)根据前面的分析解答;
(3)a→b段溶液质量的减少量为生成的二氧化碳,据此计算出生成二氧化碳的质量,然后根据碳酸钠和稀盐酸反应的化学方程式,计算出参加反应的碳酸钠的质量分数即可。
(4)首先根据图二,计算出与氯化钙反应的碳酸钠溶液的质量,然后计算出其中碳酸钠溶质的质量,根据碳酸钠和氯化钙反应的方程式计算出氯化钙溶液的质量分数即可。解答:(1)b点时碳酸钠和稀盐酸的反应结束,此时溶液呈中性,即m=7;
(2)a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
33.(1)9:1:12
(2)3;997
解答:(1)维生素C中,C、H、O三种元素的质量比为(12×6):(1×8):(16×6)=9:1:12,故填:9:1:12;
(2)配制1000g溶质质量分数为0.3%的维生素C溶液,需要维生素C的质量为1000g×0.3%=3g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=1000g﹣3g=997g.
故填:3;997.
分析:(1)根据化合物中元素质量比的计算方法来分析;
(2)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量﹣溶质质量即可求得水的质量.
一、解答题
1.乙炔俗称电石气,是因为电石(CaC2)遇水可产生乙炔(C2H2)气体,反应的化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑某桶电石标签的部分内容如图所示.计算:
(1)在C2H2分子中,C原子H原子的个数比为 .
(2)在CaC2中Ca元素C元素的质量比为 .
(3)在CaC2中,C元素的质量分数为 %.
(4)在该桶电石中,纯CaC2的质量为 kg.
2.很多人都喜欢一道美食——香椿煎鸡蛋。中国是唯一把香椿当作蔬菜的国家,它不仅营养丰富,而且具有极高的药用价值,如香椿中含有的皂甙,具有抗菌、防癌的作用,皂甙的化学式为C27H42O3,请回答:
(1)皂甙属于 (选填“单质”或“化合物”)。
(2)皂甙的相对分子质量是 。
(3)41.4g皂甙中碳元素的质量为 g。
3.人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1004。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品.下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:
(1)包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g。那么一盒牛奶含钙至少 g(保留到0.01g)。
(2)求羟基磷酸钙中钙元素的质量分数(保留为0.1%)。
(3)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝多少盒牛奶?
4.2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为如图所示的四类。
(1)以下四种物品中属于垃圾分类中可回收物的是
A.破碗瓷片 B.过期药物 C.废旧报纸 D.枯枝落叶
(2)易腐垃圾经过处理会产生沼气,沼气可以燃烧发电。沼气的主要成分是甲烷(CH4),请写出甲烷燃烧的化学方程式 。
(3)沼气发电时,能量转化形式是 转化为电能。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属 (选填“元素"或“单质”)。
(5)“可回收物”中也包含铝制易拉罐,对铝制易拉罐的回收一般分四步:破碎、脱漆、打包、熔炼。将易拉罐熔炼成铝块的过程,铝发生的物态变化是 。
5.钙元素具有壮骨、健牙、消炎、镇痛的功效。缺钙易导致少年儿童厌食、偏食;不易入睡、易惊醒、易感冒;头发稀疏;智力发育迟缓;学步晚、出牙晚或出牙不整齐;缺钙导致老年人脚后跟疼,腰椎颈椎疼痛,牙齿松动、脱落等。
(1)钙片的化学式中 x 的值为 ;
(2)钙片中钙和碳的原子个数比为 ;
(3)若一个成年人每天需摄入 900mg 的钙元素,则其一日需服几次。(请通过计算说明)
6.秀秀和山山利用氢气还原氧化铜的方法测出某样品中氧化铜的质量(样品中杂质不与氢气反应),进行了如下实验:
①将干燥样品装入硬质玻璃管中;
②用天平分别测出装置乙和装置丙的质量后,搭建好仪器,如图所示;
③往长颈漏斗加入稀硫酸,待丙中产生均匀气泡后,点燃酒精灯对样品进行加热;
④完全反应后,先熄灭酒精灯,待冷却至室温时,并称量乙、丙的质量;
记录反应前后装置乙和丙的质量如下表所示:
装置乙 装置丙
反应前 48.8 161.2g
反应后 46.5g 163.9g
(1)秀秀和山山用两种不同的方法都能算出样品中氧化铜的质量。秀秀根据装置乙减少的质量,求得氧化铜的质量为 。
(2)山山根据装置丙的质量变化计算出了氧化铜的质量,请你写出该计算过程。
(3)老师认为两位同学的测量结果都存在误差,请任选一种方法进行评价。
7.实验室有一瓶标签被腐蚀的氢氧化钠溶液,为了测定其溶质质量分数,某兴趣小组设计了两种实验方案,实验过程及结果记录如下:(注:方案2滴入酚酞试液的质量忽略不计:氢氧化钠与氯化镁反应的化学方程式为:MgCl+2NaOH=2NaCI+Mg(OH)2↓)
(1)方案1中进行过滤时,需要用到下列器材中的 (填字母编号,可多选)。
(2)根据方案1中的数据,计算该氢氧化钠溶液中溶质的质量分数。
(3)根据方案2中的数据,算得氢氧化钠溶液的溶质质量分数,发现与事实严重不符,小明分析造成这种情况的原因可能是加入的稀盐酸过量,为证明稀盐酸确实过量需要进行的实验是 (写出实验操作与相应现象)。
8.海洋水是地球上最庞大的水体,在水循环中海洋水和陆地水有着密切的联系。
(1)某兴趣小组通过图甲装置,开展了自然界的水循环模拟实验。装置烧瓶中的水主要代表 (填序号)
①地下水 ②海洋水 ③冰川
(2)海上航行缺乏饮用水时可用蒸馏法获得淡水。用图乙装置将25kg含氯化钠0.3%的海水暴晒4小时后,剩余海水中氧化钠的质量分数为0.4%,则收集到的淡水有多少千克 (不考虑收集过程中的水分散失)
9.近几年,诺如病毒日趋严重,并出现了许多变种,尤其是教室内空气流通不畅,学生比较容易感染。最有效的预防方法之一就是用消毒液对教室空气消毒。学校采用的二氧化氯消毒液是国际上公认的新一代强力、广谱、安全、高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂。二氧化氯消毒液能够迅速,彻底杀灭各种细菌(大肠杆菌,白色念珠菌等)和病毒(肝炎病毒,流感病毒等)。
小科同学观察到瓶上的标签如下表所示。
二氧化氯(ClO2)1000 毫升
溶质质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷,密封储藏
(1)这 1000 毫升二氧化氯消毒液中含溶质二氧化氯多少克;
(2)若将这 1000 毫升二氧化氯消毒液与 5000 克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少;(保留小数点后一位)
(3)我校欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这样的二氧化氯消毒液和多少升水?
10.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用如图方法可进行粗盐提纯,其中操作②的名称为 。
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电的条件下分解,获得镁和氯气(Cl2)。此反应前后,各原子的质量是 (选填“发生变化”或“保持不变”)。
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。现有10kg溶质质量分数为25%的食盐水,若要将其稀释到20%,需加水多少千克?
11.将200g石灰石与足量的盐酸反应,共收集二氧化碳66g.求:该石灰石中CaCO3的质量分数多少?
12.为积极营造安全有序的交通环境。近年来我市严格执行许多安全措施,这些安全措施中都蕴含着许多科学知识。试分析回答:
(1)有关部门规定;不允许电动自行车安装图甲所示的遮阳棚,因为骑行时会出现遮阳棚往上掀翻的情况。请你解释现象
(2)图乙是酒精测试仪工作原理电路图,电源电压为 6V; R1为气敏电阻。它的阻值随气体中酒精含量变化的情況如图丙所示。使用前通过调节滑动变阻器R2对测试仪进行调零,此时电压表示数为5V。调零后 R2的滑片位置保持不变。
①当气体中酒精含量为0时,电压表示数为 5V。则此时电流表的示数为多少安?②对某位驾驶员进行检测时,电流表示数为 0.2A,请通过计算,判斯此时该驾驶员属于洒驾还是醉驾?(气体中酒精含量大于 0 且小于 80mg/100ml.为酒驾,达到或者超过80mg/100mL为醉驾.)
13.某兴趣小组设计如下实验探究质量守恒定律。
甲 乙 丙
(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取下烧杯把铁钉放入试管中,一段时间后,再把烧杯放回天平左盘,最后天平是否平衡? 。反应后试管内溶液的质量 (填“增加”“减少”或“不变”)。
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平左盘,发现天平不再平衡,其原因是 。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,装置气密性良好)。你认为能否验证质量守恒定律并阐述理由: 。
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应,结果精确到0.1%)。
14.小科发现暖水瓶中有一层淡黄色的水垢。据悉,该地区的水垢中除碳酸钙外,无其它盐类。他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:
(1)取 2.5g 水垢按图甲中的 A 装置高温加热充分反应(已知 CaCO3 CaO+CO2↑),产 生的气体依次通过 B、C 装置,实验后发现 C 装置中氢氧化钠溶液增加了 0.88g。
①写出 C 装置中发生化学反应方程式 。
②B 装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 。
15.20℃时氯化钠的溶解度为36克。该温度下,某氯化钠溶液的组成模型如图所示,请回答:
(1)该溶液的溶质是 。
(2)保持温度不变蒸发l0克水后,氯化钠溶液中溶质的质量分数 (填“变大”“变小”或“不变”)。
16.2020年10月22日,美国食品与药品管理局(FDA)为美国吉利德科学公司的瑞德西韦(分子式:C27H35N6O8P)开绿灯,批准该药物用于治疗住院的新冠肺炎患者。瑞德西韦也成为美国首个获准用于治疗新冠患者的药物。
(1)瑞德西韦属于 (选填“有机物”或“无机物”)。
(2)瑞德西韦分子中碳、氢、氧三种原子的个数比为 。
(3)30.1 g 瑞德西韦中含氮元素 g。
17.实验室用 38%的浓盐酸 配制 10%的盐酸溶液 500 毫升,需要加水多少毫升?溶液中溶质质量为多少?(已知 10%盐酸密度为 1.05g/cm3,38%盐酸密度是 1.2g/cm 3 )(保留一位小数)
18.国王给金匠一块纯金属,要求金匠用这块金属为他制一顶王冠。虽然做好的王冠的质量与原来的金属块一样,都是2400克,但国王怀疑王冠中掺入了其他金属。国王让科学家调查王冠的制作材料。
(1)科学家找来一块跟原来完全相同的金属块,测出这块金属的长、宽、高都是5厘米,则这块金属的密度是多大?金属块最可能是哪种金属?
金属 铂 金 银 铜
密度(克/厘米3) 21.4 19.3 10.5 8.9
(2)为了测王冠的密度,科学家先测出王冠的体积,根据测量结果计算出了王冠的密度。下表是科学家五次测量王冠的体积和计算出的密度:
测试次数 202 2 3 4 5
王冠的体积(厘米3) 202 200 201 198 199
王冠的密度(克/厘米3) 11.88 12.00 11. 94 12.12 12.06
①科学家为什么要五次测量王冠的体积?
②科学家向国王报告王冠的密度是12.0克/厘米3。请说明科学家是怎样利用他们的测量结果获得这一密度值的。
③科学家会向国王报告王冠可能是用哪种金属或金属的混合物制成的?
19.有一瓶未贴标签的粉末状常见金属R,为了测定R的相对原子质量,准确称取一定量的金属粉末,在坩埚内加强热使其完全反应,冷却后再称重,重复实验、,获得如表数据。请回答下列问题(已知金属与氧元素结合形成的化合物称为金属氧化物)。
实验次数 金属质量(g) 金属氧化物质量(g)
1 45.0 84.9
2 45.0 85.1
3 45.0 85.0
平均值 45.0 m
(1)表格中m= 。
(2)求该金属氧化物中,R元素和氧元素的质量比。
(3)已知R元素的化合价为+3,求R的相对原子质量。
20.乙醇(C2H5OH)俗称酒精,是一种能替代汽油等燃料的清洁能源,但在氧气不足时燃烧除生成二氧化碳和水外,还会生成一氧化碳.现有69 g乙醇与一定量的氧气点燃后发生如下反应:xC2H5OH + 8O2yCO2 + zCO + 9H2O.
(1)判断系数x的值是 .
(2)计算反应后生成一氧化碳的质量.
21.“84消毒液”广泛应用于物体表面的消毒,其有效成分是次氯酸钠。
(1)配制50g溶质质量分数为12%的次氯酸钠溶液中,需要固体次氯酸钠多少克?
(2)可将上述溶液稀释成溶质质量分数为0.2%的次氯酸钠溶液多少克?
22. 由如图所示实验中观察到的数据,计算相应的物理量.(g=9.8N/kg,ρ水=1.0×103kg/m3)
(1)物体受到的浮力为 N.
(2)物体排开水的体积是 m3.
(3)物体排开的水重为 N.
23.小明做了下面两个实验,请解释其中的科学道理:
(1)准备了一杯60℃的恰好饱和的硝酸钾溶液,悬浮着一只新鲜鸡蛋。如图,放在室温下,一段时间后,发现鸡蛋下沉,请用学过的知识解释这一现象。
(2)他在一个空矿泉水瓶里面套一个气球,在矿泉水瓶外用绳子扎紧气球的口,然后小明对着气球吹气,可是,小明用了很大的力气也只能吹大一点点,可是矿泉水瓶里还有很大的空间,小明觉得很纳闷,请你来帮忙解释这个现象。
24.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是 克;
(2)参加反应的氯酸钾的质量是多少克
(3)氯化钾溶液的质量是多少克
25.中国是把香椿当做蔬菜的唯一国家。它不仅营养丰富,而且具有极高的药用价值,如香椿中含有的皂甙(dài),具有抗菌、防癌的作用,皂甙的化学式为C27H42O3,请你计算:
(1)皂甙由 种元素组成。
(2)皂甙中碳、氢、氧元素的原子个数之比是 。
(3)皂甙的相对分子质量(写出计算过程)。
26.疫情期间,某小区居民用酒精(C2H5OH)消毒发生火灾,后被消防队员扑灭。
(1)酒精中含有 种元素,碳元素、氢元素、氧元素的质量比是 ;
(2)230克酒精中碳元素的质量为 。
27.若冶炼200吨含杂质的质量分数为2%的生铁,需要含氧化铁的质量分数为80%的赤铁矿石多少吨?
28.右下图是某药厂生产的葡萄糖注射液的标签。其溶质葡萄糖的化学式为C6H12O6。试计算(写出计算过程):
(1)葡萄糖的相对分子质量是多少?
(2)葡萄糖中C、H、O三种元素的质量比为多少?
(3)200g该葡萄糖注射液含多少g葡萄糖?
(4)90g葡萄糖中所含碳元素的质量与多少g麦芽糖(C12H22O11)中所含碳元素的质量相等。
29.表中是四种常见的食品添加剂:
名称 亚硝酸钠 阿斯巴甜 β一胡萝卜素 环七糊精
化学式 NaNO2 C14H18O5N2 C40H56 (C6H10O5)7
类别 防腐剂护色剂 甜味剂 着色剂营养强化剂 增稠剂
最大使用量(每1kg食物中) 腊肉中0.15g 膨化食品中0.5g 淡奶油中0.02g 胶基糖果中20.0g
根据信息,请回答下列问题:
(1)NaNO2中氮元素的化合价为 。
(2)阿斯巴甜中含有 种元素。
(3)β一胡萝卜素分子中碳原子和氢原子的个数比是 。(最简整数比)
(4)测得1kg某胶基糖果中含环七糊精11.0g, (填“符合”或“不符合”)其使用标准。
(5)“我国应该禁止使用所有的食品添加剂”,这种说法是否正确并说明理由: 。(写出一条即可)
30.某科学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
(1)配制100g质量分数为8%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g.
(2)如图表示用上述配制的氢氧化钠溶液与20g某稀盐酸发生反应后溶液pH值的变化情况.当加入25g氢氧化钠溶液时,所得溶液中的溶质为 、 (写化学式).
(3)试计算该稀盐酸中溶质的质量分数(请写出计算过程)
31.人体注射葡萄糖溶液可以补充能量,葡萄糖(C6H12O6)在体内经缓慢氧化生成二氧化碳和水,释放出能量。若1 000克5%葡萄糖注射液中的葡萄糖完全氧化,计算:
(1)理论上至少消耗O2多少克?
(2)多少升空气中含有这些质量的氧气?(氧气密度为1.43克/升)
32.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH。反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。(忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。)
(1)m点的数值是 。
(2)a→b段表示碳酸钠与混合溶液中的 反应。
(3)参加反应的碳酸钠溶液的溶质的质量分数是?
(4)请计算原混合溶液中CaCl2的质量分数为?(写计算过程)。
33. 人体所需的维生素C(化学式为C6H8O6)主要从蔬菜、水果中摄取.请计算:
(1)维生素C中碳元素、氢元素、氧元素的质量的最简整数比为 .
(2)若要配制溶质质量分数为0.3%的维生素C溶液1000g,需要维生素C的质量为 g,水的质量为 g.
答案解析部分
1.(1)1:1
(2)5:3
(3)37.5
(4)40
分析:(1)根据1个乙炔分子的构成进行分析解答.(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数= ×100%,进行分析解答.(4)根据题意,一桶电石的质量为50kg,CaC2的质量分数为80%,据此进行分析解答.
解答:解:(1)1个乙炔分子是由2个碳原子和2个氢原子构成的,则在C2H2分子中,C原子H原子的个数比为1:1.(2)在CaC2中Ca元素C元素的质量比为40:(12×2)=5:3.(3)在CaC2中,C元素的质量分数为 100%=37.5%.(4)一桶电石的质量为50kg,CaC2的质量分数为80%,在该桶电石中纯CaC2的质量为50kg×80%=40kg.
故答案为:(1)1:1;(2)5:3;(3)37.5;(4)40.
2.(1)化合物
(2)414
(3)32.4
分析:(1)只由一种元素组成的纯净物叫单质;由多种元素组成的纯净物叫化合物。
(2)相对分子质量等于相对原子质量和个数的乘积之和。
(3)碳元素的质量=皂甙的质量×碳元素的质量分数。
解答:(1)根据化学式 C27H42O3 可知,皂甙由C、H、O三种元素组成,为化合物。
(2)皂甙的相对分子质量是:12×27+1×42+16×3=414;
(3)41.4g皂甙中碳元素的质量为:。
3.(1)0.28
(2)羟基磷酸钙中钙元素的质量分数=,即39.8%。
(3)人体每天至少需要来自牛奶的钙=0.6g×90%÷0.28g≈2盒
答:一个人每天至少要喝2盒牛奶。
分析:(1)通过分析题目信息“包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g”,结合一盒牛奶含量求解。
(2)化合物中元素的质量分数等于该元素相对原子质量的总和除以相对分子质量。
(1)先求出人体每天需要的来自牛奶的钙的质量,在结合每盒牛奶的含钙量求出盒数。
解答:(1)因为“包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g”,那么“包装标签上钙≥0.11g,是指100mL牛奶中含钙的质量至少0.11g”,所以一盒牛奶至少含钙为=250ml×0.11g/100ml=0,28g。
(2)化合物中元素的质量分数等于该元素相对原子质量的总和除以相对分子质量,所以羟基磷酸钙中钙元素的质量分数=。
(3)先求出人体每天需要的来自牛奶的钙的质量=0.6g×90%=0.54g,牛奶的盒数=0.54g÷0.28g≈2盒。
故答案为:(1)0.28;(2)39.8%;(3)2盒
4.(1)C
(2)CH4+2O2=CO2+2H2O
(3)化学能
(4)元素
(5)熔化和凝固
分析:(1)根据可回收物的定义判断;
(2)确定反应物、反应条件和生成物,据此写出反应的方程式;
(3)根据能量转化的知识判断;
(4)元素是具有相同核电荷数的同一类原子的统称;
(5)确定初始态和终末态,从而确定物态变化的名称。
解答:(1)可回收物指适宜回收利用和资源化利用的生活废弃物,包括废纸、废塑料、废金属、废包装物、废旧纺织物、废弃电器电子产品、废玻璃、废纸塑铝复合包装等,故C符合题意,而A、B、D不合题意。
故选C。
(2)甲烷与氧气在点燃的条件下反应,生成二氧化碳和水,反应的方程式为: CH4+2O2=CO2+2H2O 。
(3)沼气发电时,能量转化形式是化学能转化为电能。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属元素。
(5)易拉罐原来为固态,后来变成液态,这个过程叫熔化;液态的铝变成固态的铝块,这个过程叫凝固。
5.(1)11
(2)1:12
(3)Ca%=40/430=9.3%mCa=3.3×9.3%=0.3g=300mg每天需要=900/300=3粒服三次每次1粒
分析:考查有关化学式的简单计算。
解答:(1)已知相对分子质量为430=40+2×(12×6+X+16×7),解方程得X=11.
(2)化学式为 :右下角的数值就是其中各原子的个数,Ca:C=1:12;
(3)题目中已知每片钙总的3.3g,其中钙元素质量分数为 Ca%=40/430=9.3%
每一片钙含量为: mCa=3.3×9.3%=0.3g=300mg ,每天需要900mg,则需要每天服三片。
答案为:(1)11 (2)1:12
6.(1)11.5g
(2)解:m水=163.9g-161.2g =2.7g
CuO+H2 Cu+ H2O
80 18
X 2.7g
X=12g
(3)解:①山山的方案因为装置丙中浓硫酸敞口放置,会吸收空气中的水分,使质量偏重;
②秀秀的方案因为在装置甲的反应过程中,会有水蒸气逸出到硬质玻璃管中,使装置乙的质量偏大;装置乙中的CuO没有平铺,无法被氢气完全还原成Cu
分析:(1)根据乙乙减少质量为参加反应的氧化铜中氧元素质量结合化学式中元素质量计算方法分析;
(2)根据生成水的质量代入方程式中,利用方程式计算氧化铜质量分析;
(3)根据两实验方案中空气中水蒸气及氢气中的水蒸气对实验的影响分析。
解答:(1)乙减少质量为参加反应的氧化铜中氧元素质量,为48.8-46.5=2.3g,则氧化铜质量为;
(2)丙质量变化为反应后生成水的质量,由水的质量利用方程式计算氧化铜质量;
故答案为:(1)11.5g;(2)12g;(3)①山山的方案因为装置丙中浓硫酸敞口放置,会吸收空气中的水分,使质量偏重;②秀秀的方案因为在装置甲的反应过程中,会有水蒸气逸出到硬质玻璃管中,使装置乙的质量偏大;装置乙中的CuO没有平铺,无法被氢气完全还原成Cu。
7.(1)B、D、E
(2)解:设100g氢氧化钠溶液中含溶质的质量为x。
MgCl2+ 2NaOH=2NaCl+ Mg(OH)2↓
80 58
x 2.9g
解得:x=4g
NaOH溶液的溶质质量分数: ×100%=4%
(3)滴加紫色石蕊试液,溶液呈红色;加入适量的碳酸钙粉末,产生大量气泡;加入适量的金属锌,锌的表面产生气泡
分析:(1)结合实验方案图,实验过程对照实验器材解答。
(2)根据氯化镁和氢氧化钠反应的化学方程式计算。
(3)紫色石蕊溶液遇到酸变为红色;碳酸钙和稀盐酸反应产生气泡;锌和稀盐酸反应产生气泡。
解答:(1)、过滤需要用到玻璃仪器为烧杯、漏斗、玻璃棒;
(2)、根据化学方程,已知白色测定质量,可以求得氢氧化钠的质量;
(3)、检验盐酸是否过量,可以用指示剂、活动金属、大理石等。
(2)、 解:设100g氢氧化钠溶液中含溶质的质量为x。
MgCl2+ 2NaOH=2NaCl+ Mg(OH)2↓
80 58
x 2.9g
解得:x=4g
NaOH溶液的溶质质量分数: ×100%=4%
(3)、 滴加紫色石蕊试液,溶液呈红色;加入适量的碳酸钙粉末,产生大量气泡;加入适量的金属锌,锌的表面产生气泡。
8.(1)②
(2)解:设收集到的淡水的质量为m
(25000g-m)ⅹ0.4%=25000gⅹ0.3% 解得:m=6.25kg
答:可以收集到6.25kg淡水。
分析:(1)据图分析,烧瓶中的水受热蒸发,形成水蒸气,通过玻璃导管输送到玻璃板下方,遇冷凝结形成降水,降水落到托盘形成径流。
(2)由暴晒前后溶质的质量不发生改变及m暴晒后=m暴晒前-m水可列等式进行计算。
解答:(1)水循环中海洋水和陆地水有着密切的联系。根据图示可知:装置烧瓶中的水主要代表②海洋水。
(2)根据m暴晒后=m暴晒前-m水列等式进行计算。
解:设收集到的淡水的质量为m
(25000g-m)ⅹ0.4%=25000gⅹ0.3%
解得:m=6.25kg
答:可以收集到6.25kg淡水。
9.(1)1000mL×1.2克/厘米3=1200g,1200x80%=960g。
(2),因此所得稀二氧化氯消毒液中二氧化氯的质量分数是15.5%。
(3)设需要二氧化氯消毒液的质量为x,根据溶液稀释前后,溶质的质量不变,则30kg×20%=x×80%,x=7.5kg,
需要水的质量为30kg-7.5kg=22.5kg,22.5kg的水是22.5L。
分析:(1)溶质质量=溶液质量×溶质的质量分数。
(2)根据溶质质量分数计算公式分析。
(3)溶液稀释前后,溶质的质量不变。
10.(1)过滤
(2)保持不变
(3)设需加水的质量为x,
10kg×25%=(10kg+x)×20%,x=2.5kg。
分析:(1)过滤操作用于分离液体和不溶于液体的固态物质;
(2)根据质量守恒定律可知,反应前后原子的种类、个数和质量保持不变;
(3)稀释前后溶质的质量保持不变,以此为等量关系,根据溶质质量=溶液质量×溶质质量分数列出方程,然后计算即可。
解答:(1)对粗盐进行提纯,其实就是将其中的泥沙和滤液分开,因此操作②的名称为过滤;
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电的条件下分解,获得镁和氯气(Cl2)。此反应前后,各原子的质量是保持不变的。
(3)设需加水的质量为x,
10kg×25%=(10kg+x)×20%;
解得:x=2.5kg。
11.解:设该石灰石中CaCO3的质量分数为xCaCO3+2HCl═CaCl2+H2O+CO2↑100 44200g x66gx=75%
分析:根据反应的化学方程式,由生成二氧化碳的质量可计算石灰石中碳酸钙的质量,即可求得该石灰石中CaCO3的质量分数.
12.(1)骑行时,遮阳棚上方空气流动速度比下方流速快。大气压强产生一个向上的力,使遮阳棚掀翻
(2)0.1A 酒驾
分析:(1)根据流体压强和流速的关系分析;
(2)①从丙图中确定酒精含量为0时气敏电阻R1的阻值,然后根据计算电流表的示数;再根据U变=U总-U1计算出变阻器R2的电压,根据计算变阻器的阻值;
②首先根据计算出此时的总电阻,再根据R1'=R总'-R2计算出气敏电阻的阻值,最后根据丙图确定驾驶员的状态即可。
解答:(1)有关部门规定;不允许电动自行车安装图甲所示的遮阳棚,因为骑行时会出现遮阳棚往上掀翻的情况,理由是:骑行时,遮阳棚上方空气流动速度比下方流速快,大气压强产生一个向上的力,使遮阳棚掀翻。
(2)①根据图乙可知,气敏电阻R1与变阻器串联,电压表测R1的电压,电流表测总电流。
根据丙图可知,酒精含量为0时气敏电阻R1=50Ω,
那么此时电流表的示数为:;
变阻器R2的电压U变=U总-U1=6V-5V=1V;
那么此时变阻器的电阻;
②当电流表的示数为0.2A时,总电阻;
此时气敏电阻的阻值:R1'=R总'-R2=30Ω-10Ω=20Ω;
根据丙图可知,此时酒精含量肯定小于80mg/100mL,
那么该驾驶员为酒驾。
13.(1)平衡;减少
(2)盐酸和碳酸钙反应生成的二氧化碳气体逸出,使总质量减小;不能;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小
(3)解:由质量守恒定律可知,生成二氧化碳的质量为2.2克。 设参加反应的碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+ CO2↑
100 44
x 2.2克
x=5克
石灰石中碳酸钙的质量分数为 ×100%=83.3%。 答:石灰石中碳酸钙的质量分数为83.3%。
分析:探究质量守恒定律,要考虑有没有气体释放到空气中,还要考虑大气压的影响。
解答:(1)铁钉放入试管,发生反应,有化学方程式 Fe+CuSO4=FeSO4+Cu 可以看出无气体释放,故质量没变;由质量守恒定律,反应前后固体质量增加,对应液体质量减少;
(2) 盐酸与石灰石粉末混合 ,由于烧杯敞口,生成的二氧化碳气体释放到空气中,使总质量减少,天平指针向左偏转; 把烧杯换成锥形瓶(如图丙,装置气密性良好) ,虽然生成的二氧化碳气体在整个装置,但气球体积变大, 受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;
(3) 解:由质量守恒定律可知,生成二氧化碳的质量为2.2克。
设参加反应的碳酸钙的质量为x。
CaCO3+2HCl===CaCl2+H2O+ CO2↑
100 44
x 2.2克
x=5克
石灰石中碳酸钙的质量分数为 ×100%=83.3%。
答:石灰石中碳酸钙的质量分数为83.3%。
故答案为:(1)平衡;减少; (2) 盐酸和碳酸钙反应生成的二氧化碳气体逸出,使总质量减小 ; 不能;气球变大后,受到空气的浮力变大,导致天平称量反应后物质质量的读数偏小 ;(3)如上。
14.(1)CO2+2NaOH═Na2CO3+H2O;吸水
(2)浓盐酸具有很强挥发性,挥发出来的氯化氢会优先与氢氧化钙反应,而且氢氧化钙在常温下溶解度非常小很容易被氯化氢消耗完
分析:(1)①C装置中的氢氧化钠溶液是吸收二氧化碳的,氢氧化钠与二氧化碳反应生成碳酸钠和水,据此写出化学方程式;
②浓硫酸具有吸水性;
(2)浓盐酸具有强烈的挥发性,挥发出来的HCl气体会与含量极少的氢氧化钙反应生成氯化钙,进而不能再与二氧化碳气体反应生成碳酸钙沉淀。
解答:(1)①C 装置中 氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式为: CO2+2NaOH═Na2CO3+H2O ;
②B 装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的吸水性。
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是:浓盐酸具有很强挥发性,挥发出来的氯化氢会优先与氢氧化钙反应,而且氢氧化钙在常温下溶解度非常小很容易被氯化氢消耗完。
15.(1)氯化钠
(2)不变
分析:主要考查你对 固体溶解度,关于溶液的计算,溶液的定义、组成及特征 等考点的理解。
解答:(1)氯化钠溶液是氯化钠溶于水形成的,因此溶质是氯化钠;
(2)恒温下,物质的溶解度不变,根据饱和溶液中溶质的质量分数=×100%可知,保持温度不变蒸发10克水后,氯化钠溶液的溶质质量分数不变;
故答案为:(1)氯化钠;(2)不变。
16.(1)有机物
(2)27∶35∶8
(3)4.2
分析:(1)有机物即有机化合物,含碳化合物(一氧化碳、二氧化碳、碳酸盐、金属碳化物等少数简单含碳化合物除外)或碳氢化合物及其衍生物的总称。
(2)在化学式中,元素符号右下角的数字就是该原子的个数,据此计算;
(3)氮元素质量=瑞德西韦质量×氮的质量分数。
解答:(1)根据瑞德西韦的化学式 C27H35N6O8P 可知,它含有碳元素,属于有机物。
(2)根据瑞德西韦的化学式 C27H35N6O8P 可知,其中碳、氢、氧的原子个数之比为:27:35:8;
(3)30.1 g 瑞德西韦中含氮元素:。
17.溶液中溶质的质量为:1.05g/cm3×500cm3×10%=52.5g;
需要38%的浓盐酸质量为x,
38%x=52.5g;
解得:x=138.18g;
需要加水的质量:1.05g/cm3×500cm3-138.18g=386.82g;
需要加水的体积:。
分析:稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程计算即可。稀释前后溶液的质量之差就是需要加水的质量,最后根据密度公式计算需要加水的体积。
18.(1)这块金属的体积为:V=a3=(5cm)3=125cm3;
这块金属的密度:;
与表格数据比较可知,这块金属可能是金。
(2)①科学家要五次测量王冠的体积的原因:多次测量取平均值,可以减小误差;
②科学家获知这一密度值的方法为:计算5次测量出的密度的平均值;
③学家会向国王报告王冠可能是用金和铜的混合物制成的。
分析:(1)首先根据V=a3计算出金属块的体积,再根据公式计算出金属的密度,最后与表格数据进行比较即可;
(2)①对同一个物理量进行多次测量,然后计算出所有结果的平均值,可以在一定程度上减小实验误差;
②根据①中的分析解答;
③计算出王冠的密度小于纯金的密度,那么它应该是由黄金和密度小于黄金的金属混合而成的,据此分析解答。
19.(1)85.0
(2)解: 该氧化物中,R与氧元素的质量之比:45g:(85g-45g)=9:8;
(3)解:已知R元素的化合价为+3,其氧化物化学式为R2O3,2M(R):(3×16)=9: 8,则R的相对原子质量为27。
分析:(1)将三次结果相加,然后除以实验次数,从而得到平均值;
(2)氧元素的质量等于氧化物质量减去R元素质量,然后两个质量作比;
(3)在化学式中,正负化合价代数和为零,据此推算出氧化物的化学式,再根据“元素质量之比等于相对原子质量与个数的乘积之比”计算出它的相对原子质量。
解答:(1)表格中的平均值:m= ;
(2)该氧化物中,R与氧元素的质量之比:45g:(85g-45g)=9:8;
(3)设氧化物的化学式为RxOy,根据正负化合价代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3;
则氧化物的化学式为R2O3;
则2M:(16×3)=9:8;
解得:M=27。
20.(1)3
(2)设反应后生成一氧化碳的质量为x
3C2H5OH+8O2 4CO2+ 2CO+9H2O
138 56
69g x
x=28g
答:反应后生成一氧化碳的质量为28g
分析:(1)根据质量守恒可确定化学方程式中化学式前的系数;(2)根据乙醇与氧气反应的化学方程式可以由69g乙醇的量确定生成CO的量.
解答:(1)根据质量守恒定律,化学反应前后原子种类和数量保持不变.根据生成物水中氢原子的个数18可以确定反应物中氢原子的个数也是18,因为一个乙醇分子中含有6个氢原子所以应该有3个氢原子,x的值是3.
故答案为:(1)3
21.(1)需要固体次氯酸钠6克,水44毫升
(2)稀释成0.2%的次氯酸钠溶液的质量:6g÷0.2%=3000g。
分析:(1)根据溶质质量=溶液质量×溶质质量分数计算固体次氯酸钠的质量;
(2)根据溶液质量=计算稀释成0.2%的次氯酸钠溶液的质量。
解答:(1)需要固体次氯酸钠的质量:50g×12%=6g;
(2)稀释成0.2%的次氯酸钠溶液的质量:6g÷0.2%=3000g。
22.(1)0.98
(2)1×10﹣4
(3)0.98
解答:解:物体浸没在水中:
(1)物重就是在空气中弹簧秤的示数:1.96N,即G=1.96N,物体在水中弹簧秤的示数F=0.98N,
利用称重法得:F浮=G﹣F=1.96N﹣0.98N=0.98N,
(2)根据阿基米德原理F浮=ρ水gV排得:V排===1×10﹣4m3;
(3)根据阿基米德原理,排开的水重,G排=F浮=0.98N.
故答案为:(1)0.98;(2)1×10﹣4;(3)0.98.
分析:(1)看图示,弹簧称的示数即是物体重1.96N,放在水中其示数变为0.98N,由称重法知二者之差即是浮力;
(2)根据F浮=ρgV排可求得物体排开水的体积;
(3)物体排开的水重应该是物体受到的浮力.
23.(1))60℃的饱和硝酸钾溶液在室温下放置一段时间后,温度降低,溶解度下降,有一部分硝酸钾晶体析出,溶液的密度减小。鸡蛋受到的浮力减小,小于它自身的重力,所以下沉
(2)在吹气球时,气球变大,瓶内气球外的空间变小,气压变大。当瓶内气球外的气压等于人吹气球时气球内压强时,气球就无法变大了
分析:(1)首先根据温度降低,利用硝酸钾的溶解度和温度的变化规律分析溶液密度的变化,然后根据阿基米德原理F浮=ρ液gV排分析鸡蛋受到的浮力变化,最后根据浮沉条件分析鸡蛋的状态即可。
(2)当气体的质量和温度一定时,体积越小,压强越大,据此分析瓶内气体压强的变化即可。
解答:(1)60℃的饱和硝酸钾溶液在室温下放置一段时间后,温度降低,溶解度下降,有一部分硝酸钾晶体析出,溶液的密度减小。鸡蛋受到的浮力减小,小于它自身的重力,所以下沉;
(2)在吹气球时,气球变大,瓶内气球外的空间变小,气压变大。当瓶内气球外的气压等于人吹气球时气球内压强时,气球就无法变大了。
24.(1)4.8
(2)解:设氯酸钾的质量为x,生成氯化钾的质量为y,
+
245 149 96
x y 4.8g
解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:
分析:(1)氯酸钾和二氧化锰加热,二氧化锰做催化剂,生成氯化钾和氧气。
(2)由氧气的质量,利用化学方程式即可求出参加反应的氯酸钾的质量。
(3)由氧气的质量,利用化学方程式即可求出生成的氯化钾的质量,再结合溶液质量分数求出溶液的质量。
解答:(1)生成氧气的质量就是固体减少的质量=13g-8.2g=4.8g
(2)解:设氯酸钾的质量为x
2KClO3 2KCl +3O2↑
245 96
X 4.8g
X=12.25g
(3)解:设氯生成氯化钾的质量为y
2KClO3 2KCl +3O2↑
149 96
y 4.8g
y=7.45g
氯化钾溶液的质量=7.45g ÷10% = 74.5g
故答案为:(1)4.8g;(2)12.25g;(3)74.5g
25.(1)三
(2)9:14:1
(3)根据化学式C27H42O3可知,皂甙的相对分子质量为:12×27+1×42+16×3=414。
分析:(1)在化学式中,一种符号代表一种元素;
(2)在化学式中,元素符号右下角的数字就是该原子的个数;
(3)相对分子质量等于相对原子质量与个数的乘积之和。
解答:(1)根据化学式C27H42O3可知,皂甙由C、H、O三种元素组成;
(2)根据化学式C27H42O3可知,皂甙中碳、氢、氧三种原子的个数之比:27:42:3=9:14:1。
(3)根据化学式C27H42O3可知,皂甙的相对分子质量为:12×27+1×42+16×3=414。
26.(1)3;C:H:O =12:3:8
(2)120g
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
解答:(1)酒精中含有3种元素,碳元素、氢元素、氧元素的质量比是C:H:O =12:3:8;
(2)230克酒精中碳元素的质量为:,230g×52%=120g。
故答案为:(1)3;C:H:O =12:3:8(2)120g
27.设需要赤铁矿石的质量为x,
200t×(1-2%)=x××80%;
解得:x=350t。
分析:生铁的质量等于赤铁矿石中铁元素的质量,据此列出方程计算即可。
28.(1)C6H12O6的相对分子质量=12×6+12×1+16×6=180,因此葡萄糖的相对分子质量是180。
(2)(12×6):12:(16×6)=6:1:8,葡萄糖中C、H、O三种元素的质量比为6:1:8。
(3)200g×5%=10g,因此200g该葡萄糖注射液含10g葡萄糖。
(4)设需要麦芽糖的质量为x,
则,x=85.5g
分析: (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
29.(1)+3
(2)4
(3)5:7
(4)符合
(5)不正确。按标准适量使用
分析:(1)根据化合物中元素化合价代数和为0分析;
(2)根据化学式确定物质的元素组成分析;
(3)根据化学式右下角数字即为原子个数比分析;
(4)根据表中所给食品中各添加剂的最大使用量分析;
(5)根据食品添加剂可按标准使用量使用分析。
解答:(1) NaNO2中钠元素为+1价,氧元素为-2价,根据化合物中元素化合价代数和为0可知氮元素的化合价为 +3价;
(2) 阿斯巴甜中含有碳、氢、氧、氮四种元素;
(3) β一胡萝卜素分子中碳原子和氢原子的个数比是5:7;
(4) 由所给信息可知胶基糖果中含环七糊精 1kg食物中 最大使用量为20克, 1kg某胶基糖果中含环七糊精11.0g, 符合使用标准 ;
(5) 食品添加剂不能禁止使用,可按标准适量使用。
故答案为:(1)+3;(2)4;(3)5:7;(4)符合;(5)不正确;按标准适量使用。’
30.(1)8
(2)NaCl;NaOH
(3)解:20g氢氧化钠溶液中NaOH的质量=20g×8%=1.6g
设该稀盐酸中HCl的质量为x
HCl+NaOH═NaCl+H2O
36.5 40
x
1.6g
x=1.46g
稀盐酸的质量分数= ×100%=7.3%.
答:该稀盐酸中HCl的质量分数为7.3%
分析:溶质质量分数=×100%.
解答:(1)氢氧化钠固体质量为:100g×8%=8g.
(2)据图示得氢氧化钠加入20g时恰好完全反应,加入25g已经过量,则溶液溶质应该为中和反应生的成的氯化钠和过量的氢氧化钠。
31.(1)解:设理论上消耗氧气的质量为x。
C6H12O6+ 6O2===6CO2+6H2O
180 192
1 000克×5% x
x≈53克
答:理论上至少消耗氧气的质量为53克
(2)解:53克氧气的体积是53克÷1.43克/升≈37升
由于氧气在空气中的体积约占 ,则需空气的体积是37升÷ =185升。
答:185升空气中含有53克质量的氧气。
分析:根据化学方程式计算过程解答。
解答: (1)解:设理论上消耗氧气的质量为x。
C6H12O6+ 6O2===6CO2+6H2O
180 192
1 000克×5% x
x≈53克
答:理论上至少消耗氧气的质量为53克
(2)解:53克氧气的体积是53克÷1.43克/升≈37升
由于氧气在空气中的体积约占 ,则需空气的体积是37升÷ =185升。
答:185升空气中含有53克质量的氧气。
故答案为:(1)53克;(2)185升。
32.(1)7
(2)稀盐酸
(3)所以生成的二氧化碳的质量为100g+50g-147.8g=2.2g;
设参加反应的碳酸钠溶液的溶质的质量分数为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
50gx 2.2g
解得:x=10.6%
(4)根据图二可知,和氯化钙反应的碳酸钠溶液的质量为247.8g-147.8g=100g;
设原混合溶液中CaCl2的质量分数为y
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
100gy 100g×10.6%
;
解得:y=11.1%
分析:根据图二可知,碳酸钠先和盐酸反应,这个过程中溶液的pH不断增大。当稀盐酸完全反应时,溶液呈中性,即pH=7。然后碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,这个过程溶液的pH保持7不变;当氯化钙完全反应后,随着碳酸钠的滴入,溶液的pH不断增大。
(1)b点时碳酸钠和稀盐酸的反应结束,据此判断m的值;
(2)根据前面的分析解答;
(3)a→b段溶液质量的减少量为生成的二氧化碳,据此计算出生成二氧化碳的质量,然后根据碳酸钠和稀盐酸反应的化学方程式,计算出参加反应的碳酸钠的质量分数即可。
(4)首先根据图二,计算出与氯化钙反应的碳酸钠溶液的质量,然后计算出其中碳酸钠溶质的质量,根据碳酸钠和氯化钙反应的方程式计算出氯化钙溶液的质量分数即可。解答:(1)b点时碳酸钠和稀盐酸的反应结束,此时溶液呈中性,即m=7;
(2)a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
33.(1)9:1:12
(2)3;997
解答:(1)维生素C中,C、H、O三种元素的质量比为(12×6):(1×8):(16×6)=9:1:12,故填:9:1:12;
(2)配制1000g溶质质量分数为0.3%的维生素C溶液,需要维生素C的质量为1000g×0.3%=3g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=1000g﹣3g=997g.
故填:3;997.
分析:(1)根据化合物中元素质量比的计算方法来分析;
(2)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量﹣溶质质量即可求得水的质量.
