第十一单元盐化肥测试题—2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第十一单元盐化肥测试题—2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 154.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-04 17:46:21 | ||
图片预览



文档简介
第十一单元《盐 化肥》测试题
一、单选题
1.下列知识归纳完全正确的是
A.性质与用途 B.化学与环保
①氧气可用于炼钢,是由于氧气具有可燃性 ②CO可用于炼铁,是由于CO具有还原性 ①大力发展化石能源,满足工业生产需求 ②二氧化硫是造成酸雨的主要气体
C.化学与生活 D.物质分类
①生石灰可用作食品干燥剂 ②如果庄稼的叶子发黄,可施用氮肥 ①烧碱、纯碱都属于碱 ②二氧化锰、氧化铝都属于氧化物
A.A B.B C.C D.D
2.下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A.溶液呈碱性 B.固体难溶于水
C.“纯碱”是碳酸钠的俗名 D.可用于烘焙糕点
3.下列物质不能与NaOH溶液反应的是
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
4.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
5.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
6.下列化肥属于复合肥料的是( )
A.氯化钾 B.磷矿粉 C.硝酸钠 D.硝酸钾
7.下列4个图像分别对应4个变化过程,其中正确的是
A.电解水
B.将一定量的60℃硝酸钾饱和溶液冷却至室温
C.等质量的镁、铝分别与相同浓度的足量稀硫酸反应
D.向一定量CuSO4和K2SO4混合溶液中,不断加入KOH溶液
8.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
9.粗盐中难溶性杂质的去除过程中,涉及到称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
10.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
11.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
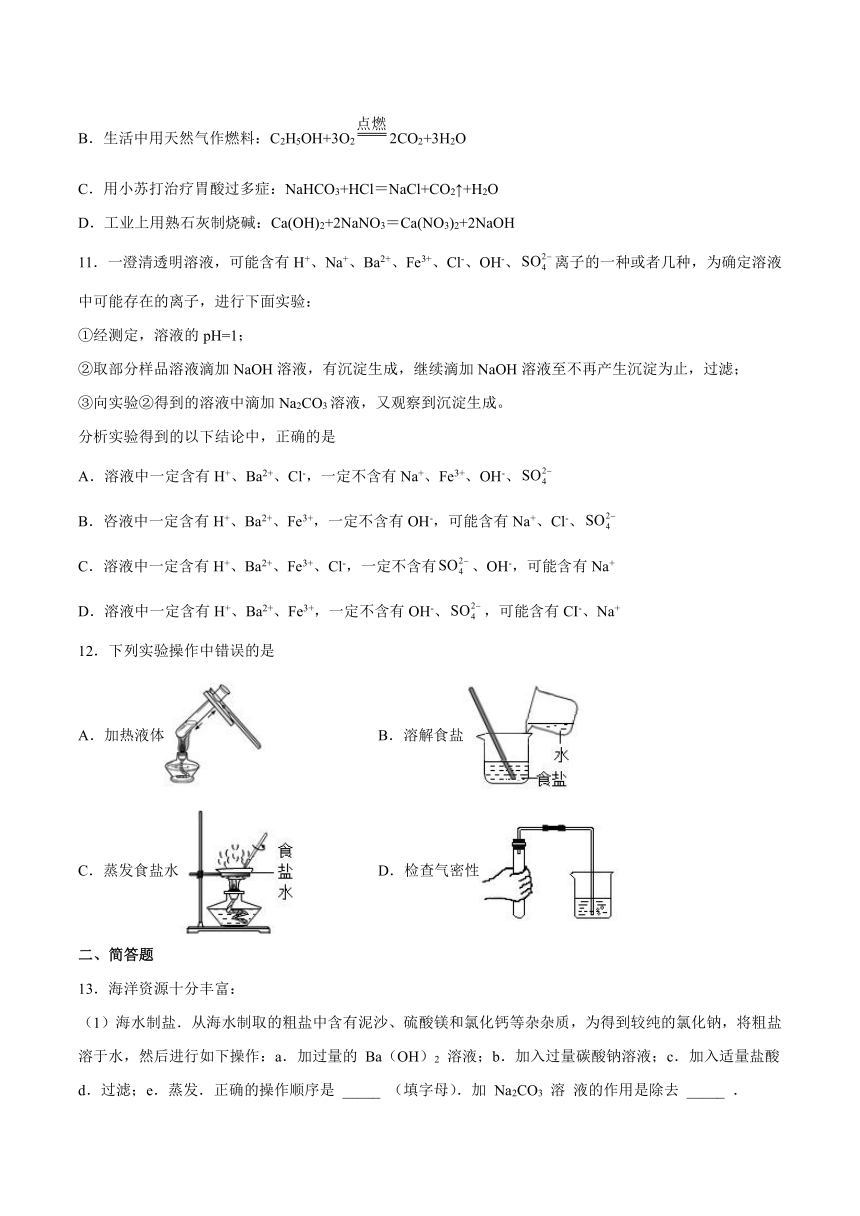
12.下列实验操作中错误的是
A.加热液体 B.溶解食盐
C.蒸发食盐水 D.检查气密性
二、简答题
13.海洋资源十分丰富:
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的 Ba(OH)2 溶液;b.加入过量碳酸钠溶液;c.加入适量盐酸d.过滤;e.蒸发.正确的操作顺序是 _____ (填字母).加 Na2CO3 溶 液的作用是除去 _____ .
(2)晒盐后得到的卤水中含有 MgCl2、KCl 和 MgSO4 等物质,如图是它们的溶解度曲线示意图.设 t1℃时 MgCl2、KCl 和 MgSO4 三种物质的溶解度分别为 a、b、c, 则它们的大小关系为 _____ .
(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是 _______ .
(4)海底矿产资源“可燃冰”的主要成分是水合甲烷晶体(CH4 nH2O),若水合甲烷晶体中 CH4 的质量分数为 10%,则水合甲烷晶体的化学式为 ______ .甲烷燃烧的化学方程式是 _______ .
14.自制汽水时,需要的原料有白糖、碳酸氢钠、柠檬酸、凉开水等。制作时会有大量气泡冒出,原因是 __________________________。
15.某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤。
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体。往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤。回答下列问题:
(1)白色沉淀B是_____,步骤②中放出的气体是_____。
(2)杂质中一定含有_____,一定没有_____。
(3)最终所得滤液中含有的阳离子是_____。
三、推断题
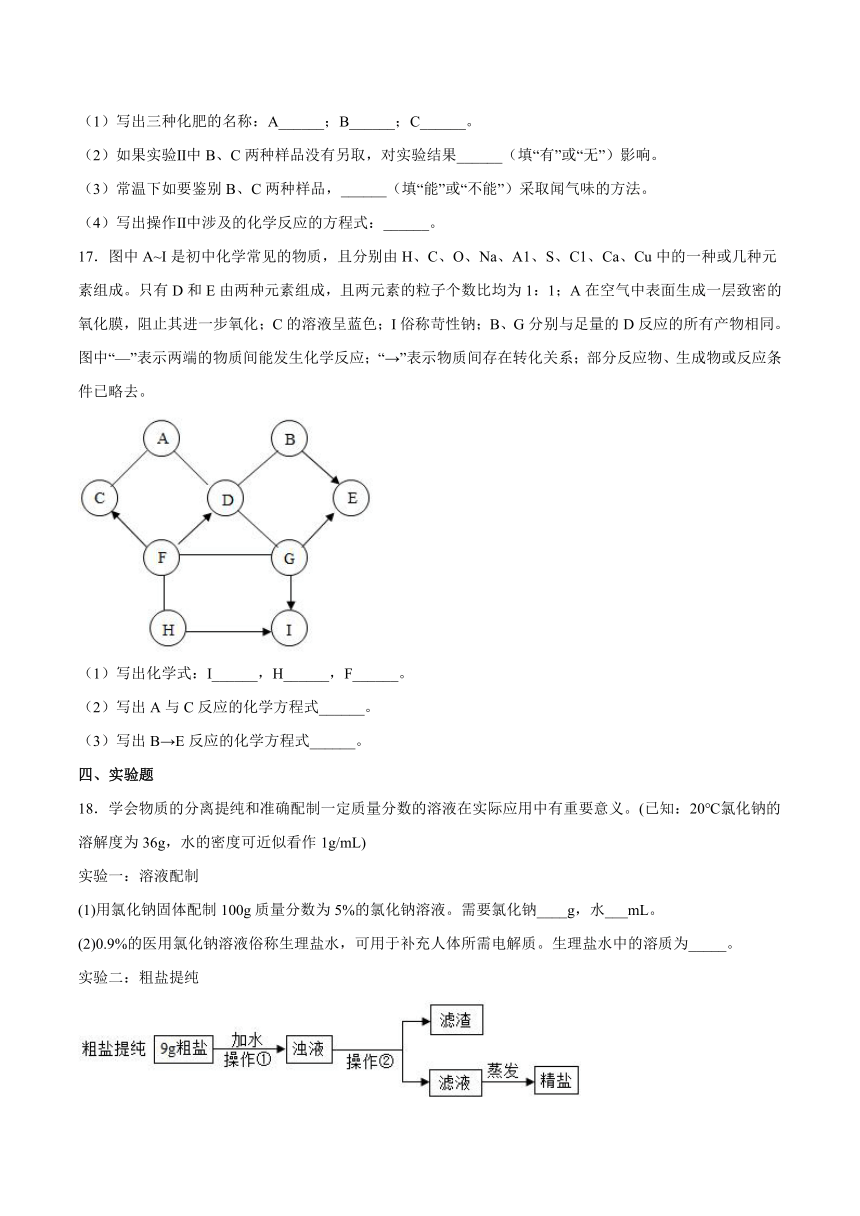
16.实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种。为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如图实验(此处箭头表示得出实验结论):
根据上述实验回答:
(1)写出三种化肥的名称:A______;B______;C______。
(2)如果实验Ⅱ中B、C两种样品没有另取,对实验结果______(填“有”或“无”)影响。
(3)常温下如要鉴别B、C两种样品,______(填“能”或“不能”)采取闻气味的方法。
(4)写出操作Ⅱ中涉及的化学反应的方程式:______。
17.图中A~I是初中化学常见的物质,且分别由H、C、O、Na、A1、S、C1、Ca、Cu中的一种或几种元素组成。只有D和E由两种元素组成,且两元素的粒子个数比均为1:1;A在空气中表面生成一层致密的氧化膜,阻止其进一步氧化;C的溶液呈蓝色;I俗称苛性钠;B、G分别与足量的D反应的所有产物相同。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:I______,H______,F______。
(2)写出A与C反应的化学方程式______。
(3)写出B→E反应的化学方程式______。
四、实验题
18.学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠____g,水___mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为_____。
实验二:粗盐提纯
(3)操作①中玻璃棒的作用是_____,操作②的名称为_____。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由________。
(5)提纯后的精盐属于____(填“纯净物”或“混合物”)。
19.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:下图是同学们做粗盐提纯实验的操作示意图。
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是_______________________________________。
(2)操作⑥中的错误是___________________________________________________。
(3)粗盐提纯实验的操作顺序为(填操作序号)___________________________、称量精盐并计算产率。
(4)操作④中,当观察到_______________________________________时,停止加热。
实验二:用提纯得到的精盐配制了50 g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有___________________(填序号)。
①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
五、计算题
20.在82.2g碳酸钠溶液中,逐渐加入盐酸,所加盐酸的质量与产生气体的质量关系如下图所示(滴加过程中先发生化学反应:Na2CO3+HCl==NaCl+NaHCO3)。试计算(不考虑气体的溶解和盐酸的挥发):
(1)m的值为___________。
(2)刚好不再产生气体时,溶液中溶质的质量分数。
21.在实验室中化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取23.7g样品放入锥形瓶中,加入适量的水,充分振荡,再向锥形瓶滴加盐酸充分反应。测得数据如表。回答下列问题:
加入盐酸的总质量/g 20 40 60 80 100 120
产生气体的总质量/g 0 2.2 4.4 6.6 m 8.8
(1)加入120g盐酸后,溶液中溶质的化学式为 。
(2)求样品中碳酸钙的质量分数是多少?(精确到0.1%)
(3)在如图画出产生气体的质量与加入盐酸的关系图。
(4)所加盐酸溶液溶质的质量分数是多少?
参考答案:
1.C 2.B 3.D 4.C 5.A 6.D 7.B 8.C 9.C 10.C 11.C 12.C
13. abdce CaCl2和过量的 Ba(OH)2 a>b=c 蒸干没有晶体析出 CH4 8H2O CH4+2O2 CO2+2H2O
14.碳酸氢钠与柠檬酸在水中反应生成二氧化碳
15. 氯化银 二氧化碳气体 硫酸钾 碳酸钙、硫酸铜、氯化钙 K+、Ba2+、H+
16. 尿素 碳酸氢铵 氯化铵 无 能 NH4HCO3+HCl═NH4Cl+H2O+CO2↑
17. NaOH Ca(OH)2 H2SO4
18. 5 95 NaCl 搅拌 过滤 25mL;粗盐中氯化钠的质量为7.2g,此温度下氯化钠全部溶解需要水20mL 混合物
19.实验一(1)加速溶解 (2)未用玻璃棒引流
(3)①⑤②③⑥④ (4)出现较多固体
实验二:①②③
20.(1)6.6g
(2)解:设碳酸氢钠与稀盐酸反应生成氯化钠的质量为x,稀盐酸的溶质质量分数为y
x=11.7g
y=9.125%
设碳酸钠与稀盐酸反应生成氯化钠的质量为z
z=11.7g
刚好不再产生气体时,溶液中溶质的质量分数为
答:刚好不再产生气体时,溶液中溶质的质量分数为10%。
21.(1)CaCl2、HCl;
(2)解:设碳酸钙的质量为x
x=20g
样品中碳酸钙的质量分数=×100%≈84.4%。
答:样品中碳酸钙的质量分数是84.4%。
(3);
(4)解:设20g稀盐酸中溶质的质量为z
z=3.65g
所加盐酸溶液溶质的质量分数=×100%=18.25%
答:所加盐酸溶液溶质的质量分数是18.25%。
一、单选题
1.下列知识归纳完全正确的是
A.性质与用途 B.化学与环保
①氧气可用于炼钢,是由于氧气具有可燃性 ②CO可用于炼铁,是由于CO具有还原性 ①大力发展化石能源,满足工业生产需求 ②二氧化硫是造成酸雨的主要气体
C.化学与生活 D.物质分类
①生石灰可用作食品干燥剂 ②如果庄稼的叶子发黄,可施用氮肥 ①烧碱、纯碱都属于碱 ②二氧化锰、氧化铝都属于氧化物
A.A B.B C.C D.D
2.下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A.溶液呈碱性 B.固体难溶于水
C.“纯碱”是碳酸钠的俗名 D.可用于烘焙糕点
3.下列物质不能与NaOH溶液反应的是
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
4.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
5.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
6.下列化肥属于复合肥料的是( )
A.氯化钾 B.磷矿粉 C.硝酸钠 D.硝酸钾
7.下列4个图像分别对应4个变化过程,其中正确的是
A.电解水
B.将一定量的60℃硝酸钾饱和溶液冷却至室温
C.等质量的镁、铝分别与相同浓度的足量稀硫酸反应
D.向一定量CuSO4和K2SO4混合溶液中,不断加入KOH溶液
8.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
9.粗盐中难溶性杂质的去除过程中,涉及到称量、溶解、过滤、蒸发等过程。下列说法不正确的是( )
A.称量时粗盐放在天平左盘的称量纸上
B.粗盐溶解时,要用玻璃棒不断搅拌
C.蒸发时,在恰好蒸干时停止加热
D.过滤时漏斗下端尖嘴处紧靠烧杯内壁
10.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
11.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
12.下列实验操作中错误的是
A.加热液体 B.溶解食盐
C.蒸发食盐水 D.检查气密性
二、简答题
13.海洋资源十分丰富:
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的 Ba(OH)2 溶液;b.加入过量碳酸钠溶液;c.加入适量盐酸d.过滤;e.蒸发.正确的操作顺序是 _____ (填字母).加 Na2CO3 溶 液的作用是除去 _____ .
(2)晒盐后得到的卤水中含有 MgCl2、KCl 和 MgSO4 等物质,如图是它们的溶解度曲线示意图.设 t1℃时 MgCl2、KCl 和 MgSO4 三种物质的溶解度分别为 a、b、c, 则它们的大小关系为 _____ .
(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是 _______ .
(4)海底矿产资源“可燃冰”的主要成分是水合甲烷晶体(CH4 nH2O),若水合甲烷晶体中 CH4 的质量分数为 10%,则水合甲烷晶体的化学式为 ______ .甲烷燃烧的化学方程式是 _______ .
14.自制汽水时,需要的原料有白糖、碳酸氢钠、柠檬酸、凉开水等。制作时会有大量气泡冒出,原因是 __________________________。
15.某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤。
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体。往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤。回答下列问题:
(1)白色沉淀B是_____,步骤②中放出的气体是_____。
(2)杂质中一定含有_____,一定没有_____。
(3)最终所得滤液中含有的阳离子是_____。
三、推断题
16.实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种。为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如图实验(此处箭头表示得出实验结论):
根据上述实验回答:
(1)写出三种化肥的名称:A______;B______;C______。
(2)如果实验Ⅱ中B、C两种样品没有另取,对实验结果______(填“有”或“无”)影响。
(3)常温下如要鉴别B、C两种样品,______(填“能”或“不能”)采取闻气味的方法。
(4)写出操作Ⅱ中涉及的化学反应的方程式:______。
17.图中A~I是初中化学常见的物质,且分别由H、C、O、Na、A1、S、C1、Ca、Cu中的一种或几种元素组成。只有D和E由两种元素组成,且两元素的粒子个数比均为1:1;A在空气中表面生成一层致密的氧化膜,阻止其进一步氧化;C的溶液呈蓝色;I俗称苛性钠;B、G分别与足量的D反应的所有产物相同。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:I______,H______,F______。
(2)写出A与C反应的化学方程式______。
(3)写出B→E反应的化学方程式______。
四、实验题
18.学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作1g/mL)
实验一:溶液配制
(1)用氯化钠固体配制100g质量分数为5%的氯化钠溶液。需要氯化钠____g,水___mL。
(2)0.9%的医用氯化钠溶液俗称生理盐水,可用于补充人体所需电解质。生理盐水中的溶质为_____。
实验二:粗盐提纯
(3)操作①中玻璃棒的作用是_____,操作②的名称为_____。
(4)20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10mL“”、“25mL”和“100mL”),请你选择并说明理由________。
(5)提纯后的精盐属于____(填“纯净物”或“混合物”)。
19.某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50 g 5%的氯化钠溶液。
实验一:下图是同学们做粗盐提纯实验的操作示意图。
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是_______________________________________。
(2)操作⑥中的错误是___________________________________________________。
(3)粗盐提纯实验的操作顺序为(填操作序号)___________________________、称量精盐并计算产率。
(4)操作④中,当观察到_______________________________________时,停止加热。
实验二:用提纯得到的精盐配制了50 g 5%的氯化钠溶液。经检测,溶质质量分数偏小,其原因可能有___________________(填序号)。
①氯化钠固体仍然不纯 ②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
五、计算题
20.在82.2g碳酸钠溶液中,逐渐加入盐酸,所加盐酸的质量与产生气体的质量关系如下图所示(滴加过程中先发生化学反应:Na2CO3+HCl==NaCl+NaHCO3)。试计算(不考虑气体的溶解和盐酸的挥发):
(1)m的值为___________。
(2)刚好不再产生气体时,溶液中溶质的质量分数。
21.在实验室中化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验分析:称取23.7g样品放入锥形瓶中,加入适量的水,充分振荡,再向锥形瓶滴加盐酸充分反应。测得数据如表。回答下列问题:
加入盐酸的总质量/g 20 40 60 80 100 120
产生气体的总质量/g 0 2.2 4.4 6.6 m 8.8
(1)加入120g盐酸后,溶液中溶质的化学式为 。
(2)求样品中碳酸钙的质量分数是多少?(精确到0.1%)
(3)在如图画出产生气体的质量与加入盐酸的关系图。
(4)所加盐酸溶液溶质的质量分数是多少?
参考答案:
1.C 2.B 3.D 4.C 5.A 6.D 7.B 8.C 9.C 10.C 11.C 12.C
13. abdce CaCl2和过量的 Ba(OH)2 a>b=c 蒸干没有晶体析出 CH4 8H2O CH4+2O2 CO2+2H2O
14.碳酸氢钠与柠檬酸在水中反应生成二氧化碳
15. 氯化银 二氧化碳气体 硫酸钾 碳酸钙、硫酸铜、氯化钙 K+、Ba2+、H+
16. 尿素 碳酸氢铵 氯化铵 无 能 NH4HCO3+HCl═NH4Cl+H2O+CO2↑
17. NaOH Ca(OH)2 H2SO4
18. 5 95 NaCl 搅拌 过滤 25mL;粗盐中氯化钠的质量为7.2g,此温度下氯化钠全部溶解需要水20mL 混合物
19.实验一(1)加速溶解 (2)未用玻璃棒引流
(3)①⑤②③⑥④ (4)出现较多固体
实验二:①②③
20.(1)6.6g
(2)解:设碳酸氢钠与稀盐酸反应生成氯化钠的质量为x,稀盐酸的溶质质量分数为y
x=11.7g
y=9.125%
设碳酸钠与稀盐酸反应生成氯化钠的质量为z
z=11.7g
刚好不再产生气体时,溶液中溶质的质量分数为
答:刚好不再产生气体时,溶液中溶质的质量分数为10%。
21.(1)CaCl2、HCl;
(2)解:设碳酸钙的质量为x
x=20g
样品中碳酸钙的质量分数=×100%≈84.4%。
答:样品中碳酸钙的质量分数是84.4%。
(3);
(4)解:设20g稀盐酸中溶质的质量为z
z=3.65g
所加盐酸溶液溶质的质量分数=×100%=18.25%
答:所加盐酸溶液溶质的质量分数是18.25%。
同课章节目录
