第九单元 金属测试题—2021-2022学年九年级化学鲁教版下册(word版 含答案)
文档属性
| 名称 | 第九单元 金属测试题—2021-2022学年九年级化学鲁教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 103.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 06:41:39 | ||
图片预览


文档简介
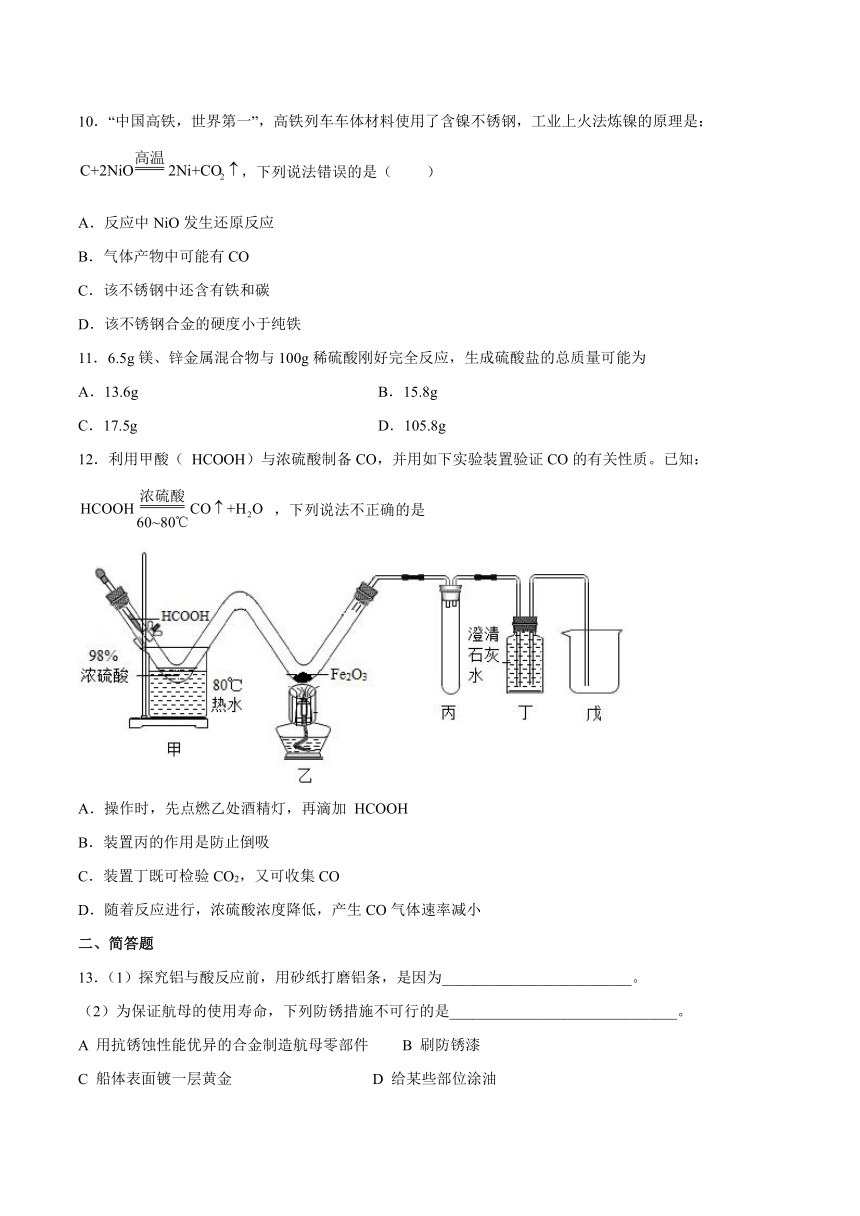
第九单元《金属》检测题
一、单选题
1.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
2.下列物质不能由金属单质和盐酸直接反应生成的是( )
A.FeCl2 B.ZnCl2 C.CuCl2 D.AlCl3
3.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
4.下列有关合金叙述正确的是
A.焊锡的熔点比纯锡的熔点高 B.合金中至少含有两种金属
C.钢是含碳量在2%~4.3%的铁合金 D.黄铜的硬度比纯铜的硬度大
5.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
6.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
7.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
8.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
9.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
10.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
11.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
12.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
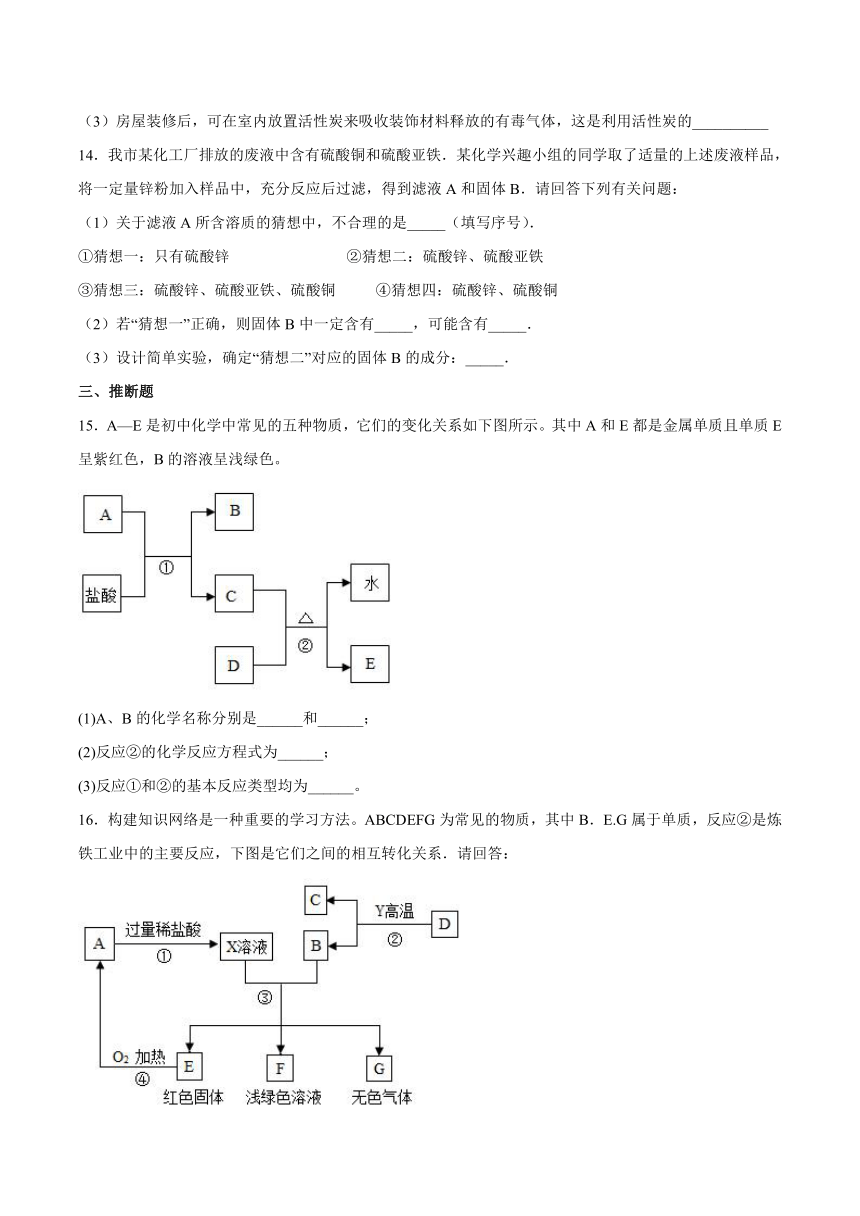
二、简答题
13.(1)探究铝与酸反应前,用砂纸打磨铝条,是因为_________________________。
(2)为保证航母的使用寿命,下列防锈措施不可行的是______________________________。
A 用抗锈蚀性能优异的合金制造航母零部件 B 刷防锈漆
C 船体表面镀一层黄金 D 给某些部位涂油
(3)房屋装修后,可在室内放置活性炭来吸收装饰材料释放的有毒气体,这是利用活性炭的__________
14.我市某化工厂排放的废液中含有硫酸铜和硫酸亚铁.某化学兴趣小组的同学取了适量的上述废液样品,将一定量锌粉加入样品中,充分反应后过滤,得到滤液A和固体B.请回答下列有关问题:
(1)关于滤液A所含溶质的猜想中,不合理的是_____(填写序号).
①猜想一:只有硫酸锌 ②猜想二:硫酸锌、硫酸亚铁
③猜想三:硫酸锌、硫酸亚铁、硫酸铜 ④猜想四:硫酸锌、硫酸铜
(2)若“猜想一”正确,则固体B中一定含有_____,可能含有_____.
(3)设计简单实验,确定“猜想二”对应的固体B的成分:_____.
三、推断题
15.A—E是初中化学中常见的五种物质,它们的变化关系如下图所示。其中A和E都是金属单质且单质E呈紫红色,B的溶液呈浅绿色。
(1)A、B的化学名称分别是______和______;
(2)反应②的化学反应方程式为______;
(3)反应①和②的基本反应类型均为______。
16.构建知识网络是一种重要的学习方法。ABCDEFG为常见的物质,其中B.E.G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系.请回答:
(1)A物质的化学式 _____
(2)写出反应②的化学方程式 _____ ;固态C物质在实际生活中的一种用途是 _____
(3)写出反应③中生成红色固体的化学方程式 _____
(4)写出物质G和A在加热条件下反应的化学方程式 _____
四、实验题
17.某同学用如图装置,进行有关碳及其氧化物的实验(图中夹持已略去),在完成气密性检查后加入药品,并已在装置中充满二氧化碳。
(1)填写表格中的空白内容:
实验步骤 实验现象 实验分析
①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且___________ 硬质玻璃管中发生反应的化学方程式为:C+CO22CO
②点燃B处酒精喷灯,加热一段时间 B处玻璃管内___________ 以上实验说明______ 具有还原性
③停止通入二氧化碳,熄灭A、B两处的火焰 C中有D中液体进入
(2)有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由___________。
18.为验证金属的化学性质,同学们进行了如下实验。
(1)能产生气泡的是_____(填序号)。
(2)能证明Fe的金属活动性比Cu强的现象是_____,发生反应的化学方程式为_____。
(3)有一只试管中的溶液不与Fe反应,原因是_____。
(4)通过实验,得出铁、铜、锌三种金属的活动性顺序从强到弱为_____。
五、计算题
19.镁铜合金常用于制飞机天线,为测定某镁铜合金中镁的质量分数,某小组取6g镁铜合金粉末,向其中缓慢加入稀硫酸,加入稀硫酸的质量与产生氢气的质量关系如图所示。请回答下列问题:
(1)镁铜合金粉末与稀硫酸充分反应产生氢气的质量为 g。
(2)计算镁铜合金粉末中镁的质量分数;
(3)加入50g稀硫酸,理论上充分反应后溶液中镁元素的质量为多少?
20.将一氧化碳通入盛有氧化铁的试管内,加热反应一段时间后,停止加热,继续通入一氧化碳至试管冷却,此时,试管内残留固体的质量为,计算反应生成铁的质量。
参考答案:
1.D 2.C 3.B 4.D 5.C 6.B 7.D 8.C 9.D 10.D 11.C 12.A
13. 铝条在空气中氧化表面形成一层致密的氧化铝薄膜 C 吸附
14. ④ 铜、铁,锌 用磁铁吸引,有黑色粉末被吸引,说明了B是铜与少量铁的混合物 若没有被吸引,说明了B是铜.
15.(1) 铁 氯化亚铁
(2)CuO+H2Cu+H2O或Cu2O+H22Cu+H2O;
(3)置换反应
16. CuO 3CO+Fe2O32Fe+3CO2 人工降雨 CuCl2+Fe=FeCl2+Cu CuO+H2Cu+H2O
17. 液面下降(或石灰水沿右侧导管进入E) 红色粉末变黑 碳和一氧化碳(或C、CO) 不需要,未反应的CO进入D装置后不会逸散到空气中(合理即可)
18. A B铁丝表面有红色固体生成,溶液由蓝色变为浅绿色 Fe+CuSO4=FeSO4+Cu 铁的活动性比锌弱 锌、铁、铜
19.(1)0.4
(2)解:设镁铜合金粉末中镁的质量为x
x=4.8g
答:镁铜合金粉末中镁的质量分数为80%
(3)有图像可知6g镁铜合金粉末(其中含有4.8g镁)与100g稀硫酸恰好反应,如果加入50g稀硫酸,理论上反应的镁元素的质量为2.4g;根据质量守恒定律反应前后元素质量、种类不发生改变,那么理论上充分反应后溶液中镁元素的质量为2.4g
20.解:设生成的铁的质量是x,固体减少的质量是12g-9.6g=2.4g
x=5.6g
答:反应生成的铁的质量为5.6g。
一、单选题
1.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
2.下列物质不能由金属单质和盐酸直接反应生成的是( )
A.FeCl2 B.ZnCl2 C.CuCl2 D.AlCl3
3.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
4.下列有关合金叙述正确的是
A.焊锡的熔点比纯锡的熔点高 B.合金中至少含有两种金属
C.钢是含碳量在2%~4.3%的铁合金 D.黄铜的硬度比纯铜的硬度大
5.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
6.下列所示的图象能反映相对应实验的是
A.向pH=12的Ca(OH)2溶液中不断加水稀释
B.向碳酸钙固体中逐滴加入稀盐酸至过量
C.在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
7.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。下列有关金属材科的说法正确的是( )
A.合金中一定只含金属元素
B.纯铜比黄铜的硬度更大
C.生锈的钢铁制品没有回收价值
D.钛和钛合金被广泛用于火箭、导弹等
8.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
9.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
10.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
11.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
12.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
二、简答题
13.(1)探究铝与酸反应前,用砂纸打磨铝条,是因为_________________________。
(2)为保证航母的使用寿命,下列防锈措施不可行的是______________________________。
A 用抗锈蚀性能优异的合金制造航母零部件 B 刷防锈漆
C 船体表面镀一层黄金 D 给某些部位涂油
(3)房屋装修后,可在室内放置活性炭来吸收装饰材料释放的有毒气体,这是利用活性炭的__________
14.我市某化工厂排放的废液中含有硫酸铜和硫酸亚铁.某化学兴趣小组的同学取了适量的上述废液样品,将一定量锌粉加入样品中,充分反应后过滤,得到滤液A和固体B.请回答下列有关问题:
(1)关于滤液A所含溶质的猜想中,不合理的是_____(填写序号).
①猜想一:只有硫酸锌 ②猜想二:硫酸锌、硫酸亚铁
③猜想三:硫酸锌、硫酸亚铁、硫酸铜 ④猜想四:硫酸锌、硫酸铜
(2)若“猜想一”正确,则固体B中一定含有_____,可能含有_____.
(3)设计简单实验,确定“猜想二”对应的固体B的成分:_____.
三、推断题
15.A—E是初中化学中常见的五种物质,它们的变化关系如下图所示。其中A和E都是金属单质且单质E呈紫红色,B的溶液呈浅绿色。
(1)A、B的化学名称分别是______和______;
(2)反应②的化学反应方程式为______;
(3)反应①和②的基本反应类型均为______。
16.构建知识网络是一种重要的学习方法。ABCDEFG为常见的物质,其中B.E.G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系.请回答:
(1)A物质的化学式 _____
(2)写出反应②的化学方程式 _____ ;固态C物质在实际生活中的一种用途是 _____
(3)写出反应③中生成红色固体的化学方程式 _____
(4)写出物质G和A在加热条件下反应的化学方程式 _____
四、实验题
17.某同学用如图装置,进行有关碳及其氧化物的实验(图中夹持已略去),在完成气密性检查后加入药品,并已在装置中充满二氧化碳。
(1)填写表格中的空白内容:
实验步骤 实验现象 实验分析
①缓缓通入CO2,点燃A处酒精喷灯,加热一段时间 木炭粉减少,D中有气泡产生、澄清石灰水变浑浊且___________ 硬质玻璃管中发生反应的化学方程式为:C+CO22CO
②点燃B处酒精喷灯,加热一段时间 B处玻璃管内___________ 以上实验说明______ 具有还原性
③停止通入二氧化碳,熄灭A、B两处的火焰 C中有D中液体进入
(2)有同学认为该装置需要添加尾气处理装置,你认为是否需要并说明理由___________。
18.为验证金属的化学性质,同学们进行了如下实验。
(1)能产生气泡的是_____(填序号)。
(2)能证明Fe的金属活动性比Cu强的现象是_____,发生反应的化学方程式为_____。
(3)有一只试管中的溶液不与Fe反应,原因是_____。
(4)通过实验,得出铁、铜、锌三种金属的活动性顺序从强到弱为_____。
五、计算题
19.镁铜合金常用于制飞机天线,为测定某镁铜合金中镁的质量分数,某小组取6g镁铜合金粉末,向其中缓慢加入稀硫酸,加入稀硫酸的质量与产生氢气的质量关系如图所示。请回答下列问题:
(1)镁铜合金粉末与稀硫酸充分反应产生氢气的质量为 g。
(2)计算镁铜合金粉末中镁的质量分数;
(3)加入50g稀硫酸,理论上充分反应后溶液中镁元素的质量为多少?
20.将一氧化碳通入盛有氧化铁的试管内,加热反应一段时间后,停止加热,继续通入一氧化碳至试管冷却,此时,试管内残留固体的质量为,计算反应生成铁的质量。
参考答案:
1.D 2.C 3.B 4.D 5.C 6.B 7.D 8.C 9.D 10.D 11.C 12.A
13. 铝条在空气中氧化表面形成一层致密的氧化铝薄膜 C 吸附
14. ④ 铜、铁,锌 用磁铁吸引,有黑色粉末被吸引,说明了B是铜与少量铁的混合物 若没有被吸引,说明了B是铜.
15.(1) 铁 氯化亚铁
(2)CuO+H2Cu+H2O或Cu2O+H22Cu+H2O;
(3)置换反应
16. CuO 3CO+Fe2O32Fe+3CO2 人工降雨 CuCl2+Fe=FeCl2+Cu CuO+H2Cu+H2O
17. 液面下降(或石灰水沿右侧导管进入E) 红色粉末变黑 碳和一氧化碳(或C、CO) 不需要,未反应的CO进入D装置后不会逸散到空气中(合理即可)
18. A B铁丝表面有红色固体生成,溶液由蓝色变为浅绿色 Fe+CuSO4=FeSO4+Cu 铁的活动性比锌弱 锌、铁、铜
19.(1)0.4
(2)解:设镁铜合金粉末中镁的质量为x
x=4.8g
答:镁铜合金粉末中镁的质量分数为80%
(3)有图像可知6g镁铜合金粉末(其中含有4.8g镁)与100g稀硫酸恰好反应,如果加入50g稀硫酸,理论上反应的镁元素的质量为2.4g;根据质量守恒定律反应前后元素质量、种类不发生改变,那么理论上充分反应后溶液中镁元素的质量为2.4g
20.解:设生成的铁的质量是x,固体减少的质量是12g-9.6g=2.4g
x=5.6g
答:反应生成的铁的质量为5.6g。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
