第5章 初识酸和碱检测题—2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第5章 初识酸和碱检测题—2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 118.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 06:46:07 | ||
图片预览



文档简介
第5章《初识酸和碱》检测题
一、单选题
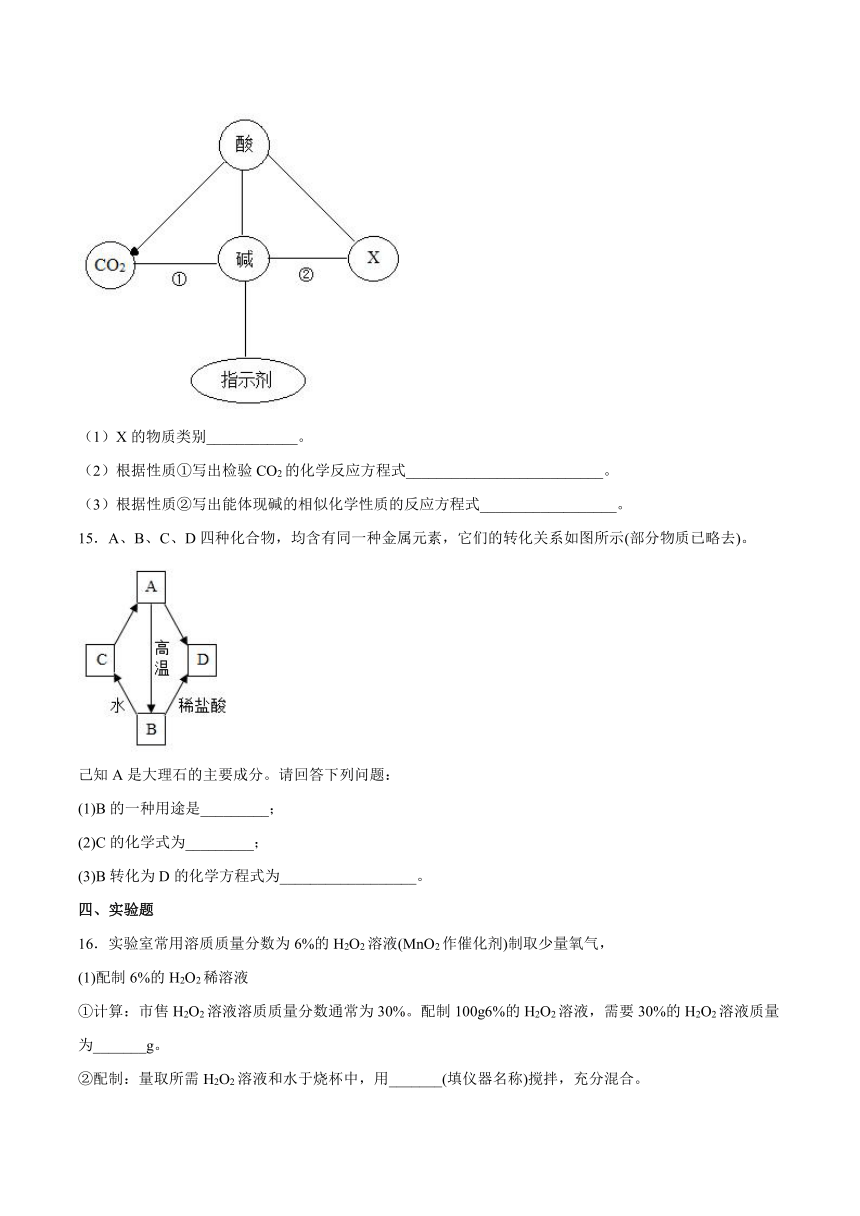
1.加热蒸干氯化镁溶液可得到碱式氯化镁Mgx(OH)yClz,其不溶于水,能与酸反应,加热能分解。取一定质量的碱式氯化镁,加热分解生成16gMgO、7.3gHCl和3.6gH2O。下列说法不正确的是
A.碱式氯化镁的质量为26.9g B.MgO和HCl的分子个数比为2∶1
C.x∶y∶z=2∶1∶3 D.HCl气体溶于水可使紫色石蕊溶液变红
2.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
3.下列药品需要密封保存的原因,解释错误的是( )
A.浓盐酸—— 防止挥发 B.氢氧化钠溶液 ——防止与二氧化碳反应
C.浓硫酸 ——防止吸水 D.生石灰 —— 防止与氧气反应
4.实验室的浓硫酸、浓盐酸敞口放置一段时间后,如图象描述正确的是( )
A. B.
C. D.
5.下列常用来改良酸性土壤的物质是
A.熟石灰
B.硫酸
C.烧碱
D.食盐
6.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
7.向20g纯碱和氯化钠的混合物中,加入100g稀盐酸,恰好完全反应后将滤液蒸干,得到固体21.1g,则原混合物中氯化钠的质量分数为
A.37% B.63% C.53% D.47%
8.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
9.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
10.下列化学方程式与事实相符且正确的是( )
A.甲烷在空气中完全燃烧:
B.用含氢氧化铝的药物治疗胃酸过多:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O
C.三氧化硫与氢氧化钠溶液的反应:SO3+2NaOH═Na2SO4+H2O
D.赤铁矿溶于盐酸:Fe2O3+2HCl═FeCl3+H2O
11.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
二、简答题
12.碳及其氧化物性质的应用。
(1)如图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色消失,说明木炭具有 _____ 能力,其原因是木炭具有 _____ 的结构。
(2)在书写具有保存价值的档案时,规定应使用碳素墨水,原因是 _____
(3)将一定质量的金刚石在足量的氧气中充分燃烧,固体全部消失,写出反应的化学方程式: _____ ;将生成的产物用足量的氢氧化钠溶液来充分吸收并测定其质量,当金刚石的质量恰好等于 _____ 时,则可证明金刚石是由碳元素组成的单质。
(4)在实验室里,检验二氧化碳一般用澄清石灰水,而吸收二氧化碳常用氢氧化钠溶液,理由是 _____ 。
13.某化工厂不断排放废气、废水(含硫酸),严重污染周边环境。
(1)排放在空气中的_______是形成酸雨的主要物质。
(2)周边农民常用________来改良酸性土壤。
(3)用(2)中选用的物质还能降低废水的酸性,反应的方程式是______。
(4)环保部门责令该厂停产整顿,下列整改措施合理的是____。
A.加高烟囱,将废气排向高空 B.改进工艺,减少废水、废气的产生
C.将废水排放在湖中稀释 D.将废气循环利用
三、推断题
14.如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已省略),请回答问题。
(1)X的物质类别____________。
(2)根据性质①写出检验CO2的化学反应方程式__________________________。
(3)根据性质②写出能体现碱的相似化学性质的反应方程式__________________。
15.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。
己知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是_________;
(2)C的化学式为_________;
(3)B转化为D的化学方程式为__________________。
四、实验题
16.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取少量氧气,
(1)配制6%的H2O2稀溶液
①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g6%的H2O2溶液,需要30%的H2O2溶液质量为_______g。
②配制:量取所需H2O2溶液和水于烧杯中,用_______(填仪器名称)搅拌,充分混合。
(2)制取氧气(可能用到的部分装置如下图)
①实验室用H2O2制取氧气的化学方程式为_______,可选择的发生装置为_______(填字母)
②若用C装置干燥氧气,则C中盛放的试剂为_______。
③若用D装置收集氧气,则气体应从导管_______(填“a”或“b”)端通入。
(3)拓展延伸
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,下列发生装置能达到最佳效果的是_______(填字母)。
17.某雪饼包装袋中的干燥剂主要成分是氧化钙。
(1)该干燥剂的干燥原理是_____(用化学方程式表示),该反应的基本类型是_____。
(2)该干燥剂在空气中放置一段时间后,主要成分可能有:氧化钙、氢氧化钙和碳酸钙。为探究其成分,取放置后的干燥剂样品进行如下实验:(杂质不参与反应)
实验操作 实验现象(依据) 实验结论
I. 取少量样品于试管中,加少量水,再滴入酚酞。 无色酚酞变红 该样品中_____(填“可能”或“一 定”)有氧化钙
II. 取少量样品于试管中,滴加足量盐酸。 _____ 该样品中一定没有碳酸钙。
III. 称取该样品 5.6 克,放入足量 水中,得到悬浊液,蒸干得到白色固体 m 克。 m 的数值范围为_____ 该样品的成分是氧化钙和氢氧化钙。
18.今年我市初中化学实验考查的内容是“二氧化碳的制取和性质”,请回答下列相关问题。
(1)从下图所给的仪器中,选择______(填字母)来组装该实验操作考查中制备二氧化碳气体的发生装置,该发生装置的优点是______。
(2)用石灰石和稀盐酸制备并收集两试管的二氧化碳气体,已知每个试管的容积约为20mL,实验条件下,二氧化碳气体的密度约为2.0g/L,该实验所用的稀盐酸的溶质质量分数约为10%。请计算制取这些二氧化碳气体,至少需要的稀盐酸的质量______(写出计算过程,结果保留到0.1g)。
实际实验过程,需添加稀盐酸的质量要远大于该质量,可能的原因是______。
(3)向一支集满CO2的试管内倒入约占试管容积三分之一的澄清石灰水,旋紧胶塞,振荡一定时间。振荡试管前,旋紧胶塞的目的是:______、______。
(4)向另一支集满CO2的试管内注入约2mL蒸馏水,滴入3滴紫色石蕊试液,旋紧胶塞,振荡,观察到紫色石蕊试液变红。大多数同学认为是产生的CO2和H2O反应生成H2CO3,使紫色石蕊试液变红。王同学提出不同猜想,他认为也可能是______使紫色石蕊试液变红,他提出这个猜想的依据是______。请你设计实验方案来验证王同学的猜想______。
(5)经实验研究发现,王同学的猜想是正确的。由此同学们认为,实验室制取二氧化碳气体时,应将气体依次通过盛有______、浓硫酸的洗气装置,可以获得纯净干燥的二氧化碳气体。
五、计算题
19.某样品由氧化铜和铜组成。取10.0g该样品于烧杯中,向其中加入92.0g稀硫酸,恰好完全反应后,过滤,所得滤液质量为100.0g。
(1)所取样品中铜的质量为_____。
(2)从反应后所得的100.0g滤液中取出10.0g溶液,将其稀释为10%的溶液,需要加水多少克___________?
20.现有部分被氧化的铜粉固体混合物,先加热完全氧化后,再加入的稀硫酸恰好完全反应,求固体混合物中铜元素的质量分数。(计算结果精确到0.1%)
参考答案:
1.C 2.D 3.D 4.C 5.A 6.D 7.D 8.C 9.B 10.C 11.B
12. 吸附 疏松多孔 常温下,碳的化学性质稳定 C+O2 CO2 氢氧化钠吸收的二氧化碳中的碳元素 CO2和澄清石灰水的反应有明显的现象,而CO2和氢氧化钠溶液的反应没有明显的现象,因此用澄清石灰水检验CO2;氢氧化钙微溶于水,氢氧化钠易溶于水,因此等量的氢氧化钠溶液比澄清石灰水含有更多的溶质,吸收CO2的效果更好
13. 二氧化硫、氮氧化物(SO2、NxOy或NO2)写出其中之一即可。 生石灰CaO或熟石灰Ca(OH)2 CaO+H2SO4===CaSO4+H2O或Ca(OH)2+H2SO4===CaSO4+2H2O BD
14. 盐 Ca(OH)2+CO2==CaCO3↓+H2O 2NH4Cl+ Ca(OH)2CaCl2+2NH3↑+2H2O (符合题意即可)
15. 用作干燥剂 Ca(OH)2 CaO+2HCl=CaCl2+H2O
16. 20 玻璃棒 B 浓硫酸 a G
17. CaO+H2O=Ca(OH)2 化合反应 可能 固体逐渐溶解,无气泡产生 5.6g<m<7.4g
18. AFG 可以通过长颈漏斗随时添加液体药品 两试管的二氧化碳气体的质量为2×20mL×2.0g/L=0.04g,设至少需要溶质质量分数约为10%的稀盐酸的质量为x,则
解得x≈0.7g。 部分二氧化碳留在装置中不能全部收集 防止石灰水冲出试管腐蚀皮肤 防止二氧化碳溢出使石灰水充分吸收二氧化碳 氯化氢气体溶于水形成盐酸 盐酸具有挥发性,收集到的二氧化碳中含有氯化氢气体 向试管剩余溶液中滴加硝酸银溶液,若产生白色沉淀,说明紫色石蕊试液变红也有盐酸的作用 饱和碳酸氢钠溶液
19.(1)2.0g(2)6g
20.86.5%
一、单选题
1.加热蒸干氯化镁溶液可得到碱式氯化镁Mgx(OH)yClz,其不溶于水,能与酸反应,加热能分解。取一定质量的碱式氯化镁,加热分解生成16gMgO、7.3gHCl和3.6gH2O。下列说法不正确的是
A.碱式氯化镁的质量为26.9g B.MgO和HCl的分子个数比为2∶1
C.x∶y∶z=2∶1∶3 D.HCl气体溶于水可使紫色石蕊溶液变红
2.下列图示实验操作中,正确的是
A.取用液体 B.稀释浓硫酸
C.收集氧气 D.蒸发结晶
3.下列药品需要密封保存的原因,解释错误的是( )
A.浓盐酸—— 防止挥发 B.氢氧化钠溶液 ——防止与二氧化碳反应
C.浓硫酸 ——防止吸水 D.生石灰 —— 防止与氧气反应
4.实验室的浓硫酸、浓盐酸敞口放置一段时间后,如图象描述正确的是( )
A. B.
C. D.
5.下列常用来改良酸性土壤的物质是
A.熟石灰
B.硫酸
C.烧碱
D.食盐
6.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
7.向20g纯碱和氯化钠的混合物中,加入100g稀盐酸,恰好完全反应后将滤液蒸干,得到固体21.1g,则原混合物中氯化钠的质量分数为
A.37% B.63% C.53% D.47%
8.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
9.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
10.下列化学方程式与事实相符且正确的是( )
A.甲烷在空气中完全燃烧:
B.用含氢氧化铝的药物治疗胃酸过多:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O
C.三氧化硫与氢氧化钠溶液的反应:SO3+2NaOH═Na2SO4+H2O
D.赤铁矿溶于盐酸:Fe2O3+2HCl═FeCl3+H2O
11.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
二、简答题
12.碳及其氧化物性质的应用。
(1)如图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色消失,说明木炭具有 _____ 能力,其原因是木炭具有 _____ 的结构。
(2)在书写具有保存价值的档案时,规定应使用碳素墨水,原因是 _____
(3)将一定质量的金刚石在足量的氧气中充分燃烧,固体全部消失,写出反应的化学方程式: _____ ;将生成的产物用足量的氢氧化钠溶液来充分吸收并测定其质量,当金刚石的质量恰好等于 _____ 时,则可证明金刚石是由碳元素组成的单质。
(4)在实验室里,检验二氧化碳一般用澄清石灰水,而吸收二氧化碳常用氢氧化钠溶液,理由是 _____ 。
13.某化工厂不断排放废气、废水(含硫酸),严重污染周边环境。
(1)排放在空气中的_______是形成酸雨的主要物质。
(2)周边农民常用________来改良酸性土壤。
(3)用(2)中选用的物质还能降低废水的酸性,反应的方程式是______。
(4)环保部门责令该厂停产整顿,下列整改措施合理的是____。
A.加高烟囱,将废气排向高空 B.改进工艺,减少废水、废气的产生
C.将废水排放在湖中稀释 D.将废气循环利用
三、推断题
14.如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已省略),请回答问题。
(1)X的物质类别____________。
(2)根据性质①写出检验CO2的化学反应方程式__________________________。
(3)根据性质②写出能体现碱的相似化学性质的反应方程式__________________。
15.A、B、C、D四种化合物,均含有同一种金属元素,它们的转化关系如图所示(部分物质已略去)。
己知A是大理石的主要成分。请回答下列问题:
(1)B的一种用途是_________;
(2)C的化学式为_________;
(3)B转化为D的化学方程式为__________________。
四、实验题
16.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取少量氧气,
(1)配制6%的H2O2稀溶液
①计算:市售H2O2溶液溶质质量分数通常为30%。配制100g6%的H2O2溶液,需要30%的H2O2溶液质量为_______g。
②配制:量取所需H2O2溶液和水于烧杯中,用_______(填仪器名称)搅拌,充分混合。
(2)制取氧气(可能用到的部分装置如下图)
①实验室用H2O2制取氧气的化学方程式为_______,可选择的发生装置为_______(填字母)
②若用C装置干燥氧气,则C中盛放的试剂为_______。
③若用D装置收集氧气,则气体应从导管_______(填“a”或“b”)端通入。
(3)拓展延伸
若直接用30%的H2O2溶液制取氧气,反应速率太快。为获得平稳的气流,下列发生装置能达到最佳效果的是_______(填字母)。
17.某雪饼包装袋中的干燥剂主要成分是氧化钙。
(1)该干燥剂的干燥原理是_____(用化学方程式表示),该反应的基本类型是_____。
(2)该干燥剂在空气中放置一段时间后,主要成分可能有:氧化钙、氢氧化钙和碳酸钙。为探究其成分,取放置后的干燥剂样品进行如下实验:(杂质不参与反应)
实验操作 实验现象(依据) 实验结论
I. 取少量样品于试管中,加少量水,再滴入酚酞。 无色酚酞变红 该样品中_____(填“可能”或“一 定”)有氧化钙
II. 取少量样品于试管中,滴加足量盐酸。 _____ 该样品中一定没有碳酸钙。
III. 称取该样品 5.6 克,放入足量 水中,得到悬浊液,蒸干得到白色固体 m 克。 m 的数值范围为_____ 该样品的成分是氧化钙和氢氧化钙。
18.今年我市初中化学实验考查的内容是“二氧化碳的制取和性质”,请回答下列相关问题。
(1)从下图所给的仪器中,选择______(填字母)来组装该实验操作考查中制备二氧化碳气体的发生装置,该发生装置的优点是______。
(2)用石灰石和稀盐酸制备并收集两试管的二氧化碳气体,已知每个试管的容积约为20mL,实验条件下,二氧化碳气体的密度约为2.0g/L,该实验所用的稀盐酸的溶质质量分数约为10%。请计算制取这些二氧化碳气体,至少需要的稀盐酸的质量______(写出计算过程,结果保留到0.1g)。
实际实验过程,需添加稀盐酸的质量要远大于该质量,可能的原因是______。
(3)向一支集满CO2的试管内倒入约占试管容积三分之一的澄清石灰水,旋紧胶塞,振荡一定时间。振荡试管前,旋紧胶塞的目的是:______、______。
(4)向另一支集满CO2的试管内注入约2mL蒸馏水,滴入3滴紫色石蕊试液,旋紧胶塞,振荡,观察到紫色石蕊试液变红。大多数同学认为是产生的CO2和H2O反应生成H2CO3,使紫色石蕊试液变红。王同学提出不同猜想,他认为也可能是______使紫色石蕊试液变红,他提出这个猜想的依据是______。请你设计实验方案来验证王同学的猜想______。
(5)经实验研究发现,王同学的猜想是正确的。由此同学们认为,实验室制取二氧化碳气体时,应将气体依次通过盛有______、浓硫酸的洗气装置,可以获得纯净干燥的二氧化碳气体。
五、计算题
19.某样品由氧化铜和铜组成。取10.0g该样品于烧杯中,向其中加入92.0g稀硫酸,恰好完全反应后,过滤,所得滤液质量为100.0g。
(1)所取样品中铜的质量为_____。
(2)从反应后所得的100.0g滤液中取出10.0g溶液,将其稀释为10%的溶液,需要加水多少克___________?
20.现有部分被氧化的铜粉固体混合物,先加热完全氧化后,再加入的稀硫酸恰好完全反应,求固体混合物中铜元素的质量分数。(计算结果精确到0.1%)
参考答案:
1.C 2.D 3.D 4.C 5.A 6.D 7.D 8.C 9.B 10.C 11.B
12. 吸附 疏松多孔 常温下,碳的化学性质稳定 C+O2 CO2 氢氧化钠吸收的二氧化碳中的碳元素 CO2和澄清石灰水的反应有明显的现象,而CO2和氢氧化钠溶液的反应没有明显的现象,因此用澄清石灰水检验CO2;氢氧化钙微溶于水,氢氧化钠易溶于水,因此等量的氢氧化钠溶液比澄清石灰水含有更多的溶质,吸收CO2的效果更好
13. 二氧化硫、氮氧化物(SO2、NxOy或NO2)写出其中之一即可。 生石灰CaO或熟石灰Ca(OH)2 CaO+H2SO4===CaSO4+H2O或Ca(OH)2+H2SO4===CaSO4+2H2O BD
14. 盐 Ca(OH)2+CO2==CaCO3↓+H2O 2NH4Cl+ Ca(OH)2CaCl2+2NH3↑+2H2O (符合题意即可)
15. 用作干燥剂 Ca(OH)2 CaO+2HCl=CaCl2+H2O
16. 20 玻璃棒 B 浓硫酸 a G
17. CaO+H2O=Ca(OH)2 化合反应 可能 固体逐渐溶解,无气泡产生 5.6g<m<7.4g
18. AFG 可以通过长颈漏斗随时添加液体药品 两试管的二氧化碳气体的质量为2×20mL×2.0g/L=0.04g,设至少需要溶质质量分数约为10%的稀盐酸的质量为x,则
解得x≈0.7g。 部分二氧化碳留在装置中不能全部收集 防止石灰水冲出试管腐蚀皮肤 防止二氧化碳溢出使石灰水充分吸收二氧化碳 氯化氢气体溶于水形成盐酸 盐酸具有挥发性,收集到的二氧化碳中含有氯化氢气体 向试管剩余溶液中滴加硝酸银溶液,若产生白色沉淀,说明紫色石蕊试液变红也有盐酸的作用 饱和碳酸氢钠溶液
19.(1)2.0g(2)6g
20.86.5%
