第九单元 金属检测题—2021-2022学年九年级化学鲁教版下册(word版 含答案)
文档属性
| 名称 | 第九单元 金属检测题—2021-2022学年九年级化学鲁教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 165.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 06:50:36 | ||
图片预览



文档简介
第九单元《金属》检测题
一、单选题
1.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
2.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
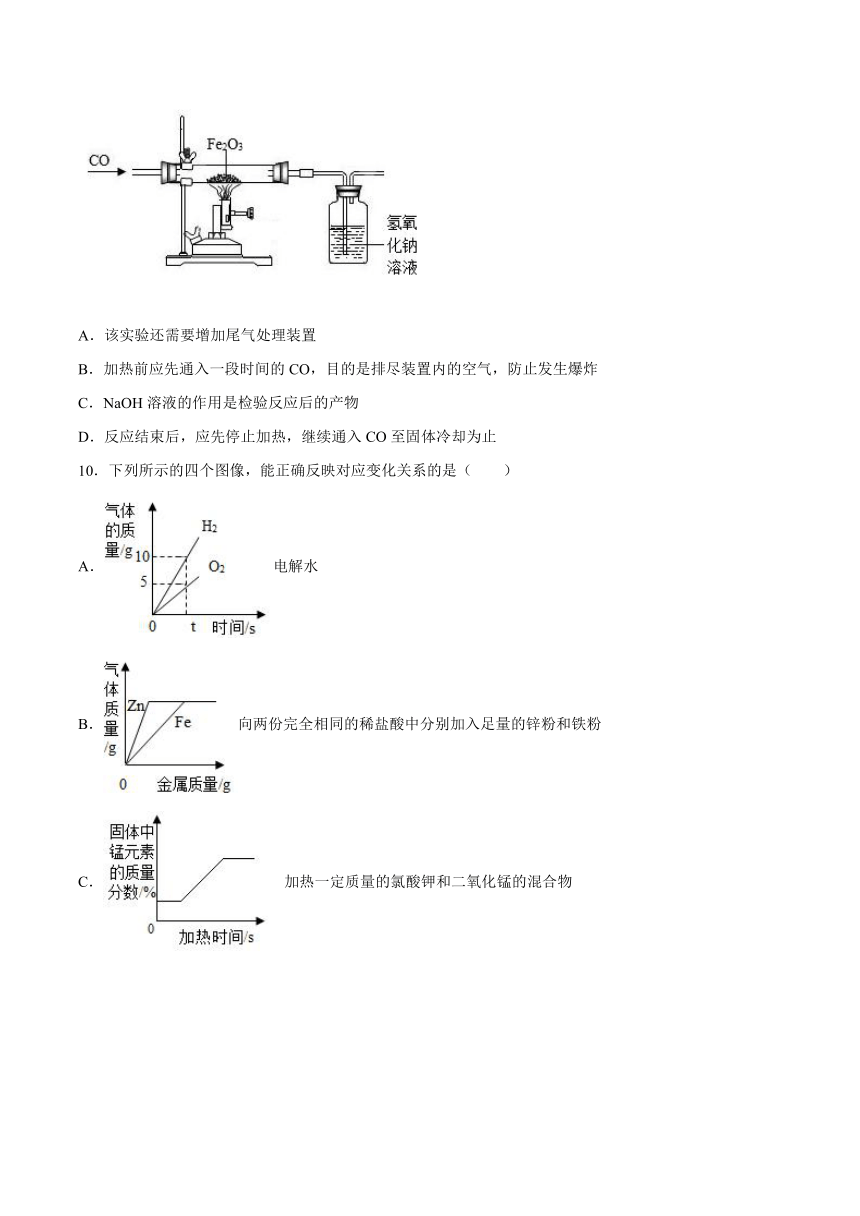
3.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
4.下列方法中,能达到目的是
选项 物质(括号内为杂质) 除去杂质的方法
A CuSO4溶液(H2SO4) 加足量铜粉,过滤
B CaO(CaCO3) 加足量水溶解、过滤
C CO2(CO) 点燃
D FeC12溶液(CuCl2) 加入过量铁粉,过滤
A.A B.B C.C D.D
5.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
6.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
7.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
8.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
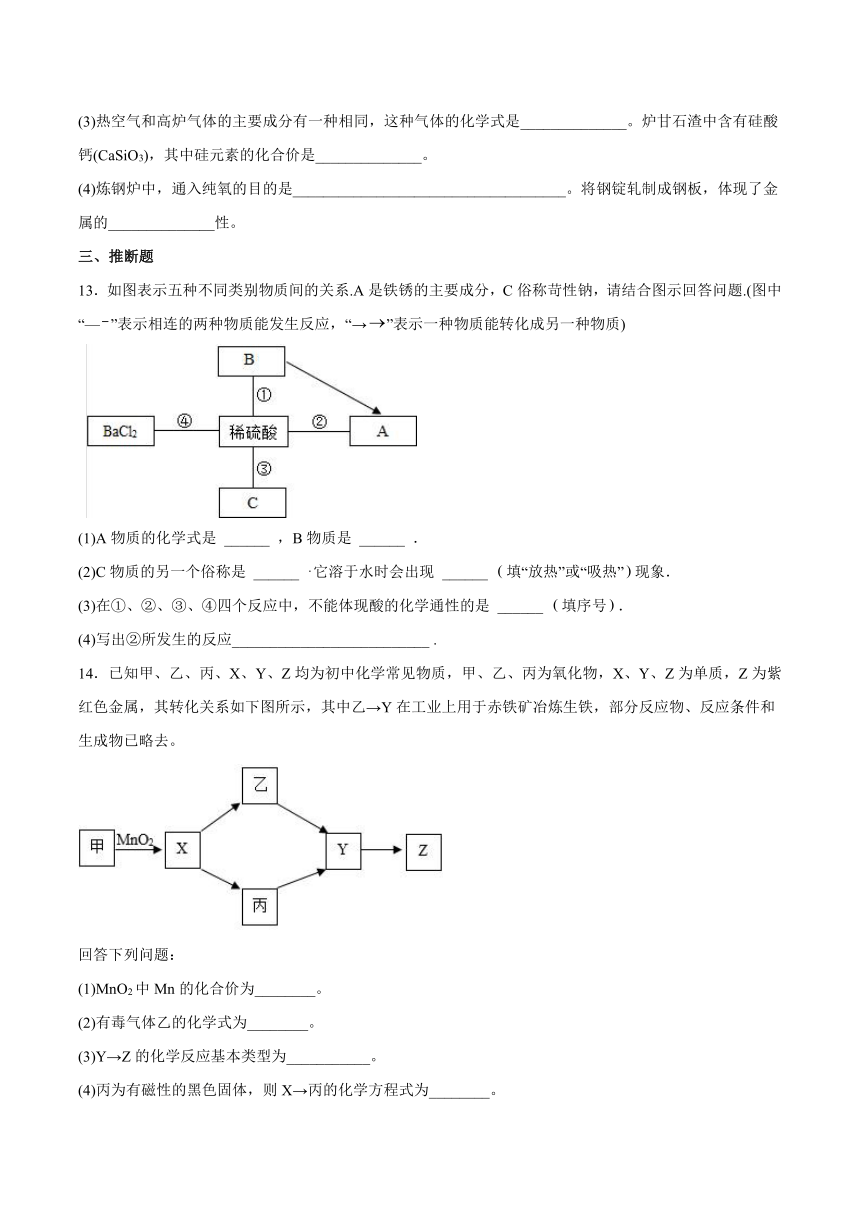
9.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的CO,目的是排尽装置内的空气,防止发生爆炸
C.NaOH溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入CO至固体冷却为止
10.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
11.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
二、简答题
12.工业上炼铁、炼钢和轧制钢材的主要流程如图所示。
已知生铁的含碳量为 2%~4.3%,钢的含碳量为 0.03%~2%。
(1)反应:①Fe2O3+3CO2Fe+3CO2,
②2Fe2O3+3C4Fe+3CO2↑。
属于置换反应的是______________,用于高炉炼铁的原理是________。(均填序号)
(2)炼铁的固体原料需经过粉碎,其目的是______________________________________。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______________。炉甘石渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是______________。
(4)炼钢炉中,通入纯氧的目的是____________________________________。将钢锭轧制成钢板,体现了金属的______________性。
三、推断题
13.如图表示五种不同类别物质间的关系.A是铁锈的主要成分,C俗称苛性钠,请结合图示回答问题.(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质)
(1)A物质的化学式是 ______ ,B物质是 ______ .
(2)C物质的另一个俗称是 ______ 它溶于水时会出现 ______ 填“放热”或“吸热”现象.
(3)在①、②、③、④四个反应中,不能体现酸的化学通性的是 ______ 填序号.
(4)写出②所发生的反应__________________________ .
14.已知甲、乙、丙、X、Y、Z均为初中化学常见物质,甲、乙、丙为氧化物,X、Y、Z为单质,Z为紫红色金属,其转化关系如下图所示,其中乙→Y在工业上用于赤铁矿冶炼生铁,部分反应物、反应条件和生成物已略去。
回答下列问题:
(1)MnO2中Mn的化合价为________。
(2)有毒气体乙的化学式为________。
(3)Y→Z的化学反应基本类型为___________。
(4)丙为有磁性的黑色固体,则X→丙的化学方程式为________。
15.A~E分别是初中化学中常见的物质,它们之间的转化关系如下图所示,“一”表示物质之间能发生反应,A、B、D都是黑色固体,C、E是空气中的成分,A、E是单质,A和B反应有红色固体生成,A和D反应有铁生成。请回答下列问题:
(1)写出物质B的化学式:__________;
(2)写出物质E的一种用途:_________;
(3)A和C反应的基本反应类型是__________;
(4)写出A和D之间发生反应的化学方程式:_________。
四、实验题
16.实验创新可以使现象更明显,操作更简便。Y型管的使用能增强实验的对比性,增添实验的趣味性。某化学兴趣小组同学利用Y型管设计了以下两个实验,请回答下列问题。
(1)实验1中:一段时间后,能观察到的现象为________。
(2)实验2中:
①一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据________现象,可得出结论:Zn的金属活动性比Cu强。
②写出Zn与稀硫酸反应的化学方程式________。
17.初步学习运用简单的实验装置和操作方法来制取某些气体,是初中学生的化学实验技能应达到的基本要求。现提供部分可用于实验室制取气体的装置如下图所示。
(1)仪器标号①的名称_______。
(2)可用A装置制取气体的化学方程式为_________。
(3)从操作简易的角度来讲,B装置也可用于氢气、氧气和二氧化碳等气体的制取。
①制取氧气的药品为_________,化学方程式为_________。
②制取CO2的药品是________证明二氧化碳充满集气瓶的方法是_________。
③如图为等质量的铁、镁、锌三种金属与足量稀盐酸反应过程中的关系示意图。图中a、b、c代表的三种金属化学式依次为________。根据图像选择其中可用于制取氢气的金属并说明原因:________。
五、计算题
18.向盛有20.0 g稀硫酸的烧杯中倒入5.0 g黄铜(铜锌合金)样品粉末,恰好完全反应,称得未溶物质量为3.7 g。完成下列计算:
(1)该黄铜样品中含Zn的质量为________g。
(2)所用稀硫酸中溶质的质量分数为________。
(3)反应后所得溶液中溶质质量分数为________(结果保留一位小数)。
19.小王同学想测定某Cu—Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为_________g。
(2)计算合金中铜的质量分数________。
20.为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
参考答案:
1.A 2.B 3.C 4.D 5.D 6.B 7.D 8.B 9.C 10.C 11.B
12. ② ① 增大接触面积,使其充分反应 N2 +4 和碳反应,降低生铁中的含碳量 延展
13. Fe2O3 Fe 火碱/烧碱 放热 ④ Fe2O3 + 3H2SO4=Fe2(SO4)3 +3H2O.
14. +4 CO 置换反应
15. CuO 医疗急救等 化合反应
16. 湿润的紫色石蕊滤纸条变红色,气球鼓起 锌片表面有气泡生成,倾斜前铜片无明显现象
17. 酒精灯 过氧化氢和二氧化锰 石灰石或大理石和盐酸 将燃着的木条放到集气瓶口,若木条熄灭,说明已经收集满 镁、铁、锌 制取氢气应选用锌,因为金属镁活动性强,与酸反应速率太快,不易收集氢气,而铁金属活动性不强,与酸反应速率慢
18.(1)1.3
(2)设稀硫酸中硫酸的质量分别为x、生成硫酸锌的质量为y,生成氢气质量为z。
解得:x=1.96g;
,解得:y=3.22g;
解得:z=0.04g;
稀硫酸中硫酸的质量分数=×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%;
(3)所得溶液中硫酸锌的质量分数=×100%≈15.1%
答:反应后所得溶液中硫酸锌的质量分数为15.1%。
19.(1)0.1;(2)75%
20.(1)0.15;(2)93.3%;(3);(4)1.225g
一、单选题
1.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
2.工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理如下:
①4FeS2+11O22Fe2O3+8SO2 ②2SO2+O22SO3
③SO3+H2O=H2SO4 ④ Fe2O3+3CO2Fe+3CO2
下列说法不正确的是
A.反应①②④均是在高温条件下进行的
B.只有①②发生的是氧化反应
C.反应②③属于化合反应
D.反应①④不属于四种基本反应类型中的任何一种
3.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
4.下列方法中,能达到目的是
选项 物质(括号内为杂质) 除去杂质的方法
A CuSO4溶液(H2SO4) 加足量铜粉,过滤
B CaO(CaCO3) 加足量水溶解、过滤
C CO2(CO) 点燃
D FeC12溶液(CuCl2) 加入过量铁粉,过滤
A.A B.B C.C D.D
5.铝是一种应用越来越广泛的金属。下列有关铝的描述正确的是
A.铝是地壳中含量最高的元素
B.单质铝的化合价常表现为+3价
C.铁比铝容易生锈,故铁的化学性质比铝活泼
D.镁和铝的金属活动性可通过等浓度的稀盐酸来判断
6.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
7.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
8.把一枚无锈铁钉放在硫酸铜溶液中,一段时间后,可出现的是
A.溶液蓝色变浅直至无色 B.铁钉表面析出红色物质
C.产生大量气泡 D.溶液质量增加
9.钢铁厂会利用焦炭产生的还原性气体来炼铁,某同学用此原理按如图装置进行实验,下列说法不正确的是( )
A.该实验还需要增加尾气处理装置
B.加热前应先通入一段时间的CO,目的是排尽装置内的空气,防止发生爆炸
C.NaOH溶液的作用是检验反应后的产物
D.反应结束后,应先停止加热,继续通入CO至固体冷却为止
10.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
11.如图是探究铁器锈蚀条件的装置。调节L端与R端的液面高度使之相同,塞紧橡皮塞,一周后观察。下列说法错误的是
A.a管中在靠近水面上方且近水面处铁钉上有明显的锈迹
B.L端液面低于R端
C.a管中铁钉明显生锈,b管中铁钉几乎不生锈
D.若将a管中的水改为海水则铁钉生锈更严重
二、简答题
12.工业上炼铁、炼钢和轧制钢材的主要流程如图所示。
已知生铁的含碳量为 2%~4.3%,钢的含碳量为 0.03%~2%。
(1)反应:①Fe2O3+3CO2Fe+3CO2,
②2Fe2O3+3C4Fe+3CO2↑。
属于置换反应的是______________,用于高炉炼铁的原理是________。(均填序号)
(2)炼铁的固体原料需经过粉碎,其目的是______________________________________。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______________。炉甘石渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是______________。
(4)炼钢炉中,通入纯氧的目的是____________________________________。将钢锭轧制成钢板,体现了金属的______________性。
三、推断题
13.如图表示五种不同类别物质间的关系.A是铁锈的主要成分,C俗称苛性钠,请结合图示回答问题.(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质)
(1)A物质的化学式是 ______ ,B物质是 ______ .
(2)C物质的另一个俗称是 ______ 它溶于水时会出现 ______ 填“放热”或“吸热”现象.
(3)在①、②、③、④四个反应中,不能体现酸的化学通性的是 ______ 填序号.
(4)写出②所发生的反应__________________________ .
14.已知甲、乙、丙、X、Y、Z均为初中化学常见物质,甲、乙、丙为氧化物,X、Y、Z为单质,Z为紫红色金属,其转化关系如下图所示,其中乙→Y在工业上用于赤铁矿冶炼生铁,部分反应物、反应条件和生成物已略去。
回答下列问题:
(1)MnO2中Mn的化合价为________。
(2)有毒气体乙的化学式为________。
(3)Y→Z的化学反应基本类型为___________。
(4)丙为有磁性的黑色固体,则X→丙的化学方程式为________。
15.A~E分别是初中化学中常见的物质,它们之间的转化关系如下图所示,“一”表示物质之间能发生反应,A、B、D都是黑色固体,C、E是空气中的成分,A、E是单质,A和B反应有红色固体生成,A和D反应有铁生成。请回答下列问题:
(1)写出物质B的化学式:__________;
(2)写出物质E的一种用途:_________;
(3)A和C反应的基本反应类型是__________;
(4)写出A和D之间发生反应的化学方程式:_________。
四、实验题
16.实验创新可以使现象更明显,操作更简便。Y型管的使用能增强实验的对比性,增添实验的趣味性。某化学兴趣小组同学利用Y型管设计了以下两个实验,请回答下列问题。
(1)实验1中:一段时间后,能观察到的现象为________。
(2)实验2中:
①一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据________现象,可得出结论:Zn的金属活动性比Cu强。
②写出Zn与稀硫酸反应的化学方程式________。
17.初步学习运用简单的实验装置和操作方法来制取某些气体,是初中学生的化学实验技能应达到的基本要求。现提供部分可用于实验室制取气体的装置如下图所示。
(1)仪器标号①的名称_______。
(2)可用A装置制取气体的化学方程式为_________。
(3)从操作简易的角度来讲,B装置也可用于氢气、氧气和二氧化碳等气体的制取。
①制取氧气的药品为_________,化学方程式为_________。
②制取CO2的药品是________证明二氧化碳充满集气瓶的方法是_________。
③如图为等质量的铁、镁、锌三种金属与足量稀盐酸反应过程中的关系示意图。图中a、b、c代表的三种金属化学式依次为________。根据图像选择其中可用于制取氢气的金属并说明原因:________。
五、计算题
18.向盛有20.0 g稀硫酸的烧杯中倒入5.0 g黄铜(铜锌合金)样品粉末,恰好完全反应,称得未溶物质量为3.7 g。完成下列计算:
(1)该黄铜样品中含Zn的质量为________g。
(2)所用稀硫酸中溶质的质量分数为________。
(3)反应后所得溶液中溶质质量分数为________(结果保留一位小数)。
19.小王同学想测定某Cu—Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。请完成下列分析及计算:
(1)反应生成氢气的总质量为_________g。
(2)计算合金中铜的质量分数________。
20.为了分析生铁中铁的含量,某学习小组进行了如下测定:称取6g生铁粉,然后将100g稀硫酸平均分五次加入,测得加入稀硫酸质虽与放出氢气的质量如下表。(说明:生铁中的杂质不溶于水,也不与硫酸、硫酸铜溶液反应)
第一次 第二次 第三次 第四次 第五次
加入稀硫酸的质量/g 20 20 20 20 20
产生氢气的累计质量/g 0.05 0.10 m 0.20 0.20
(1)上表中m的值为__________。
(2)计算生铁中含铁的质量分数是多少(写出计算过程, 结果精确到0.1%)
(3)请根据数据和计算结果,在右图坐标中画出对应的曲线图。
(4)若另取同种生铁粉6g进行下图所示的实验,由图中数据可求得,100g混合溶液中所含H2SO4的质量为__________。
参考答案:
1.A 2.B 3.C 4.D 5.D 6.B 7.D 8.B 9.C 10.C 11.B
12. ② ① 增大接触面积,使其充分反应 N2 +4 和碳反应,降低生铁中的含碳量 延展
13. Fe2O3 Fe 火碱/烧碱 放热 ④ Fe2O3 + 3H2SO4=Fe2(SO4)3 +3H2O.
14. +4 CO 置换反应
15. CuO 医疗急救等 化合反应
16. 湿润的紫色石蕊滤纸条变红色,气球鼓起 锌片表面有气泡生成,倾斜前铜片无明显现象
17. 酒精灯 过氧化氢和二氧化锰 石灰石或大理石和盐酸 将燃着的木条放到集气瓶口,若木条熄灭,说明已经收集满 镁、铁、锌 制取氢气应选用锌,因为金属镁活动性强,与酸反应速率太快,不易收集氢气,而铁金属活动性不强,与酸反应速率慢
18.(1)1.3
(2)设稀硫酸中硫酸的质量分别为x、生成硫酸锌的质量为y,生成氢气质量为z。
解得:x=1.96g;
,解得:y=3.22g;
解得:z=0.04g;
稀硫酸中硫酸的质量分数=×100%=9.8%
答:稀硫酸中溶质的质量分数为9.8%;
(3)所得溶液中硫酸锌的质量分数=×100%≈15.1%
答:反应后所得溶液中硫酸锌的质量分数为15.1%。
19.(1)0.1;(2)75%
20.(1)0.15;(2)93.3%;(3);(4)1.225g
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
