第七单元 常见的酸和碱测试题—2021-2022学年九年级化学沪鲁教版下册(word版有答案)
文档属性
| 名称 | 第七单元 常见的酸和碱测试题—2021-2022学年九年级化学沪鲁教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 109.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 15:49:35 | ||
图片预览


文档简介
第七单元《常见的酸和碱》测试题
一、单选题
1.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
2.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
3.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
4.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
5.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
6.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
7.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
8.下列物质属于盐的是
A.NaOH B.CaO C.Cu D.CaCO3
9.河道两旁有甲、乙两厂,它们排放的工业废水中共含有H+、Na+、Ba2+、Cl-、SO、CO六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲厂废水中的离子是( )
A.H+、Na+、Ba2+ B.H+、Ba2+、Cl- C.Na+、SO、CO D.H+、SO、CO
10.下列实验现象叙述正确的是( )
A.硫粉在空气中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
B.氢气通入灼热的氧化铜:黑色固体变成紫红色,试管口有无色液滴生成
C.铁粉加入稀硫酸:银白色固体表面有气泡产生,固体减少,放热,溶液由无色变为浅绿色
D.水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
二、简答题
11.生活用品中蕴含着丰富的化学知识。
用品 管道通 石灰乳
有效成分 NaOH Ca(OH)2
(1)管道通在使用时禁止与皮肤接触,其原因是_____。
(2)使用石灰乳抹墙,一段时间后变硬的原因_____(用化学方程式回答)。
12.“某饮用天然水”的广告中有如下画面(如图):
【情景描述】两个玻璃杯中分别盛有两种水样,其中一个盛“某饮用天然水”,另一个盛其他的水。水样中分别浸有试纸后,一杯的试纸呈现淡橘黄色(弱酸性),另一杯的试纸呈现淡绿色(弱碱性),广告提示大家:弱碱性的水对人体健康有利。请你回答:
(1)常温时,“某饮用天然水”的约为_____(填序号)。
A.4 B. C. D.14
(2)小茜同学看了图示中测定水样的方法后指出:这种测定方法是错误的,请你说出错在哪里?_______。用试纸测定溶液的应该______。
(3)请你判断:从(1)中选出的结果能用一般的试纸测出吗?______(填“能”或“不能”)。
三、推断题
13.A-E是初中化学5种常见的化合物,A、B、C的物质类别不同,“一”表示物质间相互反应,“→”表示一种物质生成另一种物质。A是生产玻璃、洗涤剂和日用化学工业的原料,D是常见的氧化物。
(1)A的化学式是___________,E的物质类别是_____________。
(2)B与C反应的微观实质是______________。
(3)A与B发生反应的化学方程式是__________(合理即可),实验现象是____________。
14.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为:A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物):
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
(1)写出溶液A中溶质的化学式:A_____。
(2)写出溶液A与B反应的化学方程式:_____。
(3)写出溶液C和D反应的化学方程式:_____。
四、实验题
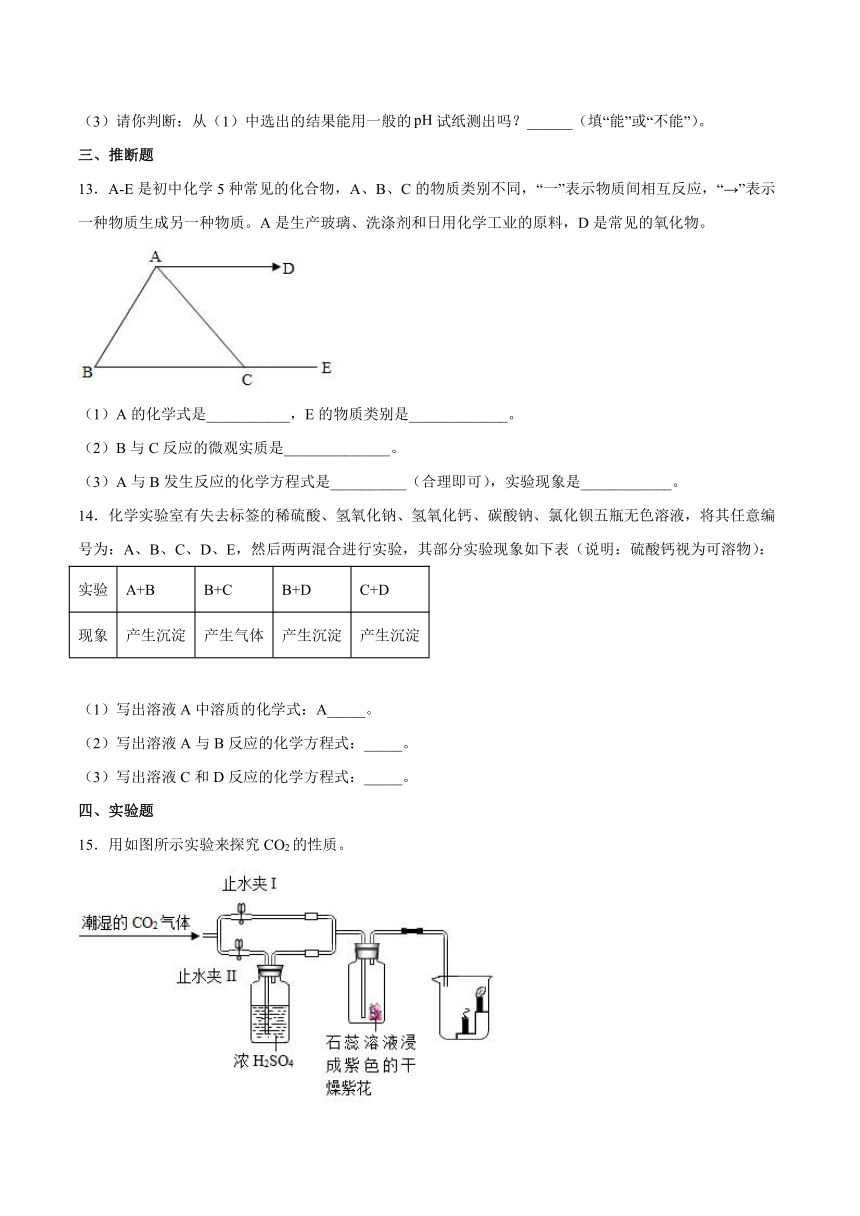
15.用如图所示实验来探究CO2的性质。
资料:浓硫酸可以做某些气体的干燥剂,如二氧化碳。
(1)用来验证CO2能否与水反应,实验时的步骤是:
a关闭止水夹Ⅰ,打开止水夹Ⅱ。
b关闭止水夹Ⅱ,打开止水夹Ⅰ。
实验的正确步骤顺序是_____(填序号)。在正确操作时,看到瓶内的现象是_____,得出的结论用方程式表示为_____。
(2)关闭止水夹Ⅰ,打开止水夹Ⅱ,持续通入CO2,可观察到烧杯中出现的现象是_____,因此二氧化碳可用来灭火,利用的性质是_____、_____。
16.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是__(填“吸热”或“放热”或“无热量变化”)反应。
(2)在A处溶液中加入石蕊,溶液呈__色。
(3)B处溶液的溶质是__(填化学式)。
(4)B到C的过程中溶液的pH逐渐__(填“增大”或“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为__,化学方程式为__。
17.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质 假设二:该溶液部分变质 假设三:该溶液全部变质
请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象____,并写出相关反应的化学方程式____。
五、计算题
18.为测定某工厂废水中硫酸的质量分数,小明进行下列实验:取49g废水样品于烧杯中,再逐滴加入溶质质量分数为10%的氢氧化钠溶液,并不断搅拌,实验过程中溶液pH的变化图像如图所示。
试计算:
(1)恰好完全反应时,加入氢氧化钠溶质的质量为____________g。
(2)此废水中硫酸的质量分数。_______
19.氯化钠不仅是必不可少的生活用品,也是重要的化工原料。
(1)若要配制1000g 0.9%的生理盐水,需要氯化钠_______g,需要水_______g。
(2)若从1000g 0.9%的生理盐水中取出500g溶液,则取出的溶液的溶质质量分数为______。
参考答案:
1.A 2.A 3.C 4.C 5.B 6.B 7.A 8.D 9.B 10.B
11. 氢氧化钠具有强烈的腐蚀性 Ca(OH)2+CO2═CaCO3↓+H2O
12. C 直接将试纸放入玻璃杯的水样中是错误的 在白瓷板或玻璃片上放一小片试纸,用玻璃棒蘸取水样滴到试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出水样的 不能
13. Na2CO3 氧化物/盐/酸(B为酸时)/碱(B为碱时) 氢离子和氢氧根子反应生成水分子(合理即可) /(合理即可) 有气泡产生/有白色沉淀生成(与化学方程式对应)
14. Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH H2SO4+BaCl2=BaSO4↓+2HCl
15. a、b a操作中紫花不变色,b操作中紫花变红色 CO2+H2O=H2CO3 蜡烛由下而上依次熄灭 密度比空气大 不能燃烧,不支持燃烧
16. 放热 蓝 NaCl 减小 有气泡产生 CaCO3+2HCl═CaCl2+H2O+CO2↑
17. 取少量溶液样品,向溶液的样品中滴加足量氯化钙溶液,若观察到有沉淀出现可判断氢氧化钠已经变质;在反应后的溶液中滴入酚酞,若出现变红则可判断部分变质,因此既出现沉淀又有溶液变红,则溶液部分变质 CaCl2+Na2CO3=CaCO3↓+2NaCl
18. 4 10%
19.(1)9;(2)991;(3)0.9%
一、单选题
1.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
2.下列有关生活中的化学说法正确的是( )
A.煤、石油、天然气等化石燃料是不可再生资源
B.室内发生火灾,立即打开门窗
C.生活中用过滤的方法降低水的硬度
D.农业上用氢氧化钠改良酸性土壤
3.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
4.下列有关测定氢氧化钠溶液pH的实验操作或描述,你认为正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的
5.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
6.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
7.中和反应在生活中有广泛应用。下列应用不属于中和反应的是
A.用盐酸除铁锈 B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤 D.用硫酸处理印染厂含碱废水
8.下列物质属于盐的是
A.NaOH B.CaO C.Cu D.CaCO3
9.河道两旁有甲、乙两厂,它们排放的工业废水中共含有H+、Na+、Ba2+、Cl-、SO、CO六种离子。两厂废水中各含三种离子,其中甲厂的废水明显呈酸性,甲厂废水中的离子是( )
A.H+、Na+、Ba2+ B.H+、Ba2+、Cl- C.Na+、SO、CO D.H+、SO、CO
10.下列实验现象叙述正确的是( )
A.硫粉在空气中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
B.氢气通入灼热的氧化铜:黑色固体变成紫红色,试管口有无色液滴生成
C.铁粉加入稀硫酸:银白色固体表面有气泡产生,固体减少,放热,溶液由无色变为浅绿色
D.水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
二、简答题
11.生活用品中蕴含着丰富的化学知识。
用品 管道通 石灰乳
有效成分 NaOH Ca(OH)2
(1)管道通在使用时禁止与皮肤接触,其原因是_____。
(2)使用石灰乳抹墙,一段时间后变硬的原因_____(用化学方程式回答)。
12.“某饮用天然水”的广告中有如下画面(如图):
【情景描述】两个玻璃杯中分别盛有两种水样,其中一个盛“某饮用天然水”,另一个盛其他的水。水样中分别浸有试纸后,一杯的试纸呈现淡橘黄色(弱酸性),另一杯的试纸呈现淡绿色(弱碱性),广告提示大家:弱碱性的水对人体健康有利。请你回答:
(1)常温时,“某饮用天然水”的约为_____(填序号)。
A.4 B. C. D.14
(2)小茜同学看了图示中测定水样的方法后指出:这种测定方法是错误的,请你说出错在哪里?_______。用试纸测定溶液的应该______。
(3)请你判断:从(1)中选出的结果能用一般的试纸测出吗?______(填“能”或“不能”)。
三、推断题
13.A-E是初中化学5种常见的化合物,A、B、C的物质类别不同,“一”表示物质间相互反应,“→”表示一种物质生成另一种物质。A是生产玻璃、洗涤剂和日用化学工业的原料,D是常见的氧化物。
(1)A的化学式是___________,E的物质类别是_____________。
(2)B与C反应的微观实质是______________。
(3)A与B发生反应的化学方程式是__________(合理即可),实验现象是____________。
14.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为:A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物):
实验 A+B B+C B+D C+D
现象 产生沉淀 产生气体 产生沉淀 产生沉淀
(1)写出溶液A中溶质的化学式:A_____。
(2)写出溶液A与B反应的化学方程式:_____。
(3)写出溶液C和D反应的化学方程式:_____。
四、实验题
15.用如图所示实验来探究CO2的性质。
资料:浓硫酸可以做某些气体的干燥剂,如二氧化碳。
(1)用来验证CO2能否与水反应,实验时的步骤是:
a关闭止水夹Ⅰ,打开止水夹Ⅱ。
b关闭止水夹Ⅱ,打开止水夹Ⅰ。
实验的正确步骤顺序是_____(填序号)。在正确操作时,看到瓶内的现象是_____,得出的结论用方程式表示为_____。
(2)关闭止水夹Ⅰ,打开止水夹Ⅱ,持续通入CO2,可观察到烧杯中出现的现象是_____,因此二氧化碳可用来灭火,利用的性质是_____、_____。
16.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是__(填“吸热”或“放热”或“无热量变化”)反应。
(2)在A处溶液中加入石蕊,溶液呈__色。
(3)B处溶液的溶质是__(填化学式)。
(4)B到C的过程中溶液的pH逐渐__(填“增大”或“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为__,化学方程式为__。
17.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,同学们提出了如下假设:
假设一:该溶液没有变质 假设二:该溶液部分变质 假设三:该溶液全部变质
请设计实验方案,分别验证以上假设,简要叙述实验步骤和现象____,并写出相关反应的化学方程式____。
五、计算题
18.为测定某工厂废水中硫酸的质量分数,小明进行下列实验:取49g废水样品于烧杯中,再逐滴加入溶质质量分数为10%的氢氧化钠溶液,并不断搅拌,实验过程中溶液pH的变化图像如图所示。
试计算:
(1)恰好完全反应时,加入氢氧化钠溶质的质量为____________g。
(2)此废水中硫酸的质量分数。_______
19.氯化钠不仅是必不可少的生活用品,也是重要的化工原料。
(1)若要配制1000g 0.9%的生理盐水,需要氯化钠_______g,需要水_______g。
(2)若从1000g 0.9%的生理盐水中取出500g溶液,则取出的溶液的溶质质量分数为______。
参考答案:
1.A 2.A 3.C 4.C 5.B 6.B 7.A 8.D 9.B 10.B
11. 氢氧化钠具有强烈的腐蚀性 Ca(OH)2+CO2═CaCO3↓+H2O
12. C 直接将试纸放入玻璃杯的水样中是错误的 在白瓷板或玻璃片上放一小片试纸,用玻璃棒蘸取水样滴到试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出水样的 不能
13. Na2CO3 氧化物/盐/酸(B为酸时)/碱(B为碱时) 氢离子和氢氧根子反应生成水分子(合理即可) /(合理即可) 有气泡产生/有白色沉淀生成(与化学方程式对应)
14. Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH H2SO4+BaCl2=BaSO4↓+2HCl
15. a、b a操作中紫花不变色,b操作中紫花变红色 CO2+H2O=H2CO3 蜡烛由下而上依次熄灭 密度比空气大 不能燃烧,不支持燃烧
16. 放热 蓝 NaCl 减小 有气泡产生 CaCO3+2HCl═CaCl2+H2O+CO2↑
17. 取少量溶液样品,向溶液的样品中滴加足量氯化钙溶液,若观察到有沉淀出现可判断氢氧化钠已经变质;在反应后的溶液中滴入酚酞,若出现变红则可判断部分变质,因此既出现沉淀又有溶液变红,则溶液部分变质 CaCl2+Na2CO3=CaCO3↓+2NaCl
18. 4 10%
19.(1)9;(2)991;(3)0.9%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
