第八单元海水中的化学测试题—2021-2022学年九年级化学鲁教版下册(word版有答案)
文档属性
| 名称 | 第八单元海水中的化学测试题—2021-2022学年九年级化学鲁教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 138.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 15:54:53 | ||
图片预览



文档简介
第八单元《海水中的化学》测试题
一、单选题
1.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
2.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
3.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
4.为了发展低碳经济,科学家们提出“绿色自由”构想技术流程如下图所示:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水(部分条件及物质未标出)。下列说法正确的是( )
A.可循环利用的物质是K2CO3,其中碳元素的化合价为-4
B.碳酸钾溶液所起的作用是富集空气中的CO2,为合成甲醇提供CO2
C.通入高温水蒸气的作用是加快CO2的逸出,以便及时为合成塔提供CO2
D.合成塔中反应的化学方程式为:CO2+3H2═CH3OH+H2O
5.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
6.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
7.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
8.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是
A.溶质为10 g B.溶剂为100 g
C.溶液为110 g D.硝酸钾的溶解度为10 g
9.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
10.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
11.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
12.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
13.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2Na2CO3 B.KNO3HCl CaCl2
C.H2SO4 FeCl3NaNO3 D.NaOH HNO3NH4NO3
二、简答题
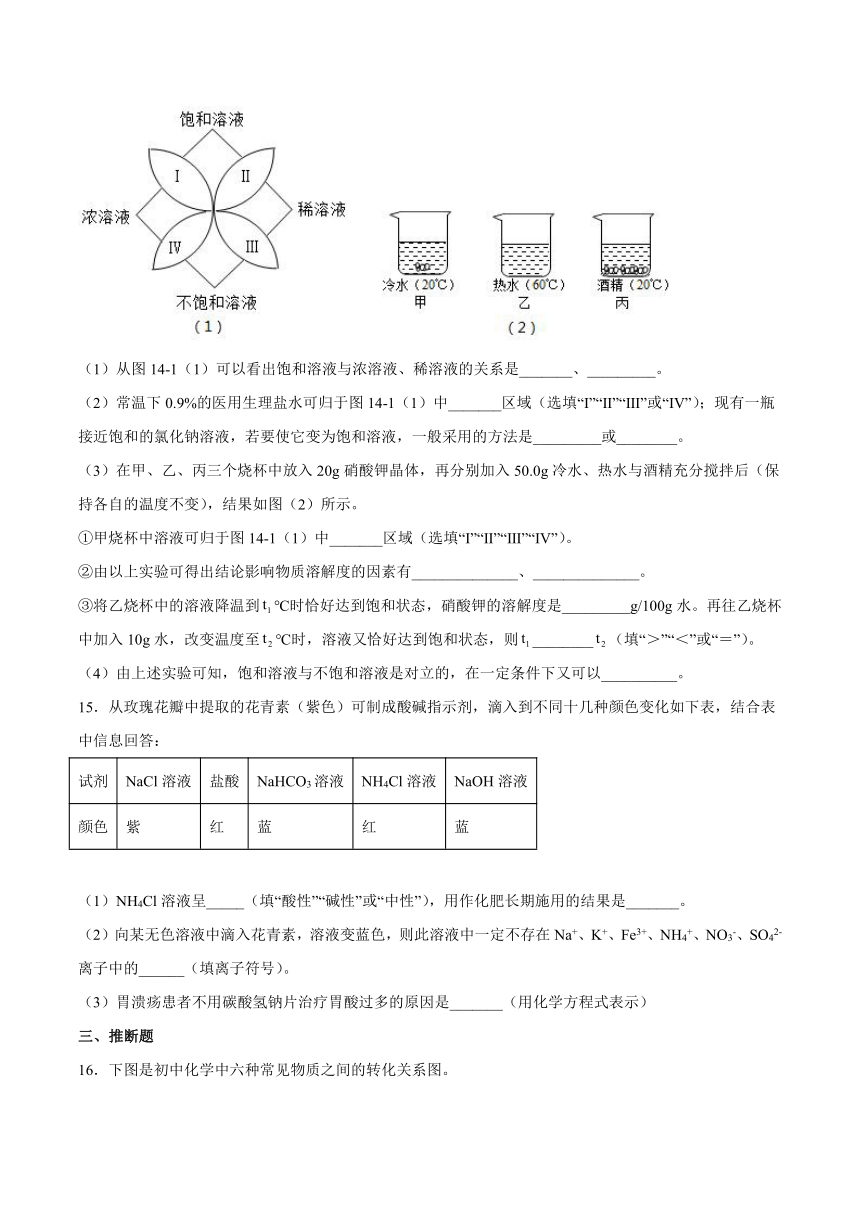
14.化学中有许多概念是对立的又是统一的。图(1)反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
(1)从图14-1(1)可以看出饱和溶液与浓溶液、稀溶液的关系是_______、_________。
(2)常温下0.9%的医用生理盐水可归于图14-1(1)中_______区域(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是_________或________。
(3)在甲、乙、丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精充分搅拌后(保持各自的温度不变),结果如图(2)所示。
①甲烧杯中溶液可归于图14-1(1)中_______区域(选填“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②由以上实验可得出结论影响物质溶解度的因素有______________、______________。
③将乙烧杯中的溶液降温到℃时恰好达到饱和状态,硝酸钾的溶解度是_________g/100g水。再往乙烧杯中加入10g水,改变温度至℃时,溶液又恰好达到饱和状态,则________(填“>”“<”或“=”)。
(4)由上述实验可知,饱和溶液与不饱和溶液是对立的,在一定条件下又可以__________。
15.从玫瑰花瓣中提取的花青素(紫色)可制成酸碱指示剂,滴入到不同十几种颜色变化如下表,结合表中信息回答:
试剂 NaCl溶液 盐酸 NaHCO3溶液 NH4Cl溶液 NaOH溶液
颜色 紫 红 蓝 红 蓝
(1)NH4Cl溶液呈_____(填“酸性”“碱性”或“中性”),用作化肥长期施用的结果是_______。
(2)向某无色溶液中滴入花青素,溶液变蓝色,则此溶液中一定不存在Na+、K+、Fe3+、NH4+、NO3-、SO42-离子中的______(填离子符号)。
(3)胃溃疡患者不用碳酸氢钠片治疗胃酸过多的原因是_______(用化学方程式表示)
三、推断题
16.下图是初中化学中六种常见物质之间的转化关系图。
已知A、D、F均为单质,其中D、F为金属单质,D的合金是使用最多的金属材料;B为氧化物,C是一种常见的酸,E(相对分子质量为160)的溶液呈蓝色。试回答下列问题:(框图中的反应条件和某些生成物已略去)
(1)请写出下列物质的化学式:B_____,D_____。
(2)上述反应中,不属于置换反应的是 _______(填序号)。
(3)请写出反应④的化学方程式:___________________。
(4)请写出E在生产生活中的一种用途_______________。
17.某固体粉末可能含有氯化镁、硫酸钠、硝酸钠、硫酸铜和碳酸钙中的一种或几种,为确定其成分,某化学实验小组同学进行了如下实验。
回答下列问题:
(1)白色沉淀C是_________(填化学式)。
(2)反应①的化学方程式为_____________。
(3)原固体粉末中一定含有的物质是_____(填化学式),一定不含的物质是_________(填化学式)。
四、实验题
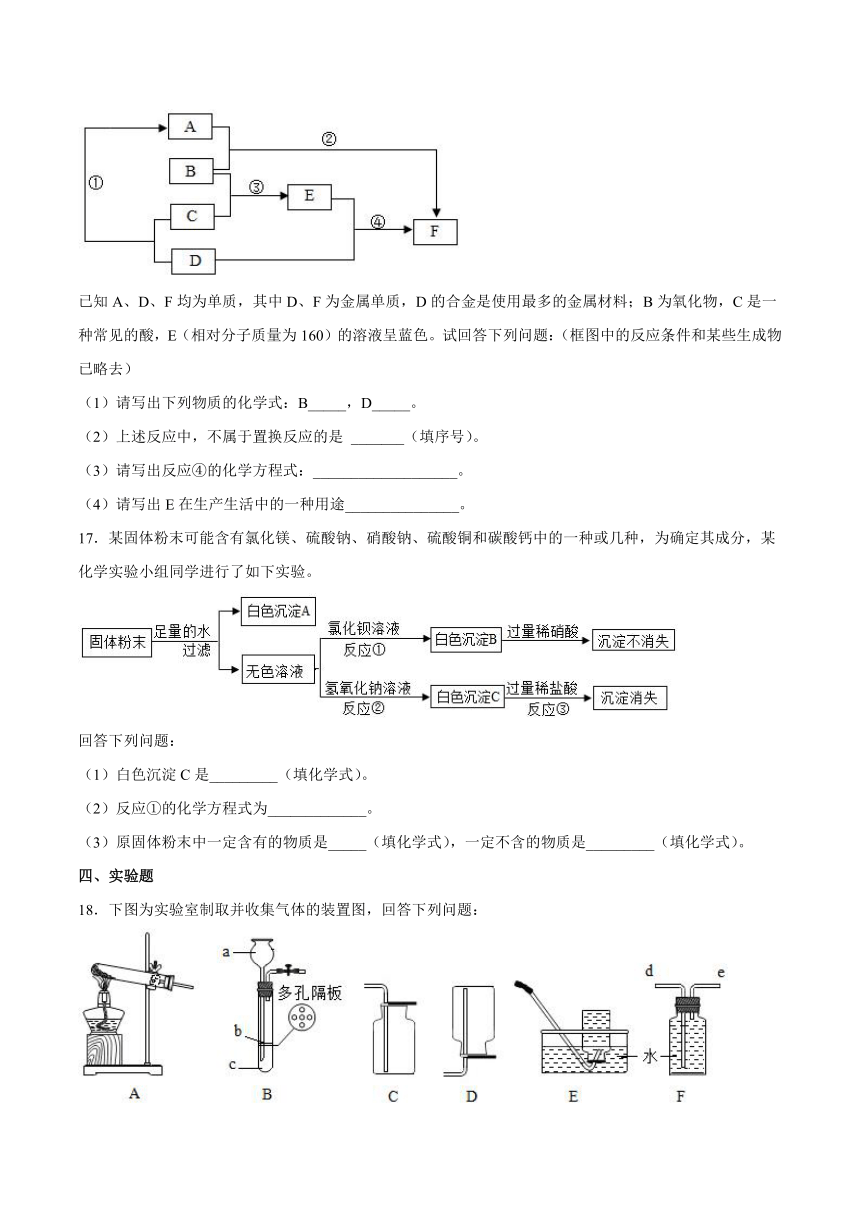
18.下图为实验室制取并收集气体的装置图,回答下列问题:
(1)a仪器的名称是______。
(2)实验室用高锰酸钾制取并收集干燥的氧气应选用的装置组合是______(填序号),反应的化学方程式是______。
(3)若用F装置收集并测量氧气的体积,应在______(填“d”或“e”)段连接量筒。
(4)实验室制取二氧化碳的化学方程式是______,用B装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在______(填“b”或“c”)处。
(5)某化学兴趣小组利用下图装置进行燃烧条件及固体的溶解度与温度关系的探究(装置气密性良好;实验前弹簧夹K1、K2、K3都处于关闭状态)。
①打开弹簧夹K1、K2,注入足量过氧化氢溶液,A中发生反应的化学方程式为______。
②打开弹簧夹K3,关闭弹簧夹K2,接下来观察到B中先、后产生的现象为______,由此得出了燃烧需要的某个条件。
③继续观察C,试管甲中现象为______,试管乙中的溶液变浑浊,乙中产生此现象的原因是______。
19.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
20.氧化钙是一种常见的食品干燥剂,化学兴趣小组为了测定食品包装袋内的氧化钙干燥剂是否变质及其成分对其进行实验,取干燥剂样品10g加入103.2g稀盐酸,恰好完全反应,固体完全溶解后得到溶液的质量为111g。请回答下列问题:
(1)由实验数据可知氧化钙已变质,依据是___,实验中完全反应生成二氧化碳质量为___g;
(2)求样品中碳酸钙的质量分数(写出计算步骤);
(3)如果103.2g稀盐酸恰好完全反应,经测定反应后的溶液的溶质质量分数为12.5%,则10g干燥剂样品中钙元素的质量为_______g,该干燥剂样品成分是_______。
21.某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
参考答案:
1.C 2.A 3.B 4.B 5.B 6.B 7.B 8.D 9.C 10.D 11.C 12.B 13.B
14. 饱和溶液可能是浓溶液 也可能是稀溶液 Ⅲ 加入氯化钠固体至不再继续溶解 蒸发溶剂至刚好有晶体析出 Ⅰ 温度 溶剂种类 40.0 > 相互转化
15. 酸性 使土壤酸化、板结(写出其中之一即可) Fe3+、NH4+ NaHCO3+HCl=NaCl+H2O+CO2↑
16. CuO Fe ③ CuSO4+Fe=Cu+FeSO4 制农药
17. Mg(OH)2 CaCO3、Na2SO4、MgCl2 CuSO4
18. 长颈漏斗 AC d b B中液面下降至燃烧匙下方,白磷燃烧 固体消失 Ca(OH)2的溶解度随温度升高而减小
19.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
20.(1) 质量守恒定律 2.2g
(2)解:设该样品中碳酸钙的质量分数为x
x=50%
答:样品中碳酸钙的质量分数为50%。
(3) 5 氧化钙、氢氧化钙和碳酸钙
21.(1)97.1
(2)解:设原氯化钠溶液中氯化镁的质量分数为x
得x=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
一、单选题
1.下列方法能使硝酸钾固体在水中溶解度增大的是
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
2.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
3.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
4.为了发展低碳经济,科学家们提出“绿色自由”构想技术流程如下图所示:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水(部分条件及物质未标出)。下列说法正确的是( )
A.可循环利用的物质是K2CO3,其中碳元素的化合价为-4
B.碳酸钾溶液所起的作用是富集空气中的CO2,为合成甲醇提供CO2
C.通入高温水蒸气的作用是加快CO2的逸出,以便及时为合成塔提供CO2
D.合成塔中反应的化学方程式为:CO2+3H2═CH3OH+H2O
5.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
6.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
7.20℃时,硝酸钾的溶解度为31.6g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解硝酸钾31.6g
B.20℃时,100g硝酸钾饱和溶液中含硝酸钾31.6g
C.20℃时,氯化钠饱和溶液中水与硝酸钾的质量比为100∶31.6
D.20℃时,将31.6g硝酸钾溶解于100g水中,所得溶液为该温度下硝酸钾的饱和溶液
8.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是
A.溶质为10 g B.溶剂为100 g
C.溶液为110 g D.硝酸钾的溶解度为10 g
9.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
10.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
11.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
12.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
13.下列各组物质在溶液中能大量共存且形成无色溶液的是
A.NaCl BaCl2Na2CO3 B.KNO3HCl CaCl2
C.H2SO4 FeCl3NaNO3 D.NaOH HNO3NH4NO3
二、简答题
14.化学中有许多概念是对立的又是统一的。图(1)反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
(1)从图14-1(1)可以看出饱和溶液与浓溶液、稀溶液的关系是_______、_________。
(2)常温下0.9%的医用生理盐水可归于图14-1(1)中_______区域(选填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是_________或________。
(3)在甲、乙、丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精充分搅拌后(保持各自的温度不变),结果如图(2)所示。
①甲烧杯中溶液可归于图14-1(1)中_______区域(选填“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②由以上实验可得出结论影响物质溶解度的因素有______________、______________。
③将乙烧杯中的溶液降温到℃时恰好达到饱和状态,硝酸钾的溶解度是_________g/100g水。再往乙烧杯中加入10g水,改变温度至℃时,溶液又恰好达到饱和状态,则________(填“>”“<”或“=”)。
(4)由上述实验可知,饱和溶液与不饱和溶液是对立的,在一定条件下又可以__________。
15.从玫瑰花瓣中提取的花青素(紫色)可制成酸碱指示剂,滴入到不同十几种颜色变化如下表,结合表中信息回答:
试剂 NaCl溶液 盐酸 NaHCO3溶液 NH4Cl溶液 NaOH溶液
颜色 紫 红 蓝 红 蓝
(1)NH4Cl溶液呈_____(填“酸性”“碱性”或“中性”),用作化肥长期施用的结果是_______。
(2)向某无色溶液中滴入花青素,溶液变蓝色,则此溶液中一定不存在Na+、K+、Fe3+、NH4+、NO3-、SO42-离子中的______(填离子符号)。
(3)胃溃疡患者不用碳酸氢钠片治疗胃酸过多的原因是_______(用化学方程式表示)
三、推断题
16.下图是初中化学中六种常见物质之间的转化关系图。
已知A、D、F均为单质,其中D、F为金属单质,D的合金是使用最多的金属材料;B为氧化物,C是一种常见的酸,E(相对分子质量为160)的溶液呈蓝色。试回答下列问题:(框图中的反应条件和某些生成物已略去)
(1)请写出下列物质的化学式:B_____,D_____。
(2)上述反应中,不属于置换反应的是 _______(填序号)。
(3)请写出反应④的化学方程式:___________________。
(4)请写出E在生产生活中的一种用途_______________。
17.某固体粉末可能含有氯化镁、硫酸钠、硝酸钠、硫酸铜和碳酸钙中的一种或几种,为确定其成分,某化学实验小组同学进行了如下实验。
回答下列问题:
(1)白色沉淀C是_________(填化学式)。
(2)反应①的化学方程式为_____________。
(3)原固体粉末中一定含有的物质是_____(填化学式),一定不含的物质是_________(填化学式)。
四、实验题
18.下图为实验室制取并收集气体的装置图,回答下列问题:
(1)a仪器的名称是______。
(2)实验室用高锰酸钾制取并收集干燥的氧气应选用的装置组合是______(填序号),反应的化学方程式是______。
(3)若用F装置收集并测量氧气的体积,应在______(填“d”或“e”)段连接量筒。
(4)实验室制取二氧化碳的化学方程式是______,用B装置制取二氧化碳便于控制反应的发生与停止,制取时应将大理石放在______(填“b”或“c”)处。
(5)某化学兴趣小组利用下图装置进行燃烧条件及固体的溶解度与温度关系的探究(装置气密性良好;实验前弹簧夹K1、K2、K3都处于关闭状态)。
①打开弹簧夹K1、K2,注入足量过氧化氢溶液,A中发生反应的化学方程式为______。
②打开弹簧夹K3,关闭弹簧夹K2,接下来观察到B中先、后产生的现象为______,由此得出了燃烧需要的某个条件。
③继续观察C,试管甲中现象为______,试管乙中的溶液变浑浊,乙中产生此现象的原因是______。
19.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
20.氧化钙是一种常见的食品干燥剂,化学兴趣小组为了测定食品包装袋内的氧化钙干燥剂是否变质及其成分对其进行实验,取干燥剂样品10g加入103.2g稀盐酸,恰好完全反应,固体完全溶解后得到溶液的质量为111g。请回答下列问题:
(1)由实验数据可知氧化钙已变质,依据是___,实验中完全反应生成二氧化碳质量为___g;
(2)求样品中碳酸钙的质量分数(写出计算步骤);
(3)如果103.2g稀盐酸恰好完全反应,经测定反应后的溶液的溶质质量分数为12.5%,则10g干燥剂样品中钙元素的质量为_______g,该干燥剂样品成分是_______。
21.某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
参考答案:
1.C 2.A 3.B 4.B 5.B 6.B 7.B 8.D 9.C 10.D 11.C 12.B 13.B
14. 饱和溶液可能是浓溶液 也可能是稀溶液 Ⅲ 加入氯化钠固体至不再继续溶解 蒸发溶剂至刚好有晶体析出 Ⅰ 温度 溶剂种类 40.0 > 相互转化
15. 酸性 使土壤酸化、板结(写出其中之一即可) Fe3+、NH4+ NaHCO3+HCl=NaCl+H2O+CO2↑
16. CuO Fe ③ CuSO4+Fe=Cu+FeSO4 制农药
17. Mg(OH)2 CaCO3、Na2SO4、MgCl2 CuSO4
18. 长颈漏斗 AC d b B中液面下降至燃烧匙下方,白磷燃烧 固体消失 Ca(OH)2的溶解度随温度升高而减小
19.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
20.(1) 质量守恒定律 2.2g
(2)解:设该样品中碳酸钙的质量分数为x
x=50%
答:样品中碳酸钙的质量分数为50%。
(3) 5 氧化钙、氢氧化钙和碳酸钙
21.(1)97.1
(2)解:设原氯化钠溶液中氯化镁的质量分数为x
得x=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
