第11章 酸与碱 测试题—2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第11章 酸与碱 测试题—2021-2022学年九年级化学京改版(2013)下册(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 132.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 00:00:00 | ||
图片预览




文档简介
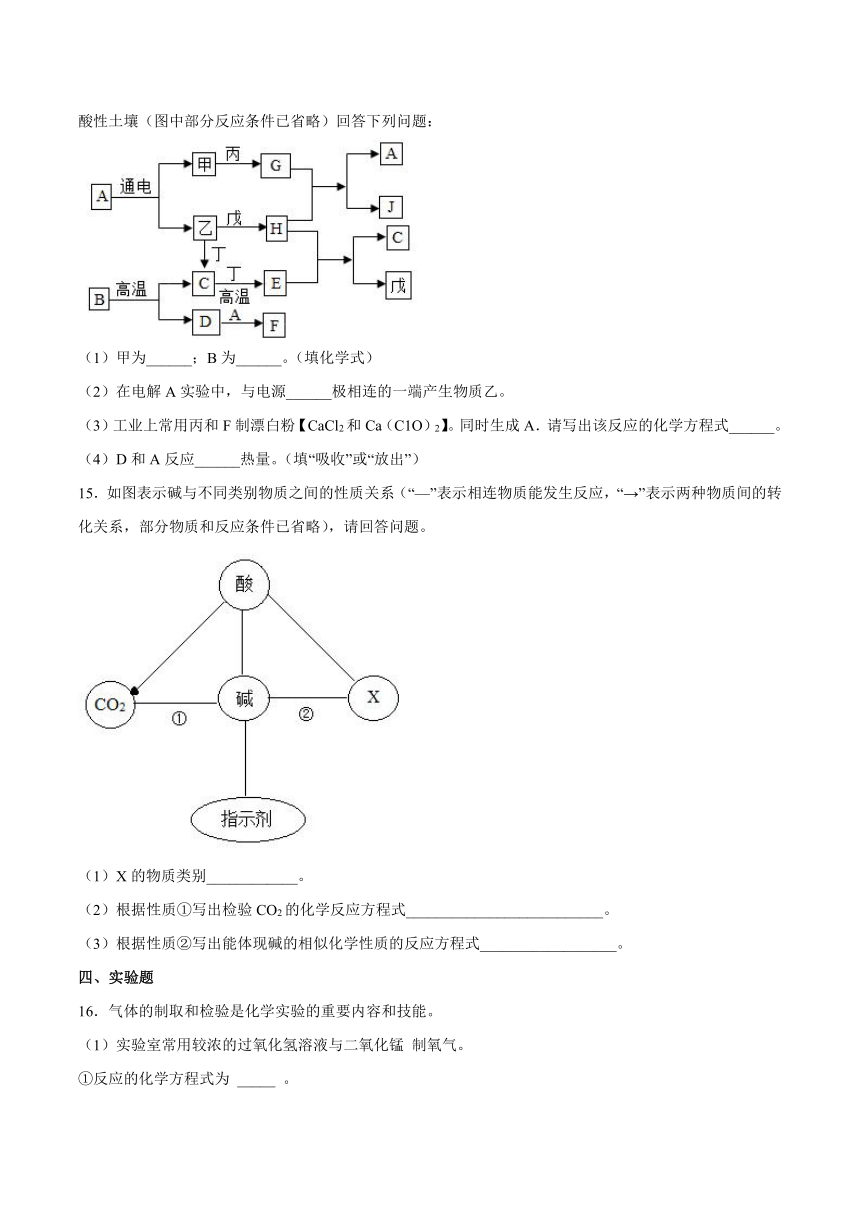
第11章《酸与碱》检测题
一、单选题
1.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去FeSO4溶液中的CuSO4 加入足量铁粉,过滤
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个干冷的烧杯
C 除去炭粉中的氧化铜 将样品溶于稀硫酸,过滤、洗涤、干燥
D 鉴别CuSO4和Na2CO3粉末 分别取适量粉末溶于水后,观察溶液颜色
A.A B.B
C.C D.D
2.下列图像分别与选项中的操作相对应,其中合理的是( )
A.向纯碱溶液中加水稀释
B.加热高锰酸钾固体制取氧气
C.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
D.向一定质量氯化钾和氯化铜的混合溶液中加入氢氧化钠溶液
3.下列实验现象叙述正确的是( )
A.硫粉在空气中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
B.氢气通入灼热的氧化铜:黑色固体变成紫红色,试管口有无色液滴生成
C.铁粉加入稀硫酸:银白色固体表面有气泡产生,固体减少,放热,溶液由无色变为浅绿色
D.水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
4.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
5.常温下,下列说法错误的是
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱
D.pH>10的土壤不适于种植农作物,因为碱性太强
6.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
7.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
8.类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素,所以含不同种元素的物质一定是化合物
B.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应
C.含碳元素的物质燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素
D.同种元素的原子所含质子数相同,含有相同质子数的微粒一定属于同种元素
9.实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化。测定结果如图所示,下列说法不正确的是
A.反应过程中有热量放出 B.30 s时,溶液中溶质为HCl和NaCl
C.该实验是将稀盐酸滴入稀NaOH溶液 D.从20 s到40 s,溶液的温度升高,pH增大
10.醋酸(CH3COOH是食醋的成分之一,其水溶液中存在H+和CH3COO-。下列说法正确的是
A.醋酸属于氧化物
B.醋酸不能用于除铁锈
C.醋酸能与镁反应产生氢气
D.醋酸中碳元素的质量分数最大
11.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
二、简答题
12.酸、碱与指示剂作用
实验现象与结果:(1)稀盐酸、稀硫酸、白醋、拧檬汁都能使石蕊试液变_____色,使酚酞试液_____,溶液的pH_____7。
(2)氢氧化钠溶液、氢氧化钙溶液、肥皂水都能使石蕊试液变_____色,使酚酞试液变_____色,溶液的pH_____7。
(3)自来水、蔗糖水、食盐水都不能使石蕊试液、酚酞试液变色,溶液的pH_____7。
13.某些植物的花汁可作酸碱指示剂.取三种花汁用稀酸溶液或稀碱溶液检验,颜色如表:
花种类 花汁在酒精(中性)中颜色 花汁在稀酸中颜色 花汁在稀碱中颜色
玫瑰花 粉红 粉红 绿
万寿菊花 黄 黄 黄
大红花 粉红 橙 绿
试回答下列问题:
为试验生活中的食盐水、肥皂水、汽水、石灰水四种物质的酸碱性,我选择________花汁,不选用其他花汁的原因是________
取所选花汁少许分别滴入上述四种物质,请将所显颜色填入表中:
试验物质 食盐水 肥皂水 汽水 石灰水
所显颜色 _______ _______ _______ _______
三、推断题
14.图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是一种黄绿色有毒气体,是由17号元素组成的双原子分子,丁是黑色固体,戊是紫红色金属;常温下A是液态,农业上常用F改良酸性土壤(图中部分反应条件已省略)回答下列问题:
(1)甲为______;B为______。(填化学式)
(2)在电解A实验中,与电源______极相连的一端产生物质乙。
(3)工业上常用丙和F制漂白粉【CaCl2和Ca(C1O)2】。同时生成A.请写出该反应的化学方程式______。
(4)D和A反应______热量。(填“吸收”或“放出”)
15.如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已省略),请回答问题。
(1)X的物质类别____________。
(2)根据性质①写出检验CO2的化学反应方程式__________________________。
(3)根据性质②写出能体现碱的相似化学性质的反应方程式__________________。
四、实验题
16.气体的制取和检验是化学实验的重要内容和技能。
(1)实验室常用较浓的过氧化氢溶液与二氧化锰 制氧气。
①反应的化学方程式为 _____ 。
②实验中,为了得到平稳的气流,下图中最适合的装置组合是 _____ (填序号)。
(2)某未知气体X可能含有CO、中的一种或两种,为了确定其成分,某同学设计如下实验(如图所示)进行探究。
查阅资料:
I.加热时, 能与反应生成、 和;
Ⅱ.20℃时,和 溶解度分别为:0.165g,2.1g。
①仪器 M 的名称是 ________ ,与 反应的化学方程式为 _________________ 。
气体X成分的猜想与探究:
猜想 1:只有 CO 猜想 2:只有 猜想 3:既有 CO 又有 ②实验时,先往装置中通一段时间的 ,再通入气体 X后加热,实验中有下列变化。
变化 1:A中玻璃管内黑色粉末逐渐变红;变化 2:B瓶增重;变化 3:C中出现浑浊。 根据变化 ________ (填“1”“2”或“3”),可知猜想1不成立。
③根据上述变化仍无法确定气体X的成分,还需要测定 ________ (填序号),并进行 定量分析才能得出结论。
a实验前 A 中 CuO 的质量 b B 瓶增重的质量 c C 瓶增重的质量
讨论和反思:
④C 中用 溶液而不用 溶液的原因是 ________________________ 。
⑤从环保的角度,该装置还应进行的改进是 ________________________________ 。
17.为探究酸的化学性质,某化学小组做了如图实验:
(1)上述反应中有气泡产生的是_______(填字母序号)。
(2)上述反应中不能体现酸的通性的是_______(填字母序号)。酸具有相似的化学性质,是因为它们在溶于水时,都解离出了共同的阳离子_______(填离子符号)
(3)实验室制取氢气时不用盐酸,一般选用稀硫酸与锌反应,写出化学方程式:_______ 。
(4)下列物质存放在烧杯中一段时间后,质量变小且溶质种类不变的是_______。
①烧碱 ②浓硫酸 ③浓盐酸 ④生石灰
(5)鉴别稀盐酸,稀硫酸时,我们应该分别取两种待测液于两支洁净的试管中,滴加少量_______溶液。(填化学式)
五、计算题
18.已知Na2CO3的水溶液呈碱性。在一烧杯中盛有31.4gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填>、=或<)。
(2)通过计算求出烧杯中溶液恰好是中性时,所得溶液中溶质的质量。
19.某化学兴趣小组的同学在实验室棋拟用石灰石制取生石灰的过程。该小组取用100g某石灰石样品粉末,充分高温煅烧,冷却后称量剩余固体质量为64.8g。
(1)生石灰与水反应,除了制取熟石灰外,还可用于_________(填一种用途)。
(2)请计算该石灰石样品中碳酸钙的质量分数______(根据化学方程式计算)。
20.将8.0g三氧化二铁加入到100.0g的稀硫酸溶液中,恰好完全反应:化学反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O。试计算:
(1)硫酸的相对分子质量是_________;
(2)稀硫酸溶液的溶质质量分数是______(计算结果精确到0.1%)。
参考答案:
1.B 2.B 3.B 4.B 5.C 6.D 7.B 8.C 9.C 10.C 11.C
12. 红 不变色 < 蓝 红 > =
13. 大红花; 因为其它两种在酸、碱、中性溶液中呈现相同的颜色. 绿 橙 绿
14. H2 CaCO3 正 放出
15. 盐 Ca(OH)2+CO2==CaCO3↓+H2O 2NH4Cl+ Ca(OH)2CaCl2+2NH3↑+2H2O (符合题意即可)
16. AD 酒精灯 2 bc 20℃时,的溶解度比的溶解度大,能吸收尽二氧化碳 在C装置右边导管处增加一个尾气处理装置
17.(1)BE
(2) FG H+
(3)Zn+H2SO4=ZnSO4+H2↑
(4)③
(5)BaCl2
18.(1)<
(2)设固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z
解得x=10. 6g,y=11. 7g,z=4. 4g
NaCl溶液中溶质的质量分数为:
答:所得溶液中溶质的质量分数是32. 5%。
19. 做干燥剂 完全反应后生成二氧化碳的质量为:100g-64. 8g=35. 2g;
设参与反应的CaCO3的质量为x
x=80g
该石灰石样品中碳酸钙的质量分数为:
答:该石灰石样品中碳酸钙的质量分数80%。
20.(1)98(2)14.7%
一、单选题
1.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去FeSO4溶液中的CuSO4 加入足量铁粉,过滤
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个干冷的烧杯
C 除去炭粉中的氧化铜 将样品溶于稀硫酸,过滤、洗涤、干燥
D 鉴别CuSO4和Na2CO3粉末 分别取适量粉末溶于水后,观察溶液颜色
A.A B.B
C.C D.D
2.下列图像分别与选项中的操作相对应,其中合理的是( )
A.向纯碱溶液中加水稀释
B.加热高锰酸钾固体制取氧气
C.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
D.向一定质量氯化钾和氯化铜的混合溶液中加入氢氧化钠溶液
3.下列实验现象叙述正确的是( )
A.硫粉在空气中燃烧:产生明亮的蓝紫色火焰,放热,生成有刺激性气味的气体
B.氢气通入灼热的氧化铜:黑色固体变成紫红色,试管口有无色液滴生成
C.铁粉加入稀硫酸:银白色固体表面有气泡产生,固体减少,放热,溶液由无色变为浅绿色
D.水通电:两极均有气体生成,正极多,负极少,体积比约为1:2
4.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A.①②③④⑤ B.②③④⑤
C.②③⑤ D.②④⑤
5.常温下,下列说法错误的是
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱
D.pH>10的土壤不适于种植农作物,因为碱性太强
6.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
7.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
8.类比推理在化学学习和科学研究中有重要意义,下列说法正确的是( )
A.化合物中含不同种元素,所以含不同种元素的物质一定是化合物
B.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应
C.含碳元素的物质燃烧会生成CO2,所以燃烧生成CO2的物质一定含碳元素
D.同种元素的原子所含质子数相同,含有相同质子数的微粒一定属于同种元素
9.实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化。测定结果如图所示,下列说法不正确的是
A.反应过程中有热量放出 B.30 s时,溶液中溶质为HCl和NaCl
C.该实验是将稀盐酸滴入稀NaOH溶液 D.从20 s到40 s,溶液的温度升高,pH增大
10.醋酸(CH3COOH是食醋的成分之一,其水溶液中存在H+和CH3COO-。下列说法正确的是
A.醋酸属于氧化物
B.醋酸不能用于除铁锈
C.醋酸能与镁反应产生氢气
D.醋酸中碳元素的质量分数最大
11.下列有关酸碱盐的说法中,错误的是( )
A.用氢氧化铝治疗胃酸过多是利用了中和反应原理
B.浓盐酸敞口放置在空气中会产生白雾
C.侯氏制碱法中的“碱”是指NaOH
D.治理硫酸厂的污水时,可向该污水中投放适量的生石灰
二、简答题
12.酸、碱与指示剂作用
实验现象与结果:(1)稀盐酸、稀硫酸、白醋、拧檬汁都能使石蕊试液变_____色,使酚酞试液_____,溶液的pH_____7。
(2)氢氧化钠溶液、氢氧化钙溶液、肥皂水都能使石蕊试液变_____色,使酚酞试液变_____色,溶液的pH_____7。
(3)自来水、蔗糖水、食盐水都不能使石蕊试液、酚酞试液变色,溶液的pH_____7。
13.某些植物的花汁可作酸碱指示剂.取三种花汁用稀酸溶液或稀碱溶液检验,颜色如表:
花种类 花汁在酒精(中性)中颜色 花汁在稀酸中颜色 花汁在稀碱中颜色
玫瑰花 粉红 粉红 绿
万寿菊花 黄 黄 黄
大红花 粉红 橙 绿
试回答下列问题:
为试验生活中的食盐水、肥皂水、汽水、石灰水四种物质的酸碱性,我选择________花汁,不选用其他花汁的原因是________
取所选花汁少许分别滴入上述四种物质,请将所显颜色填入表中:
试验物质 食盐水 肥皂水 汽水 石灰水
所显颜色 _______ _______ _______ _______
三、推断题
14.图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是一种黄绿色有毒气体,是由17号元素组成的双原子分子,丁是黑色固体,戊是紫红色金属;常温下A是液态,农业上常用F改良酸性土壤(图中部分反应条件已省略)回答下列问题:
(1)甲为______;B为______。(填化学式)
(2)在电解A实验中,与电源______极相连的一端产生物质乙。
(3)工业上常用丙和F制漂白粉【CaCl2和Ca(C1O)2】。同时生成A.请写出该反应的化学方程式______。
(4)D和A反应______热量。(填“吸收”或“放出”)
15.如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已省略),请回答问题。
(1)X的物质类别____________。
(2)根据性质①写出检验CO2的化学反应方程式__________________________。
(3)根据性质②写出能体现碱的相似化学性质的反应方程式__________________。
四、实验题
16.气体的制取和检验是化学实验的重要内容和技能。
(1)实验室常用较浓的过氧化氢溶液与二氧化锰 制氧气。
①反应的化学方程式为 _____ 。
②实验中,为了得到平稳的气流,下图中最适合的装置组合是 _____ (填序号)。
(2)某未知气体X可能含有CO、中的一种或两种,为了确定其成分,某同学设计如下实验(如图所示)进行探究。
查阅资料:
I.加热时, 能与反应生成、 和;
Ⅱ.20℃时,和 溶解度分别为:0.165g,2.1g。
①仪器 M 的名称是 ________ ,与 反应的化学方程式为 _________________ 。
气体X成分的猜想与探究:
猜想 1:只有 CO 猜想 2:只有 猜想 3:既有 CO 又有 ②实验时,先往装置中通一段时间的 ,再通入气体 X后加热,实验中有下列变化。
变化 1:A中玻璃管内黑色粉末逐渐变红;变化 2:B瓶增重;变化 3:C中出现浑浊。 根据变化 ________ (填“1”“2”或“3”),可知猜想1不成立。
③根据上述变化仍无法确定气体X的成分,还需要测定 ________ (填序号),并进行 定量分析才能得出结论。
a实验前 A 中 CuO 的质量 b B 瓶增重的质量 c C 瓶增重的质量
讨论和反思:
④C 中用 溶液而不用 溶液的原因是 ________________________ 。
⑤从环保的角度,该装置还应进行的改进是 ________________________________ 。
17.为探究酸的化学性质,某化学小组做了如图实验:
(1)上述反应中有气泡产生的是_______(填字母序号)。
(2)上述反应中不能体现酸的通性的是_______(填字母序号)。酸具有相似的化学性质,是因为它们在溶于水时,都解离出了共同的阳离子_______(填离子符号)
(3)实验室制取氢气时不用盐酸,一般选用稀硫酸与锌反应,写出化学方程式:_______ 。
(4)下列物质存放在烧杯中一段时间后,质量变小且溶质种类不变的是_______。
①烧碱 ②浓硫酸 ③浓盐酸 ④生石灰
(5)鉴别稀盐酸,稀硫酸时,我们应该分别取两种待测液于两支洁净的试管中,滴加少量_______溶液。(填化学式)
五、计算题
18.已知Na2CO3的水溶液呈碱性。在一烧杯中盛有31.4gNa2CO3和NaCl组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填>、=或<)。
(2)通过计算求出烧杯中溶液恰好是中性时,所得溶液中溶质的质量。
19.某化学兴趣小组的同学在实验室棋拟用石灰石制取生石灰的过程。该小组取用100g某石灰石样品粉末,充分高温煅烧,冷却后称量剩余固体质量为64.8g。
(1)生石灰与水反应,除了制取熟石灰外,还可用于_________(填一种用途)。
(2)请计算该石灰石样品中碳酸钙的质量分数______(根据化学方程式计算)。
20.将8.0g三氧化二铁加入到100.0g的稀硫酸溶液中,恰好完全反应:化学反应方程式为Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O。试计算:
(1)硫酸的相对分子质量是_________;
(2)稀硫酸溶液的溶质质量分数是______(计算结果精确到0.1%)。
参考答案:
1.B 2.B 3.B 4.B 5.C 6.D 7.B 8.C 9.C 10.C 11.C
12. 红 不变色 < 蓝 红 > =
13. 大红花; 因为其它两种在酸、碱、中性溶液中呈现相同的颜色. 绿 橙 绿
14. H2 CaCO3 正 放出
15. 盐 Ca(OH)2+CO2==CaCO3↓+H2O 2NH4Cl+ Ca(OH)2CaCl2+2NH3↑+2H2O (符合题意即可)
16. AD 酒精灯 2 bc 20℃时,的溶解度比的溶解度大,能吸收尽二氧化碳 在C装置右边导管处增加一个尾气处理装置
17.(1)BE
(2) FG H+
(3)Zn+H2SO4=ZnSO4+H2↑
(4)③
(5)BaCl2
18.(1)<
(2)设固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z
解得x=10. 6g,y=11. 7g,z=4. 4g
NaCl溶液中溶质的质量分数为:
答:所得溶液中溶质的质量分数是32. 5%。
19. 做干燥剂 完全反应后生成二氧化碳的质量为:100g-64. 8g=35. 2g;
设参与反应的CaCO3的质量为x
x=80g
该石灰石样品中碳酸钙的质量分数为:
答:该石灰石样品中碳酸钙的质量分数80%。
20.(1)98(2)14.7%
