第6章常用的金属和盐测试题—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐测试题—2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 90.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 16:29:02 | ||
图片预览



文档简介
第6章《常用的金属和盐》检测题
一、单选题
1.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
2.类推是化学学习中常用的思考方法,以下四个类推结果正确的是( )
A.有氧气参加的反应一定是氧化反应,氧化反应一定有氧气参加
B.化学变化生成了新物质,所以初中阶段有新物质生成的变化都是化学变化
C.分子是保持物质化学性质的一种微粒,保持物质化学性质的唯一微粒是分子
D.分解反应生成了多种物质,因此只要生成了两种或两种以上物质的化学反应就应该是分解反应
3.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去FeSO4溶液中的CuSO4 加入足量铁粉,过滤
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个干冷的烧杯
C 除去炭粉中的氧化铜 将样品溶于稀硫酸,过滤、洗涤、干燥
D 鉴别CuSO4和Na2CO3粉末 分别取适量粉末溶于水后,观察溶液颜色
A.A B.B
C.C D.D
4.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
5.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
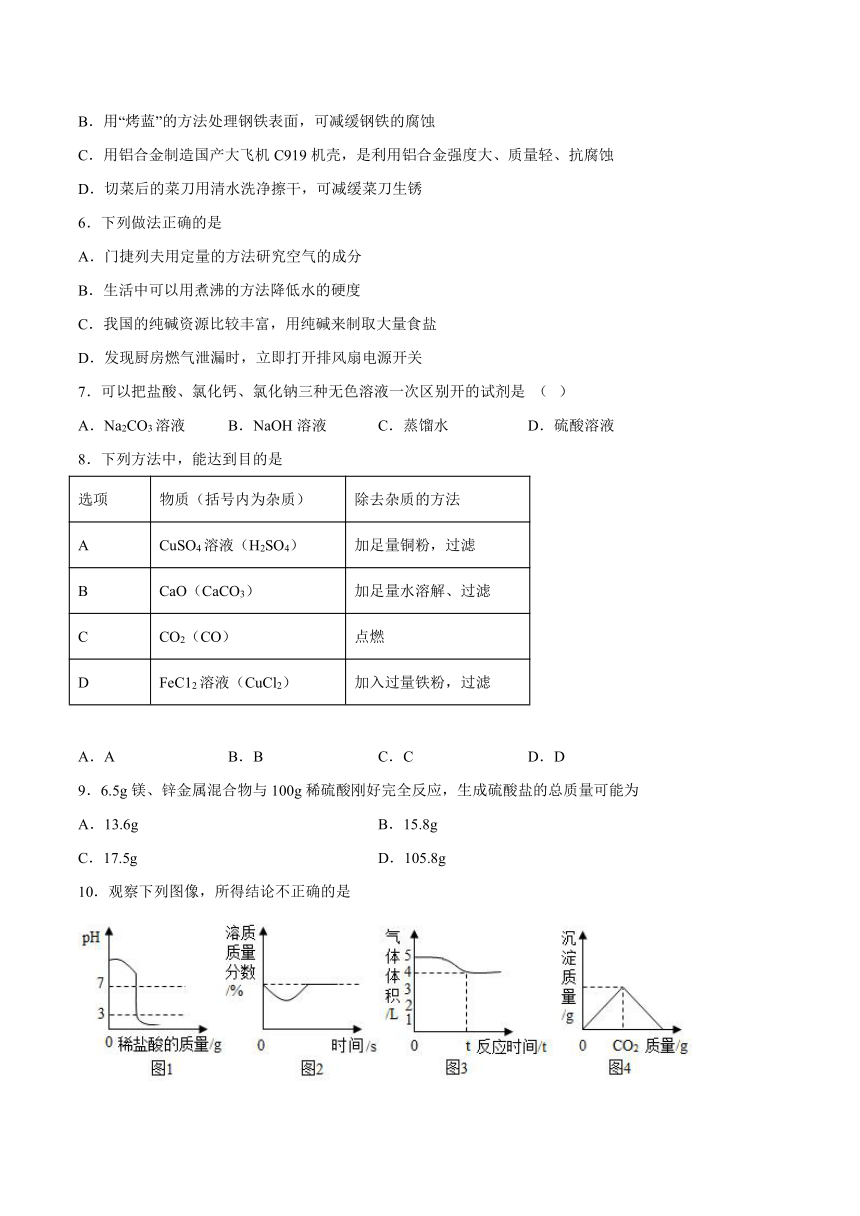
6.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
7.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
8.下列方法中,能达到目的是
选项 物质(括号内为杂质) 除去杂质的方法
A CuSO4溶液(H2SO4) 加足量铜粉,过滤
B CaO(CaCO3) 加足量水溶解、过滤
C CO2(CO) 点燃
D FeC12溶液(CuCl2) 加入过量铁粉,过滤
A.A B.B C.C D.D
9.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
10.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
11.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48:23
D.该反应中甲、丁的相对分子质量之比一定为44:27
二、简答题
12.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质为________。
(2)若反应后,将溶液过滤,所得固体物质加盐酸没有气体产生,则固体物质中一定有________,可能有________________________________________________________________________。
(3)若反应后,将析出的金属过滤,向滤液中滴加NaCl溶液,有不溶于稀HNO3的白色沉淀生成,则此时溶液中含有的溶质为________________________________________________。
13.化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
实验步骤 实验现象 结 论
________________ ________________ 金属活动性:Fe>Cu
(2)实验二:镁、锌、铁三种金属与酸的反应.
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]
①三个反应的共同特点是_________,写出其中一个反应的化学方程式__________________.
②若完全反应后,三个反应生成氢气的质量相等,原因是__________________.
三、推断题
14.(1)实验室有两瓶失去标签的溶液,已知分别是稀硫酸和氢氧化钠溶液(记作A、B),小雪同学用下列方法鉴别,试回答下列问题:
①取适量的A、B两种溶液于试管中,分别加入适量镁粉,观察到A中有气体产生,则A是___________溶液(写化学式)。
②她还利用了下列试剂进行鉴别,其中不可行的是___________(填选项序号之一)。
A石蕊试液 B铜粉 C氯化铁溶液 D碳酸钾固体
(2)现欲探究一固体混合物A的成分,已知其中可能含有Na2CO3、BaCl2、Cu(NO3)2、NH4NO3四种物质中的两种或多种,按图所示进行实验,出现的现象如图中所示(设过程中所有发生的反应都恰好完全反应)。
试根据实验过程和现象做出判断并回答:
①沉淀D的化学式为___________。
②写出实验过程②发生反应的化学方程式___________。
③通过实验可知固体混合物A中Cu(NO3)2一定不存在,得出此结论的理由是___________。
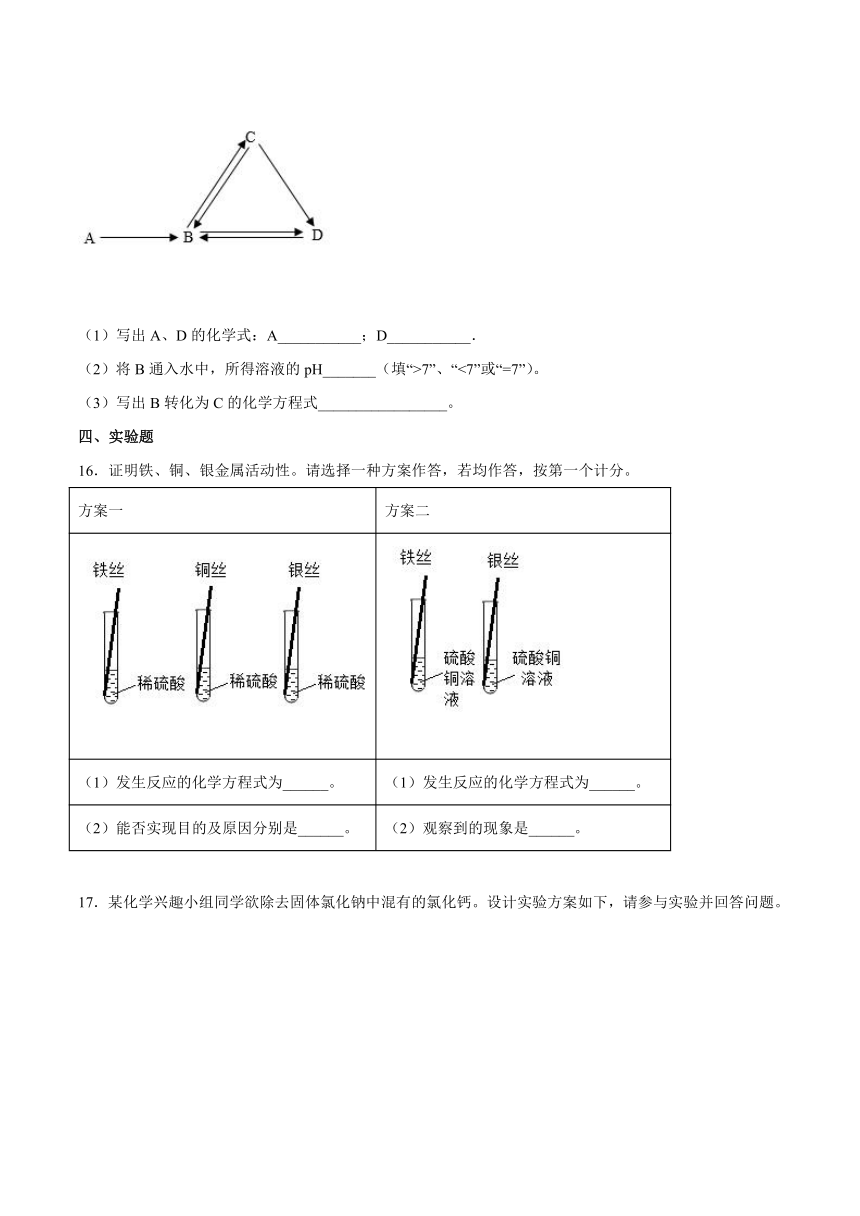
15.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
四、实验题
16.证明铁、铜、银金属活动性。请选择一种方案作答,若均作答,按第一个计分。
方案一 方案二
(1)发生反应的化学方程式为______。 (1)发生反应的化学方程式为______。
(2)能否实现目的及原因分别是______。 (2)观察到的现象是______。
17.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
18.北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6gFe粉,充分反应后,理论上可以得到Cu的质量是多少?
19.实验室有一包碳酸钠和氯化钠及少量杂质的固体混合物样品(其中杂质不溶于水,也不与其他物质发生化学反应),某实验小组同学进行了如下实验:
(1)发生反应的化学方程式为______________。
(2)根据已知条件求解样品中参加反应的物质质量(X)的比例式为________。
(3)C烧杯溶液中溶质的质量分数为_______。
(4)B烧杯溶液中溶质的化学式为____________。
(5)原样品中碳酸钠和氯化钠的质量最简整数比为________。
(6)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸质量是________。
20.某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数。他们取6g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示。请回答下列问题:
(1)该样品中碳酸钠的质量分数是多少?(写出计算步骤,计算结果精确到0.1%)
(2)如果反应开始前,向烧杯中滴加几滴无色酚酞试液,在整个测定过程中可观察到的现象是: 。
参考答案:
1.B 2.B 3.B 4.D 5.A 6.B 7.A 8.D 9.C 10.A 11.C
12. Zn(NO3)2 Ag Cu AgNO3、Cu(NO3)2、Zn(NO3)2
13. 向硫酸铜溶液中投入铁钉 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 都是置换反应 Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑; 当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等.
14. H2SO4 B BaSO4 滤液C中加入氢氧化钠物没有沉淀生成
15. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
16. Fe+H2SO4=FeSO4+H2↑ 不能,没有证明出铜和银的金属活动性 Fe+CuSO4=FeSO4+Cu 第一支试管中铁丝表面附着一层紫红色的固体,蓝色溶液逐渐变浅,第二支试管中无明显变化
17.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
18.(1)强;(2)6.4g
19.(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)(3)12.8%(4)Na2CO3、NaCl(5)212:117(6)40g
20.(1)
解:根据图示,反应中生成的碳酸钙质量为5g。
设该纯碱样品中碳酸钠的质量为 x。
X=5.3g;
该纯碱样品中碳酸钠的质量分数为:;
答:纯碱样品中碳酸钠的质量分数为88.3%;
(2)溶液由红色变为无色,有白色沉淀生成
一、单选题
1.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
2.类推是化学学习中常用的思考方法,以下四个类推结果正确的是( )
A.有氧气参加的反应一定是氧化反应,氧化反应一定有氧气参加
B.化学变化生成了新物质,所以初中阶段有新物质生成的变化都是化学变化
C.分子是保持物质化学性质的一种微粒,保持物质化学性质的唯一微粒是分子
D.分解反应生成了多种物质,因此只要生成了两种或两种以上物质的化学反应就应该是分解反应
3.下列实验设计不能达到实验目的的是( )
选项 实验目的 实验设计
A 除去FeSO4溶液中的CuSO4 加入足量铁粉,过滤
B 鉴别H2和CH4 分别点燃,在火焰上方罩一个干冷的烧杯
C 除去炭粉中的氧化铜 将样品溶于稀硫酸,过滤、洗涤、干燥
D 鉴别CuSO4和Na2CO3粉末 分别取适量粉末溶于水后,观察溶液颜色
A.A B.B
C.C D.D
4.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
5.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
6.下列做法正确的是
A.门捷列夫用定量的方法研究空气的成分
B.生活中可以用煮沸的方法降低水的硬度
C.我国的纯碱资源比较丰富,用纯碱来制取大量食盐
D.发现厨房燃气泄漏时,立即打开排风扇电源开关
7.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
8.下列方法中,能达到目的是
选项 物质(括号内为杂质) 除去杂质的方法
A CuSO4溶液(H2SO4) 加足量铜粉,过滤
B CaO(CaCO3) 加足量水溶解、过滤
C CO2(CO) 点燃
D FeC12溶液(CuCl2) 加入过量铁粉,过滤
A.A B.B C.C D.D
9.6.5g镁、锌金属混合物与100g稀硫酸刚好完全反应,生成硫酸盐的总质量可能为
A.13.6g B.15.8g
C.17.5g D.105.8g
10.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
11.在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是
A.该反应一定属于置换反应
B.戊一定是该反应的催化剂
C.参加反应的乙、丙的质量比一定为48:23
D.该反应中甲、丁的相对分子质量之比一定为44:27
二、简答题
12.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质为________。
(2)若反应后,将溶液过滤,所得固体物质加盐酸没有气体产生,则固体物质中一定有________,可能有________________________________________________________________________。
(3)若反应后,将析出的金属过滤,向滤液中滴加NaCl溶液,有不溶于稀HNO3的白色沉淀生成,则此时溶液中含有的溶质为________________________________________________。
13.化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
实验步骤 实验现象 结 论
________________ ________________ 金属活动性:Fe>Cu
(2)实验二:镁、锌、铁三种金属与酸的反应.
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]
①三个反应的共同特点是_________,写出其中一个反应的化学方程式__________________.
②若完全反应后,三个反应生成氢气的质量相等,原因是__________________.
三、推断题
14.(1)实验室有两瓶失去标签的溶液,已知分别是稀硫酸和氢氧化钠溶液(记作A、B),小雪同学用下列方法鉴别,试回答下列问题:
①取适量的A、B两种溶液于试管中,分别加入适量镁粉,观察到A中有气体产生,则A是___________溶液(写化学式)。
②她还利用了下列试剂进行鉴别,其中不可行的是___________(填选项序号之一)。
A石蕊试液 B铜粉 C氯化铁溶液 D碳酸钾固体
(2)现欲探究一固体混合物A的成分,已知其中可能含有Na2CO3、BaCl2、Cu(NO3)2、NH4NO3四种物质中的两种或多种,按图所示进行实验,出现的现象如图中所示(设过程中所有发生的反应都恰好完全反应)。
试根据实验过程和现象做出判断并回答:
①沉淀D的化学式为___________。
②写出实验过程②发生反应的化学方程式___________。
③通过实验可知固体混合物A中Cu(NO3)2一定不存在,得出此结论的理由是___________。
15.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
四、实验题
16.证明铁、铜、银金属活动性。请选择一种方案作答,若均作答,按第一个计分。
方案一 方案二
(1)发生反应的化学方程式为______。 (1)发生反应的化学方程式为______。
(2)能否实现目的及原因分别是______。 (2)观察到的现象是______。
17.某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
(1)写出A物质的化学式:__________,写出A物质的俗称:_________。
(2)写出反应②的化学方程式___________。
(3)反应①中加入过量A物质的目的是除尽CaCl2,反应②中如果加入盐酸也过量,则对所得到的氯化钠纯度_________(选填“有”或“没有”)影响。
(4)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果_________(选填“增大”“不变”或“减小”)。
五、计算题
18.北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6gFe粉,充分反应后,理论上可以得到Cu的质量是多少?
19.实验室有一包碳酸钠和氯化钠及少量杂质的固体混合物样品(其中杂质不溶于水,也不与其他物质发生化学反应),某实验小组同学进行了如下实验:
(1)发生反应的化学方程式为______________。
(2)根据已知条件求解样品中参加反应的物质质量(X)的比例式为________。
(3)C烧杯溶液中溶质的质量分数为_______。
(4)B烧杯溶液中溶质的化学式为____________。
(5)原样品中碳酸钠和氯化钠的质量最简整数比为________。
(6)配制上述实验所用的稀盐酸,需要质量分数为36.5%的浓盐酸质量是________。
20.某碳酸钠样品中含少量氯化钠,化学兴趣小组的同学欲通过实验来测定样品中碳酸钠的质量分数。他们取6g该样品,配制成溶液,再向其中加入足量的氯化钙溶液(呈中性),测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示。请回答下列问题:
(1)该样品中碳酸钠的质量分数是多少?(写出计算步骤,计算结果精确到0.1%)
(2)如果反应开始前,向烧杯中滴加几滴无色酚酞试液,在整个测定过程中可观察到的现象是: 。
参考答案:
1.B 2.B 3.B 4.D 5.A 6.B 7.A 8.D 9.C 10.A 11.C
12. Zn(NO3)2 Ag Cu AgNO3、Cu(NO3)2、Zn(NO3)2
13. 向硫酸铜溶液中投入铁钉 铁钉表面有红色固体析出,溶液由蓝色变为浅绿色 都是置换反应 Mg+H2SO4=MgSO4+H2↑或Zn+H2SO4=ZnSO4+H2↑或Fe+H2SO4=FeSO4+H2↑; 当三种金属过量,硫酸完全反应时,则生成氢气质量相等;当硫酸过量,三种金属完全反应,且质量比为mMg:mZn:mFe=24:65:56时,则生成氢气质量相等.
14. H2SO4 B BaSO4 滤液C中加入氢氧化钠物没有沉淀生成
15. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
16. Fe+H2SO4=FeSO4+H2↑ 不能,没有证明出铜和银的金属活动性 Fe+CuSO4=FeSO4+Cu 第一支试管中铁丝表面附着一层紫红色的固体,蓝色溶液逐渐变浅,第二支试管中无明显变化
17.(1) Na2CO3 纯碱
(2)
(3)没有
(4)增大
18.(1)强;(2)6.4g
19.(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑(2)(3)12.8%(4)Na2CO3、NaCl(5)212:117(6)40g
20.(1)
解:根据图示,反应中生成的碳酸钙质量为5g。
设该纯碱样品中碳酸钠的质量为 x。
X=5.3g;
该纯碱样品中碳酸钠的质量分数为:;
答:纯碱样品中碳酸钠的质量分数为88.3%;
(2)溶液由红色变为无色,有白色沉淀生成
