第九单元 金属测试题 (word版有答案)
文档属性
| 名称 | 第九单元 金属测试题 (word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 104.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 16:50:58 | ||
图片预览

文档简介
第九单元《金属》检测题
一、单选题
1.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
2.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中D.将铜片放入硝酸银溶液中
3.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
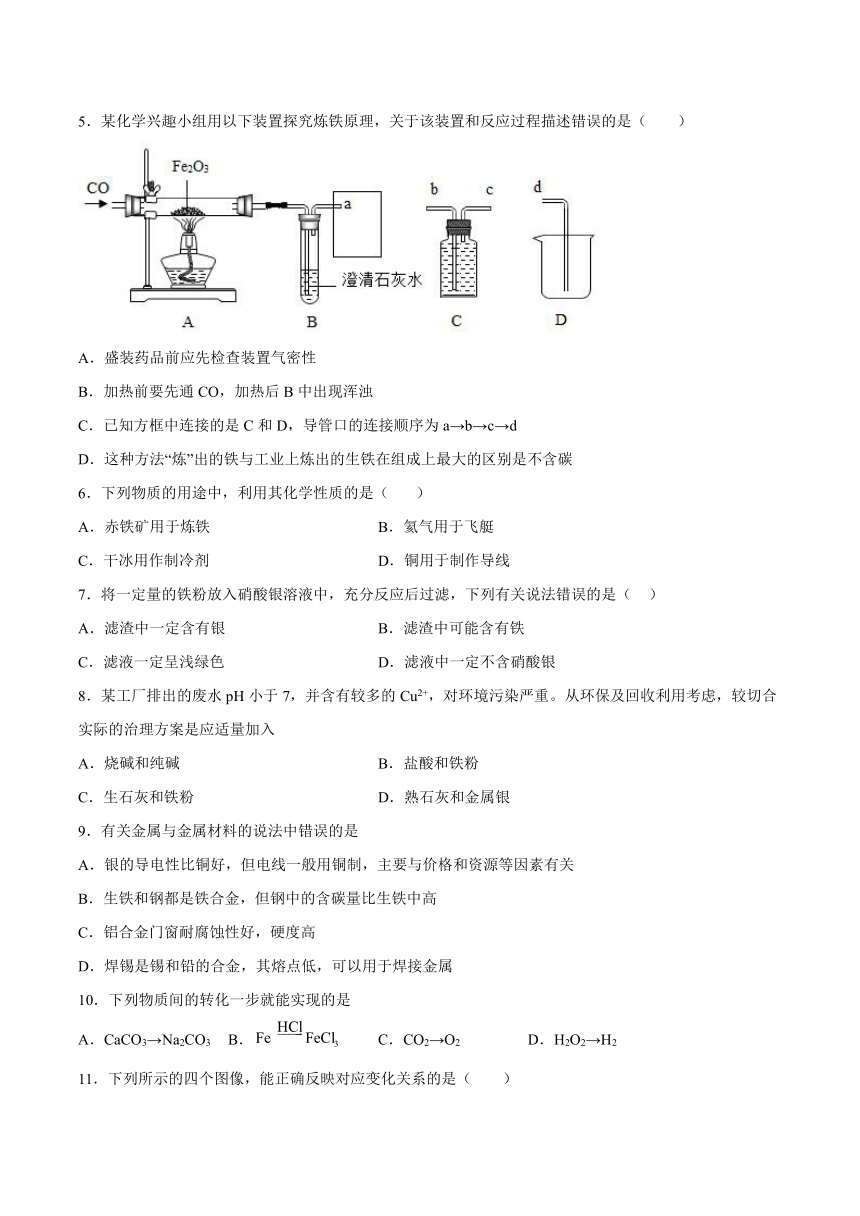
4.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
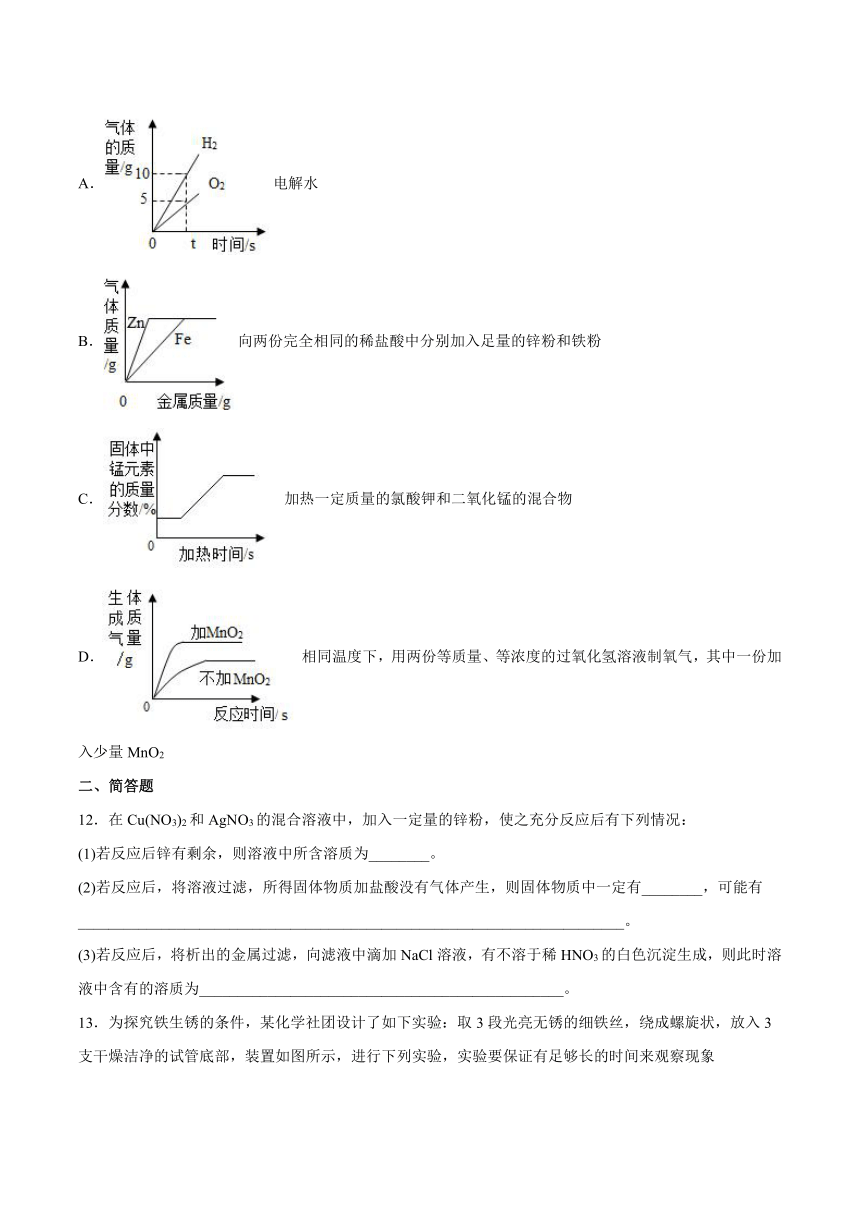
5.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
6.下列物质的用途中,利用其化学性质的是( )
A.赤铁矿用于炼铁 B.氦气用于飞艇
C.干冰用作制冷剂 D.铜用于制作导线
7.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
8.某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
9.有关金属与金属材料的说法中错误的是
A.银的导电性比铜好,但电线一般用铜制,主要与价格和资源等因素有关
B.生铁和钢都是铁合金,但钢中的含碳量比生铁中高
C.铝合金门窗耐腐蚀性好,硬度高
D.焊锡是锡和铅的合金,其熔点低,可以用于焊接金属
10.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
11.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
二、简答题
12.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质为________。
(2)若反应后,将溶液过滤,所得固体物质加盐酸没有气体产生,则固体物质中一定有________,可能有________________________________________________________________________。
(3)若反应后,将析出的金属过滤,向滤液中滴加NaCl溶液,有不溶于稀HNO3的白色沉淀生成,则此时溶液中含有的溶质为________________________________________________。
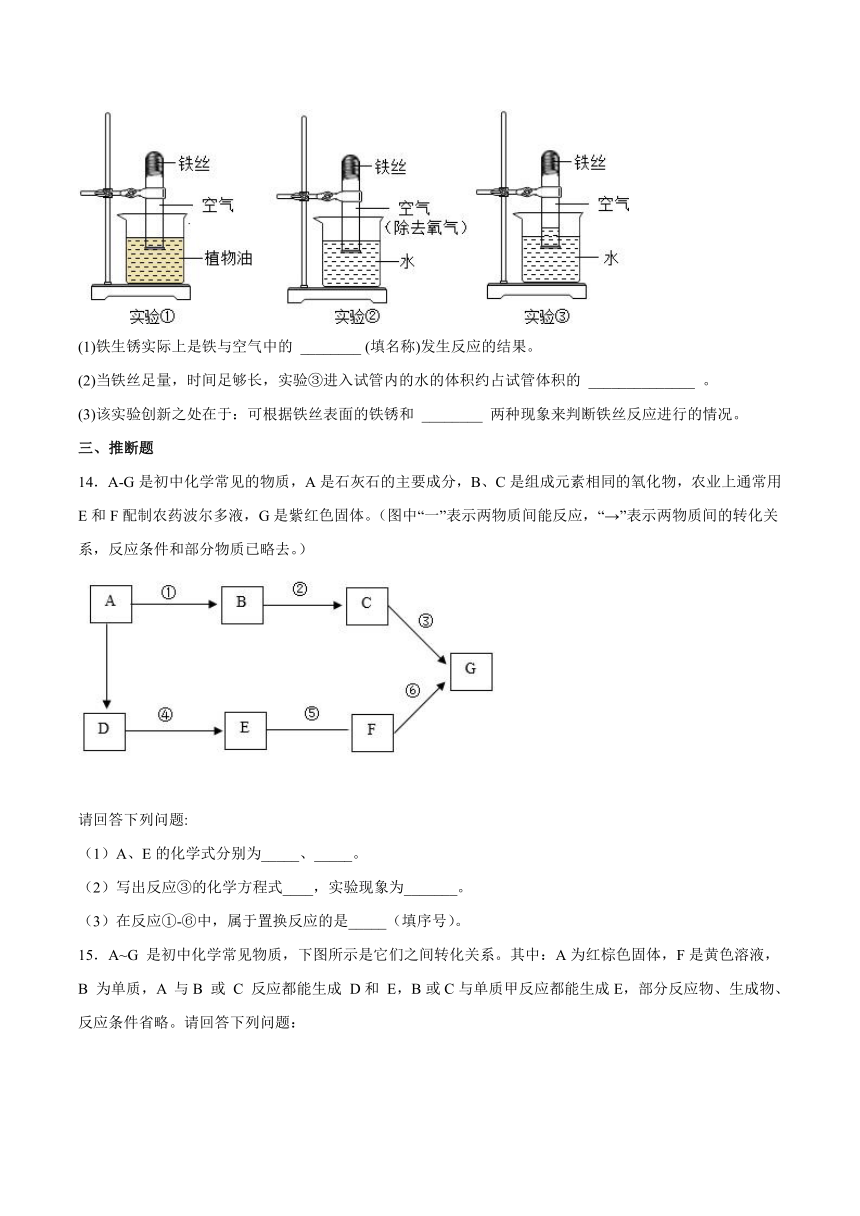
13.为探究铁生锈的条件,某化学社团设计了如下实验:取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,装置如图所示,进行下列实验,实验要保证有足够长的时间来观察现象
(1)铁生锈实际上是铁与空气中的 ________ (填名称)发生反应的结果。
(2)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 ______________ 。
(3)该实验创新之处在于:可根据铁丝表面的铁锈和 ________ 两种现象来判断铁丝反应进行的情况。
三、推断题
14.A-G是初中化学常见的物质,A是石灰石的主要成分,B、C是组成元素相同的氧化物,农业上通常用E和F配制农药波尔多液,G是紫红色固体。(图中“一”表示两物质间能反应,“→”表示两物质间的转化关系,反应条件和部分物质已略去。)
请回答下列问题:
(1)A、E的化学式分别为_____、_____。
(2)写出反应③的化学方程式____,实验现象为_______。
(3)在反应①-⑥中,属于置换反应的是_____(填序号)。
15.A~G 是初中化学常见物质,下图所示是它们之间转化关系。其中:A为红棕色固体,F是黄色溶液,B 为单质,A 与B 或 C 反应都能生成 D和 E,B或C与单质甲反应都能生成E,部分反应物、生成物、反应条件省略。请回答下列问题:
(1)实验室检验E的方法为______;
(2)C 与甲反应的现象为______;
(3)写出A与G反应的化学方程式______;
(4)写出A 与C反应的化学方程式______。
四、实验题
16.化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
(1)实验一:发生反应的化学方程式 ________________________________________________ ,该实验可得出三种金属的活动性由强到弱的顺序为 ______________________ 。
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤。滤渣中一定含有的物质是 ________________ ,可能含有的物质是 ________________ ,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
实验步骤 实验现象 结论
取少量滤渣于试管中,向其中滴加 _______________ 没有气泡产生 ________
滤液中含有的金属离子可能是 ____________ 。
①Mg2+ ②Mg2+、Fe2+ ③Mg2+、Fe3+ ④Cu2+、Fe2+ ⑤Mg2+、Fe2+、Cu2+
17.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
18.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。
现称取100.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O。)请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g。
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
19.将10g铁棒放入硫酸铜溶液中,片刻后取出铁棒,称量为10.4g,计算生成铜多少克?
20.北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6gFe粉,充分反应后,理论上可以得到Cu的质量是多少?
参考答案:
1.D 2.C 3.A 4.A 5.C 6.A 7.D 8.C 9.B 10.C 11.C
12. Zn(NO3)2 Ag Cu AgNO3、Cu(NO3)2、Zn(NO3)2
13. 水、氧气 五分之一 试管内液面上升
14. CaCO3 Ca(OH)2 黑色固体变红 ⑥
15. 将气体通入澄清石灰水中,若澄清石灰水变浑浊,则该气体为二氧化碳 发出蓝色的火焰,放出大量的热 (答案合理即可)
16. Mg、Fe、Cu(或镁、铁、铜) Cu(或铜) Fe(或铁) 稀盐酸(或稀硫酸) 滤渣中没有铁 ②⑤
17. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
18.(1)267.0
(2)62.5%
(3)解:设稀硫酸中溶质的质量分数为x
答:稀硫酸中溶质的质量分数为20%。
19.3.2g
20.(1)强;(2)6.4g
一、单选题
1.明代宋应星著的《天工开物》中有关于“火法”冶炼金属锌的工艺记载:“炉甘石(注:主要成分是碳酸锌)十斤,装载入一泥罐內,然后逐层用煤炭饼(注:反应后生成一氧化碳)垫盛,其底铺薪,发火煅红,冷淀,毁罐取出,即倭铅也”。下列说法错误的是
A.煤炭中起作用的主要成分是C
B.冶炼Zn的化学方程式为:
C.该冶炼锌的反应属于置换反应
D.倭铅是指金属锌和铅的混合物
2.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中D.将铜片放入硝酸银溶液中
3.下列有关金属资源的利用与防护解释不合理的是
A.在001A型国产航母金属外壳覆盖涂料,主要是为了美观
B.用“烤蓝”的方法处理钢铁表面,可减缓钢铁的腐蚀
C.用铝合金制造国产大飞机C919机壳,是利用铝合金强度大、质量轻、抗腐蚀
D.切菜后的菜刀用清水洗净擦干,可减缓菜刀生锈
4.观察下列图像,所得结论不正确的是
A.图1:向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
B.图2:在饱和石灰水中加入少量生石灰
C.图3:将一定体积的空气通过灼热的铜网充分反应,可知氧气的体积约占空气体积的1/5
D.图4:将CO2通入一定量的澄清石灰水中,先变浑浊,后生成Ca(HCO3)2而变澄清
5.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
6.下列物质的用途中,利用其化学性质的是( )
A.赤铁矿用于炼铁 B.氦气用于飞艇
C.干冰用作制冷剂 D.铜用于制作导线
7.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
8.某工厂排出的废水pH小于7,并含有较多的Cu2+,对环境污染严重。从环保及回收利用考虑,较切合实际的治理方案是应适量加入
A.烧碱和纯碱 B.盐酸和铁粉
C.生石灰和铁粉 D.熟石灰和金属银
9.有关金属与金属材料的说法中错误的是
A.银的导电性比铜好,但电线一般用铜制,主要与价格和资源等因素有关
B.生铁和钢都是铁合金,但钢中的含碳量比生铁中高
C.铝合金门窗耐腐蚀性好,硬度高
D.焊锡是锡和铅的合金,其熔点低,可以用于焊接金属
10.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
11.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
二、简答题
12.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量的锌粉,使之充分反应后有下列情况:
(1)若反应后锌有剩余,则溶液中所含溶质为________。
(2)若反应后,将溶液过滤,所得固体物质加盐酸没有气体产生,则固体物质中一定有________,可能有________________________________________________________________________。
(3)若反应后,将析出的金属过滤,向滤液中滴加NaCl溶液,有不溶于稀HNO3的白色沉淀生成,则此时溶液中含有的溶质为________________________________________________。
13.为探究铁生锈的条件,某化学社团设计了如下实验:取3段光亮无锈的细铁丝,绕成螺旋状,放入3支干燥洁净的试管底部,装置如图所示,进行下列实验,实验要保证有足够长的时间来观察现象
(1)铁生锈实际上是铁与空气中的 ________ (填名称)发生反应的结果。
(2)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的 ______________ 。
(3)该实验创新之处在于:可根据铁丝表面的铁锈和 ________ 两种现象来判断铁丝反应进行的情况。
三、推断题
14.A-G是初中化学常见的物质,A是石灰石的主要成分,B、C是组成元素相同的氧化物,农业上通常用E和F配制农药波尔多液,G是紫红色固体。(图中“一”表示两物质间能反应,“→”表示两物质间的转化关系,反应条件和部分物质已略去。)
请回答下列问题:
(1)A、E的化学式分别为_____、_____。
(2)写出反应③的化学方程式____,实验现象为_______。
(3)在反应①-⑥中,属于置换反应的是_____(填序号)。
15.A~G 是初中化学常见物质,下图所示是它们之间转化关系。其中:A为红棕色固体,F是黄色溶液,B 为单质,A 与B 或 C 反应都能生成 D和 E,B或C与单质甲反应都能生成E,部分反应物、生成物、反应条件省略。请回答下列问题:
(1)实验室检验E的方法为______;
(2)C 与甲反应的现象为______;
(3)写出A与G反应的化学方程式______;
(4)写出A 与C反应的化学方程式______。
四、实验题
16.化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
(1)实验一:发生反应的化学方程式 ________________________________________________ ,该实验可得出三种金属的活动性由强到弱的顺序为 ______________________ 。
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤。滤渣中一定含有的物质是 ________________ ,可能含有的物质是 ________________ ,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
实验步骤 实验现象 结论
取少量滤渣于试管中,向其中滴加 _______________ 没有气泡产生 ________
滤液中含有的金属离子可能是 ____________ 。
①Mg2+ ②Mg2+、Fe2+ ③Mg2+、Fe3+ ④Cu2+、Fe2+ ⑤Mg2+、Fe2+、Cu2+
17.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
18.废旧金属的回收利用既能保护环境,又能节约资源和能源。某冶金厂回收了一批废黄铜屑,需测定其中铜元素的质量分数。
现称取100.0g样品,加入足量稀硫酸,充分反应后得无色溶液,产生氢气的质量及剩余固体的质量与消耗稀硫酸的质量关系分别如图所示。(设该批次黄铜屑只含铜、锌和少量黄铜锈。黄铜锈与稀硫酸反应生成CuSO4、ZnSO4、CO2和H2O。)请回答下列问题:
(1)完全反应时,样品消耗稀硫酸的质量为______g。
(2)样品中铜元素的质量分数为______%(计算结果精确到0.1%,下同);
(3)计算稀硫酸中溶质的质量分数(写出计算过程)。
19.将10g铁棒放入硫酸铜溶液中,片刻后取出铁棒,称量为10.4g,计算生成铜多少克?
20.北宋沈括编撰的《梦溪笔谈》中,记录了用CuSO4溶液熬制胆矾的铁釜,使用时间久了也可以化作铜。
(1)由上述材料分析,Fe比Cu的金属活动性 (填“强”或“弱”)。
(2)如果向足量的CuSO4溶液中加入5.6gFe粉,充分反应后,理论上可以得到Cu的质量是多少?
参考答案:
1.D 2.C 3.A 4.A 5.C 6.A 7.D 8.C 9.B 10.C 11.C
12. Zn(NO3)2 Ag Cu AgNO3、Cu(NO3)2、Zn(NO3)2
13. 水、氧气 五分之一 试管内液面上升
14. CaCO3 Ca(OH)2 黑色固体变红 ⑥
15. 将气体通入澄清石灰水中,若澄清石灰水变浑浊,则该气体为二氧化碳 发出蓝色的火焰,放出大量的热 (答案合理即可)
16. Mg、Fe、Cu(或镁、铁、铜) Cu(或铜) Fe(或铁) 稀盐酸(或稀硫酸) 滤渣中没有铁 ②⑤
17. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
18.(1)267.0
(2)62.5%
(3)解:设稀硫酸中溶质的质量分数为x
答:稀硫酸中溶质的质量分数为20%。
19.3.2g
20.(1)强;(2)6.4g
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
