第八章常见的酸碱盐基础练习题—2021—2022学年九年级化学科粤版(2012)下册(word版有答案)
文档属性
| 名称 | 第八章常见的酸碱盐基础练习题—2021—2022学年九年级化学科粤版(2012)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 314.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-05 17:22:01 | ||
图片预览




文档简介
第八章常见的酸碱盐基础练习题—2021—2022学年九年级化学科粤版(2012)下册
一、单选题
1.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
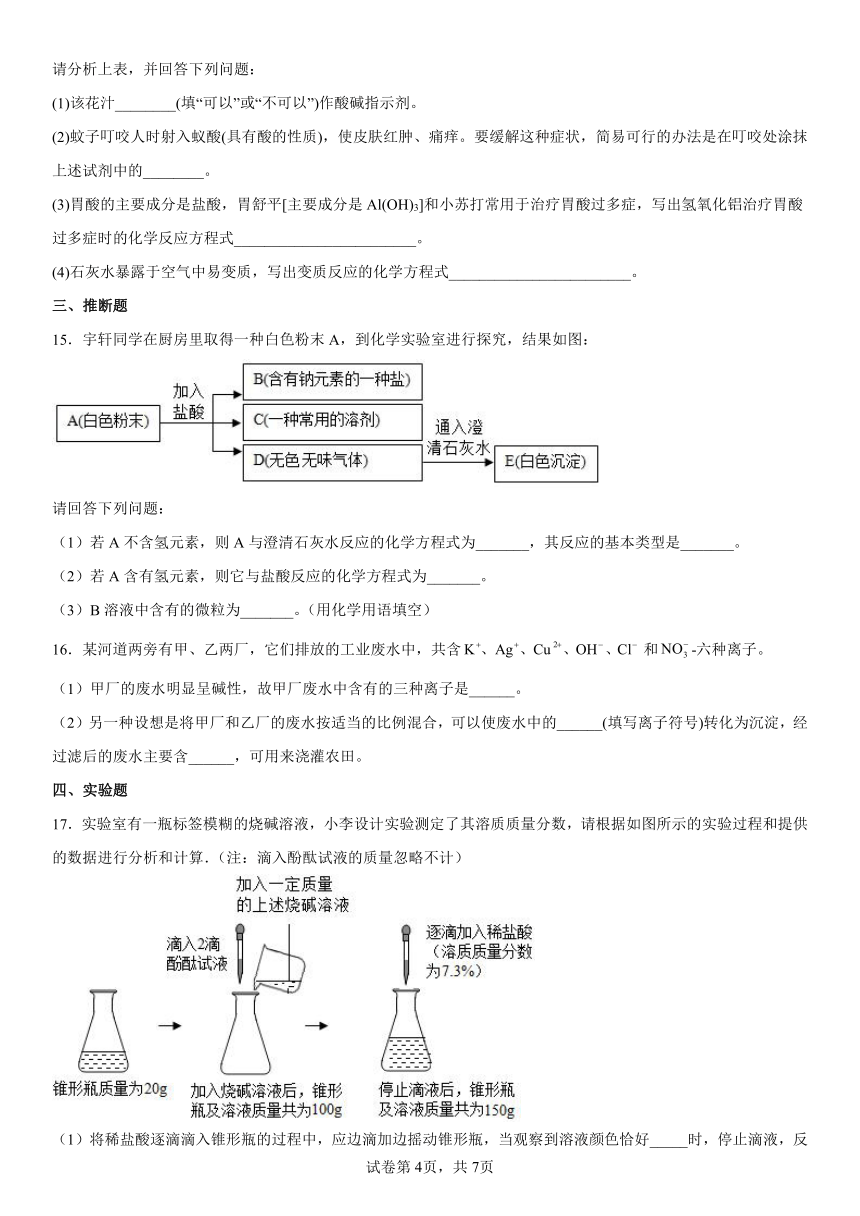
2.下图所示的有关化学实验操作正确的是
A.向试管中加入铁钉 B.检查装置气密性
C.稀释浓硫酸 D.倾倒少量盐酸
3.下列物质的名称、俗名与化学式完全相符的是( )
A.碳酸钠 小苏打 Na2CO3
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.二氧化碳 干冰 CO2
4.下列物质中,属于钾肥的是
A.NH4H2PO4 B.CO(NH2)2 C.Ca2 (PO4) 3 D.K2SO4
5.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
6.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
7.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
8.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
9.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
10.常温下,下列说法错误的是
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱
D.pH>10的土壤不适于种植农作物,因为碱性太强
11.推理是化学常用的思维方法。下列推理正确的是
A.单质是由一种元素组成的,因此由一种元素组成的纯净物一定是单质
B.浓硫酸具有吸水性,因此浓盐酸也具有吸水性
C.铁丝能在氧气中燃烧,空气中有氧气,因此铁丝也能在空气中燃烧
D.由金属离子和酸根离子组成的化合物是盐,因此盐中一定含有金属离子
二、简答题
12.物质世界是丰富多彩的,人类的生产、生活和化学密不可分。
(1)用适当的化学符号填空。
①汽水中含有的一种酸 ______ ②用来改良酸性土壤的碱 ______ ③用来配置波尔多液的盐 ______ ④可用作干燥剂的氧化物 ______
(2)以下是日常生活中常用各种清洗剂。
名称 洗涤灵 洁厕灵 炉具清洁剂 活氧彩漂 污渍爆炸盐
产品样式
有效成分或功能 清洁油污 盐酸 氢氧化钠 过氧化氢 过碳酸钠
①使用洗涤灵牌洗涤剂清洗餐具上的油污,这是因为它具有 ______ 功能。
②清除以下物质,可使用炉具清洁剂的是 ______ (填字母序号)。
A.铁锈 B.油污 C.水垢(主要成分CaCO3和Mg(OH)2)
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,加入少量二氧化锰,会产生少量气泡,产生该气体的化学方程式 _______ 。
④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中一定含有的阴离子是(用化学符号表示) ______ 。
13.“某饮用天然水”的广告中有如下画面(如图):
【情景描述】两个玻璃杯中分别盛有两种水样,其中一个盛“某饮用天然水”,另一个盛其他的水。水样中分别浸有试纸后,一杯的试纸呈现淡橘黄色(弱酸性),另一杯的试纸呈现淡绿色(弱碱性),广告提示大家:弱碱性的水对人体健康有利。请你回答:
(1)常温时,“某饮用天然水”的约为_____(填序号)。
A.4 B. C. D.14
(2)小茜同学看了图示中测定水样的方法后指出:这种测定方法是错误的,请你说出错在哪里?_______。用试纸测定溶液的应该______。
(3)请你判断:从(1)中选出的结果能用一般的试纸测出吗?______(填“能”或“不能”)。
14.某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如下表所示。
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液 石灰水
颜色 红 红 黄 黄 绿 绿 绿
请分析上表,并回答下列问题:
(1)该花汁________(填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的________。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分是Al(OH)3]和小苏打常用于治疗胃酸过多症,写出氢氧化铝治疗胃酸过多症时的化学反应方程式________________________。
(4)石灰水暴露于空气中易变质,写出变质反应的化学方程式________________________。
三、推断题
15.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
16.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含和-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是______。
(2)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______(填写离子符号)转化为沉淀,经过滤后的废水主要含______,可用来浇灌农田。
四、实验题
17.实验室有一瓶标签模糊的烧碱溶液,小李设计实验测定了其溶质质量分数,请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好_____时,停止滴液,反应所消耗稀盐酸的质量为_____g.
(2)烧碱与稀盐酸的反应类型是_____(基本反应类型)
(3)通过计算确定该瓶烧碱溶液的溶质质量分数是_____.(写出计算步骤)
18.用下图装置探究可燃物燃烧条件(装置气密性良好)。
已知:白磷的着火点为40℃。
步骤Ⅰ:点燃蜡烛,立即伸入瓶中并塞进瓶塞。
步骤Ⅱ:一段时间后,待蜡烛熄灭并冷却至室温,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞,观察到铝盒中的白磷燃烧。
(1)对比步骤Ⅰ中蜡烛点燃前后的现象,可得出可燃物燃烧的条件是_______。
(2)步骤Ⅱ中白磷燃烧的化学方程式为_______。
(3)分析上述实验,下列说法正确是_______(填序号)。
A 蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭
B 蜡烛燃烧后瓶内还有少量氧气,但氧气浓度过低导致蜡烛熄灭
C 生石灰的作用是与水反应提供热量,并利用生成物吸收二氧化碳
19.无土栽培是利用营养液栽培作物的一种方法.
(1)下列化学肥料中属于复合肥的是 __________ (填序号).
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 _________ g.
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如图所示的实验.
根据以上实验,请你进行有关推断.
①由实验1可确定原营养液中一定没有的物质是 _____________ ;
②根据实验1、实验2推测原营养液的组成可能有 ____________ 种情况;
③若测得原营养液中K+和Cl一的数目之比为1:1,则原营养液的组成中的溶质是 ____________ .
五、计算题
20.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
21.工业上常用煅烧石灰石的方法制取生石灰(氧化钙)和二氧化碳,某工厂现有石 灰石 125 吨,完全煅烧相关数据如图所示(杂质不参与反应)求:
(1)生成 CO2 的质量为_____t。
(2)所用石灰石中碳酸钙的质量分数。
22.某化工厂实验室用 10%的氢氧化钠溶液中和一定量的稀盐酸,共消耗氢氧化钠溶液 40克,反应后的溶液呈中性。试计算:
(1)配制 40 克 10%的氢氧化钠溶液,需要水的质量为_____克。
(2)一定量的盐酸中含 HCl 的质量。_____(写出过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.D
4.D
5.A
6.B
7.B
8.C
9.A
10.C
11.A
12. H2CO3 Ca(OH)2 CuSO4 CaO 乳化; B OH-和Cl-
13. C 直接将试纸放入玻璃杯的水样中是错误的 在白瓷板或玻璃片上放一小片试纸,用玻璃棒蘸取水样滴到试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出水样的 不能
14. 可以 肥皂水 Al(OH)3+3HCl===AlCl3+3H2O
Ca(OH)2+CO2===CaCO3↓+H2O
15. 复分解反应 Na+、Cl- 、H2O
16. 、、 、、、
17. 由红色变成无色 50g 复分解反应 5%
18. 温度达到着火点 4P+5O22P2O5 BC
19. ②③ 3 K2CO3 两 KCl、Ca(NO3)2
20.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
21.(1)44;
(2)解:设所用石灰石中碳酸钙的质量分数为x
x=80%
答:所用石灰石中碳酸钙的质量分数为80%。
22. 36 3.65g(详见解析)
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的性质与用途,不相匹配的是( )
A.氧气可以支持燃烧 工业上可用作燃料
B.氮气的化学性质定稳 工业上可用作焊接保护气
C.白醋含有醋酸,显酸性 家庭中可用作除水垢
D.硫酸钡既不溶于水,也不与酸反应 医疗上可用于“钡餐”造影
2.下图所示的有关化学实验操作正确的是
A.向试管中加入铁钉 B.检查装置气密性
C.稀释浓硫酸 D.倾倒少量盐酸
3.下列物质的名称、俗名与化学式完全相符的是( )
A.碳酸钠 小苏打 Na2CO3
B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO
D.二氧化碳 干冰 CO2
4.下列物质中,属于钾肥的是
A.NH4H2PO4 B.CO(NH2)2 C.Ca2 (PO4) 3 D.K2SO4
5.某无色混合气体可能由CH4、H2、CO、CO2和HCl中的若干种气体组成,将此混合气体通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使白色CuSO4粉末变蓝色。则原混合气体中一定含有
A.HCl和CO B.HC1、H2和CO2 C.CH4和H2 D.CO和CO2
6.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
7.硫酸厂的污水中含有硫酸,直接排放会导致河流水质酸化。为了除去污水中的硫酸,你建议选用的物质是
A. B. C. D.
8.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
9.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
10.常温下,下列说法错误的是
A.pH=2的溶液显酸性
B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱
D.pH>10的土壤不适于种植农作物,因为碱性太强
11.推理是化学常用的思维方法。下列推理正确的是
A.单质是由一种元素组成的,因此由一种元素组成的纯净物一定是单质
B.浓硫酸具有吸水性,因此浓盐酸也具有吸水性
C.铁丝能在氧气中燃烧,空气中有氧气,因此铁丝也能在空气中燃烧
D.由金属离子和酸根离子组成的化合物是盐,因此盐中一定含有金属离子
二、简答题
12.物质世界是丰富多彩的,人类的生产、生活和化学密不可分。
(1)用适当的化学符号填空。
①汽水中含有的一种酸 ______ ②用来改良酸性土壤的碱 ______ ③用来配置波尔多液的盐 ______ ④可用作干燥剂的氧化物 ______
(2)以下是日常生活中常用各种清洗剂。
名称 洗涤灵 洁厕灵 炉具清洁剂 活氧彩漂 污渍爆炸盐
产品样式
有效成分或功能 清洁油污 盐酸 氢氧化钠 过氧化氢 过碳酸钠
①使用洗涤灵牌洗涤剂清洗餐具上的油污,这是因为它具有 ______ 功能。
②清除以下物质,可使用炉具清洁剂的是 ______ (填字母序号)。
A.铁锈 B.油污 C.水垢(主要成分CaCO3和Mg(OH)2)
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,加入少量二氧化锰,会产生少量气泡,产生该气体的化学方程式 _______ 。
④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中一定含有的阴离子是(用化学符号表示) ______ 。
13.“某饮用天然水”的广告中有如下画面(如图):
【情景描述】两个玻璃杯中分别盛有两种水样,其中一个盛“某饮用天然水”,另一个盛其他的水。水样中分别浸有试纸后,一杯的试纸呈现淡橘黄色(弱酸性),另一杯的试纸呈现淡绿色(弱碱性),广告提示大家:弱碱性的水对人体健康有利。请你回答:
(1)常温时,“某饮用天然水”的约为_____(填序号)。
A.4 B. C. D.14
(2)小茜同学看了图示中测定水样的方法后指出:这种测定方法是错误的,请你说出错在哪里?_______。用试纸测定溶液的应该______。
(3)请你判断:从(1)中选出的结果能用一般的试纸测出吗?______(填“能”或“不能”)。
14.某同学把自制的一种黄色花汁,分别滴加到下列不同的试剂中,并记录观察到的现象如下表所示。
试剂 稀盐酸 食醋 蔗糖水 蒸馏水 肥皂水 烧碱溶液 石灰水
颜色 红 红 黄 黄 绿 绿 绿
请分析上表,并回答下列问题:
(1)该花汁________(填“可以”或“不可以”)作酸碱指示剂。
(2)蚊子叮咬人时射入蚁酸(具有酸的性质),使皮肤红肿、痛痒。要缓解这种症状,简易可行的办法是在叮咬处涂抹上述试剂中的________。
(3)胃酸的主要成分是盐酸,胃舒平[主要成分是Al(OH)3]和小苏打常用于治疗胃酸过多症,写出氢氧化铝治疗胃酸过多症时的化学反应方程式________________________。
(4)石灰水暴露于空气中易变质,写出变质反应的化学方程式________________________。
三、推断题
15.宇轩同学在厨房里取得一种白色粉末A,到化学实验室进行探究,结果如图:
请回答下列问题:
(1)若A不含氢元素,则A与澄清石灰水反应的化学方程式为_______,其反应的基本类型是_______。
(2)若A含有氢元素,则它与盐酸反应的化学方程式为_______。
(3)B溶液中含有的微粒为_______。(用化学用语填空)
16.某河道两旁有甲、乙两厂,它们排放的工业废水中,共含和-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是______。
(2)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______(填写离子符号)转化为沉淀,经过滤后的废水主要含______,可用来浇灌农田。
四、实验题
17.实验室有一瓶标签模糊的烧碱溶液,小李设计实验测定了其溶质质量分数,请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好_____时,停止滴液,反应所消耗稀盐酸的质量为_____g.
(2)烧碱与稀盐酸的反应类型是_____(基本反应类型)
(3)通过计算确定该瓶烧碱溶液的溶质质量分数是_____.(写出计算步骤)
18.用下图装置探究可燃物燃烧条件(装置气密性良好)。
已知:白磷的着火点为40℃。
步骤Ⅰ:点燃蜡烛,立即伸入瓶中并塞进瓶塞。
步骤Ⅱ:一段时间后,待蜡烛熄灭并冷却至室温,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞,观察到铝盒中的白磷燃烧。
(1)对比步骤Ⅰ中蜡烛点燃前后的现象,可得出可燃物燃烧的条件是_______。
(2)步骤Ⅱ中白磷燃烧的化学方程式为_______。
(3)分析上述实验,下列说法正确是_______(填序号)。
A 蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭
B 蜡烛燃烧后瓶内还有少量氧气,但氧气浓度过低导致蜡烛熄灭
C 生石灰的作用是与水反应提供热量,并利用生成物吸收二氧化碳
19.无土栽培是利用营养液栽培作物的一种方法.
(1)下列化学肥料中属于复合肥的是 __________ (填序号).
①硝酸铵 ②磷酸二氢铵 ③硝酸钾 ④硫酸
(2)某同学要在实验室配制150g溶质质量分数为2%的硝酸钾溶液,需要硝酸钾的质量为 _________ g.
(3)现有一种无色的营养液,可能由KNO3、Ca(NO3)2、K2CO3、KCl中的一种或几种物质组成,为探究其成分,某同学设计并完成了如图所示的实验.
根据以上实验,请你进行有关推断.
①由实验1可确定原营养液中一定没有的物质是 _____________ ;
②根据实验1、实验2推测原营养液的组成可能有 ____________ 种情况;
③若测得原营养液中K+和Cl一的数目之比为1:1,则原营养液的组成中的溶质是 ____________ .
五、计算题
20.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
21.工业上常用煅烧石灰石的方法制取生石灰(氧化钙)和二氧化碳,某工厂现有石 灰石 125 吨,完全煅烧相关数据如图所示(杂质不参与反应)求:
(1)生成 CO2 的质量为_____t。
(2)所用石灰石中碳酸钙的质量分数。
22.某化工厂实验室用 10%的氢氧化钠溶液中和一定量的稀盐酸,共消耗氢氧化钠溶液 40克,反应后的溶液呈中性。试计算:
(1)配制 40 克 10%的氢氧化钠溶液,需要水的质量为_____克。
(2)一定量的盐酸中含 HCl 的质量。_____(写出过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.D
4.D
5.A
6.B
7.B
8.C
9.A
10.C
11.A
12. H2CO3 Ca(OH)2 CuSO4 CaO 乳化; B OH-和Cl-
13. C 直接将试纸放入玻璃杯的水样中是错误的 在白瓷板或玻璃片上放一小片试纸,用玻璃棒蘸取水样滴到试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出水样的 不能
14. 可以 肥皂水 Al(OH)3+3HCl===AlCl3+3H2O
Ca(OH)2+CO2===CaCO3↓+H2O
15. 复分解反应 Na+、Cl- 、H2O
16. 、、 、、、
17. 由红色变成无色 50g 复分解反应 5%
18. 温度达到着火点 4P+5O22P2O5 BC
19. ②③ 3 K2CO3 两 KCl、Ca(NO3)2
20.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
21.(1)44;
(2)解:设所用石灰石中碳酸钙的质量分数为x
x=80%
答:所用石灰石中碳酸钙的质量分数为80%。
22. 36 3.65g(详见解析)
答案第1页,共2页
答案第1页,共2页
