第11章酸与碱单元检测题—2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第11章酸与碱单元检测题—2021-2022学年九年级化学京改版(2013)下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 204.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 00:00:00 | ||
图片预览


文档简介
第11章酸与碱单元检测题—2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列化学变化中吸收热量的是
A.高温煅烧石灰石 B.红磷在氧气中的燃烧
C.锌和稀硫酸的反应 D.生石灰与水反应
2.能使紫色石蕊试液变红的是
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
3.在滴有紫色石蕊试液的稀硫酸中,分别加入过量下列物质,溶液仍为红色的是( )
A.CaO B.BaCl2 C.Na2CO3 D.Ca(OH)2
4.有关浓硫酸的说法,错误的是
A.浓硫酸具有吸水性,在实验室中常用作干燥剂
B.浓硫酸具有强腐蚀性,它能使纸张、布料、皮肤等脱水碳化
C.浓硫酸溶于水时会吸收大量的热,可作制冷剂
D.如果不慎将张硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂3%~5%的碳酸氢钠溶液
5.小正同学测得下列水果的pH值,其中酸性最强的是( )
A.葡萄pH=4.5 B.菠萝pH=4.1
C.柠檬pH=2.2 D.草莓pH=3.1
6.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
7.分类是学习化学的方法之一,下列各组物质按单质、氧化物、酸的顺序排列的一组是
A.Zn、CO2、H3PO4 B.H2、H2O、KClO3 C.O2、NaOH、H2SO4 D.CO、MgO、NaHSO4
8.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
9.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
10.下列化学实验中能达到预期实验结果的是( )
A.借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B.用pH试纸测定某未知溶液的pH为5.5
C.20℃时,配制2%的氢氧化钙溶液
D.将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
二、简答题
11.山西的酒文化、醋文化驰名中外,陈年老酒,醇香四溢,从微观角度看,产生这一现象的原因_____。食醋是餐桌上常见的调味品。它呈酸性,主要是因为食醋中含有的物质是_____。
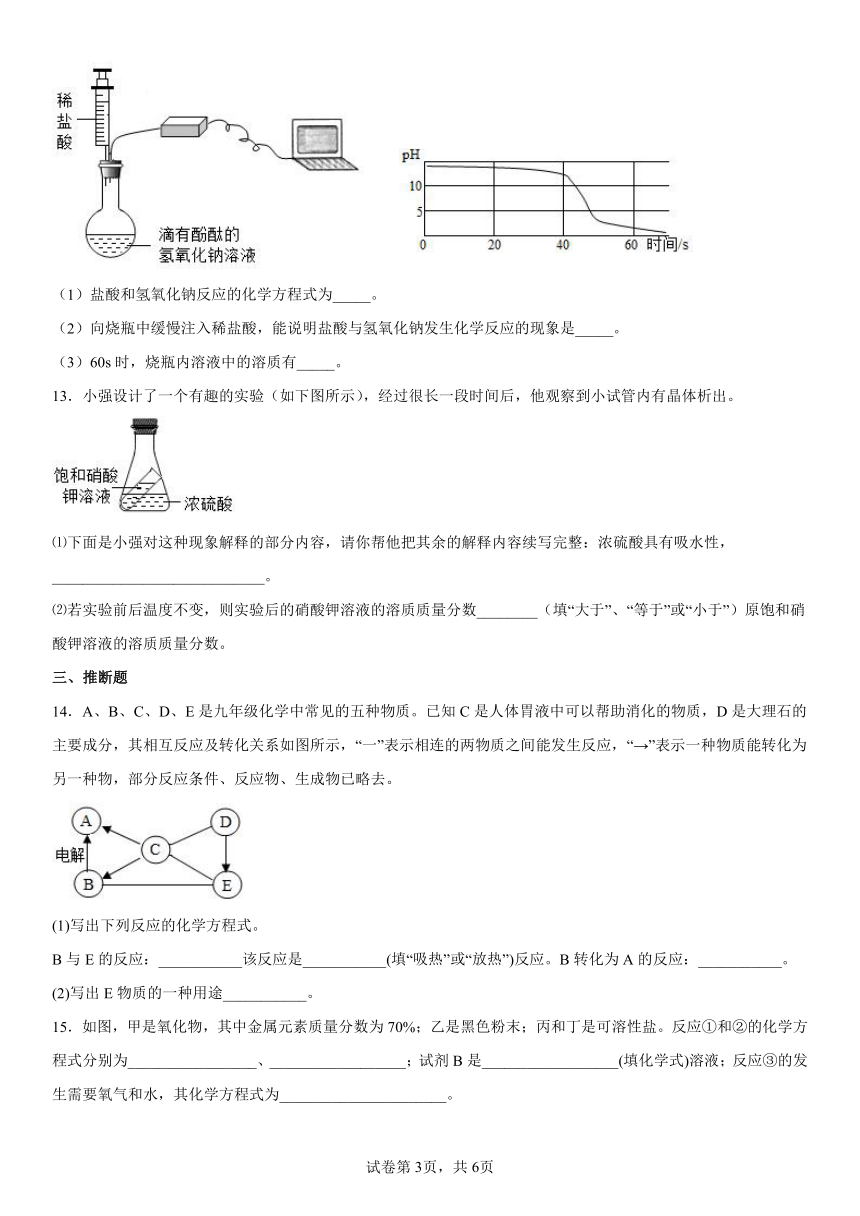
12.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的现象是_____。
(3)60s时,烧瓶内溶液中的溶质有_____。
13.小强设计了一个有趣的实验(如下图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
⑴下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性,____________________________。
⑵若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数________(填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
三、推断题
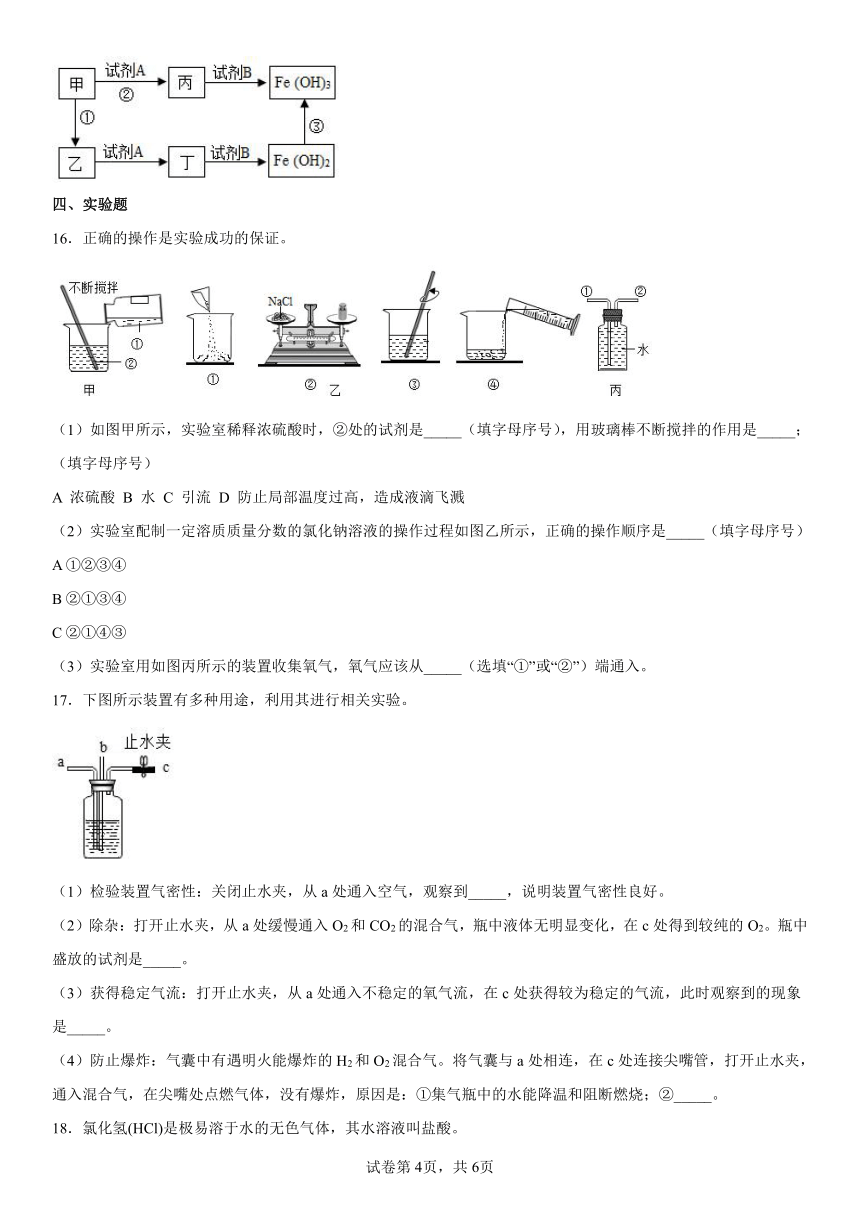
14.A、B、C、D、E是九年级化学中常见的五种物质。已知C是人体胃液中可以帮助消化的物质,D是大理石的主要成分,其相互反应及转化关系如图所示,“一”表示相连的两物质之间能发生反应,“→”表示一种物质能转化为另一种物,部分反应条件、反应物、生成物已略去。
(1)写出下列反应的化学方程式。
B与E的反应:___________该反应是___________(填“吸热”或“放热”)反应。B转化为A的反应:___________。
(2)写出E物质的一种用途___________。
15.如图,甲是氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为_________________、__________________;试剂B是__________________(填化学式)溶液;反应③的发生需要氧气和水,其化学方程式为______________________。
四、实验题
16.正确的操作是实验成功的保证。
(1)如图甲所示,实验室稀释浓硫酸时,②处的试剂是_____(填字母序号),用玻璃棒不断搅拌的作用是_____;(填字母序号)
A 浓硫酸 B 水 C 引流 D 防止局部温度过高,造成液滴飞溅
(2)实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是_____(填字母序号)
A ①②③④
B ②①③④
C ②①④③
(3)实验室用如图丙所示的装置收集氧气,氧气应该从_____(选填“①”或“②”)端通入。
17.下图所示装置有多种用途,利用其进行相关实验。
(1)检验装置气密性:关闭止水夹,从a处通入空气,观察到_____,说明装置气密性良好。
(2)除杂:打开止水夹,从a处缓慢通入O2和CO2的混合气,瓶中液体无明显变化,在c处得到较纯的O2。瓶中盛放的试剂是_____。
(3)获得稳定气流:打开止水夹,从a处通入不稳定的氧气流,在c处获得较为稳定的气流,此时观察到的现象是_____。
(4)防止爆炸:气囊中有遇明火能爆炸的H2和O2混合气。将气囊与a处相连,在c处连接尖嘴管,打开止水夹,通入混合气,在尖嘴处点燃气体,没有爆炸,原因是:①集气瓶中的水能降温和阻断燃烧;②_____。
18.氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________________________________。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是_____________________,发生反应的化学方程式是___________________。
(3) 画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注_______________(水分子不用画出)。
五、计算题
19.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
20.小明想测定部分变质的熟石灰样品中Ca(OH)2的质量分数,他称取0.5g该样品,加足量水使之充分溶解,搅拌过滤后,在滤液中加入10%盐酸溶液,加入盐酸溶液的质量和溶液的pH见表。
加入盐酸溶液的质量/g 0 2.5 3.65 6
溶液的pH 12 11 7 2
(1)当pH=2时,溶液中所含的溶质是_____(写化学式)。
(2)求样品中Ca(OH)2的质量分数_____。(写出计算过程)
21.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶段加入,溶液液的pH的变化如图所示。试回答:
(1)a点溶液中含有的离子有____________________________。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.C
6.C
7.A
8.D
9.B
10.A
11. 分子是在不断运动的 醋酸
12. NaOH+HCl=NaCl+H2O 红色溶液变为无色,pH逐渐减小至小于7 NaCl、HCl
13. 可以吸收硝酸钾溶液中挥发出的水分,使饱和溶液中的溶剂减少,溶质析出 等于
14. 放热 2H2O2H2↑+O2↑ 做食品干燥剂
15. Fe2O3+3CO2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O NaOH
4Fe(OH)2+O2+2H2O=4Fe(OH)3
16. B D C ②
17. b管中的液面升高到一定高度后保持不变 NaOH溶液 b管中的液面上下移动 b管能调节装置内的压强
18. 染有石蕊的纸条变红色 固体溶解,有气泡产生
19.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
20.(1)HCl、CaCl2(2)74%
21.(1)Na+、H+、 SO42-
(2)0.8
(3)9.8%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列化学变化中吸收热量的是
A.高温煅烧石灰石 B.红磷在氧气中的燃烧
C.锌和稀硫酸的反应 D.生石灰与水反应
2.能使紫色石蕊试液变红的是
A.蒸馏水 B.盐酸 C.食盐水 D.石灰水
3.在滴有紫色石蕊试液的稀硫酸中,分别加入过量下列物质,溶液仍为红色的是( )
A.CaO B.BaCl2 C.Na2CO3 D.Ca(OH)2
4.有关浓硫酸的说法,错误的是
A.浓硫酸具有吸水性,在实验室中常用作干燥剂
B.浓硫酸具有强腐蚀性,它能使纸张、布料、皮肤等脱水碳化
C.浓硫酸溶于水时会吸收大量的热,可作制冷剂
D.如果不慎将张硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂3%~5%的碳酸氢钠溶液
5.小正同学测得下列水果的pH值,其中酸性最强的是( )
A.葡萄pH=4.5 B.菠萝pH=4.1
C.柠檬pH=2.2 D.草莓pH=3.1
6.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
7.分类是学习化学的方法之一,下列各组物质按单质、氧化物、酸的顺序排列的一组是
A.Zn、CO2、H3PO4 B.H2、H2O、KClO3 C.O2、NaOH、H2SO4 D.CO、MgO、NaHSO4
8.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
9.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
10.下列化学实验中能达到预期实验结果的是( )
A.借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B.用pH试纸测定某未知溶液的pH为5.5
C.20℃时,配制2%的氢氧化钙溶液
D.将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
二、简答题
11.山西的酒文化、醋文化驰名中外,陈年老酒,醇香四溢,从微观角度看,产生这一现象的原因_____。食醋是餐桌上常见的调味品。它呈酸性,主要是因为食醋中含有的物质是_____。
12.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的现象是_____。
(3)60s时,烧瓶内溶液中的溶质有_____。
13.小强设计了一个有趣的实验(如下图所示),经过很长一段时间后,他观察到小试管内有晶体析出。
⑴下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性,____________________________。
⑵若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数________(填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
三、推断题
14.A、B、C、D、E是九年级化学中常见的五种物质。已知C是人体胃液中可以帮助消化的物质,D是大理石的主要成分,其相互反应及转化关系如图所示,“一”表示相连的两物质之间能发生反应,“→”表示一种物质能转化为另一种物,部分反应条件、反应物、生成物已略去。
(1)写出下列反应的化学方程式。
B与E的反应:___________该反应是___________(填“吸热”或“放热”)反应。B转化为A的反应:___________。
(2)写出E物质的一种用途___________。
15.如图,甲是氧化物,其中金属元素质量分数为70%;乙是黑色粉末;丙和丁是可溶性盐。反应①和②的化学方程式分别为_________________、__________________;试剂B是__________________(填化学式)溶液;反应③的发生需要氧气和水,其化学方程式为______________________。
四、实验题
16.正确的操作是实验成功的保证。
(1)如图甲所示,实验室稀释浓硫酸时,②处的试剂是_____(填字母序号),用玻璃棒不断搅拌的作用是_____;(填字母序号)
A 浓硫酸 B 水 C 引流 D 防止局部温度过高,造成液滴飞溅
(2)实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是_____(填字母序号)
A ①②③④
B ②①③④
C ②①④③
(3)实验室用如图丙所示的装置收集氧气,氧气应该从_____(选填“①”或“②”)端通入。
17.下图所示装置有多种用途,利用其进行相关实验。
(1)检验装置气密性:关闭止水夹,从a处通入空气,观察到_____,说明装置气密性良好。
(2)除杂:打开止水夹,从a处缓慢通入O2和CO2的混合气,瓶中液体无明显变化,在c处得到较纯的O2。瓶中盛放的试剂是_____。
(3)获得稳定气流:打开止水夹,从a处通入不稳定的氧气流,在c处获得较为稳定的气流,此时观察到的现象是_____。
(4)防止爆炸:气囊中有遇明火能爆炸的H2和O2混合气。将气囊与a处相连,在c处连接尖嘴管,打开止水夹,通入混合气,在尖嘴处点燃气体,没有爆炸,原因是:①集气瓶中的水能降温和阻断燃烧;②_____。
18.氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)在充满HCl气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水,现象是___________________________________________________。
(2)向盛有NaHCO3粉末的试管中通入HCl气体,无明显现象;停止通气,再加入少量水,现象是_____________________,发生反应的化学方程式是___________________。
(3) 画出HCl气体和盐酸的微观粒子组成示意图,并进行必要的标注_______________(水分子不用画出)。
五、计算题
19.正常情况下人的胃液pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃液中HCl过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.49%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_____性。
(2)人的胃液总量为100mL,正常人胃液中HCl的质量范围是_____g。
(3)服用碱性药品可以治疗胃液中HCl含量过多,你认为该患者_____(填“能”或“不能”)服用氢氧化钠来治疗胃液中过多,理由是_____。
(4)医生给患者开的药品为胃舒平[有效成分是Al(OH)3],每片胃舒平平含Al(OH)3的质量为0.39g。请根据化学方程式计算该患者至少服用多少片的胃舒平,胃液才能恢复正常?(请写出计算过程)_______________
20.小明想测定部分变质的熟石灰样品中Ca(OH)2的质量分数,他称取0.5g该样品,加足量水使之充分溶解,搅拌过滤后,在滤液中加入10%盐酸溶液,加入盐酸溶液的质量和溶液的pH见表。
加入盐酸溶液的质量/g 0 2.5 3.65 6
溶液的pH 12 11 7 2
(1)当pH=2时,溶液中所含的溶质是_____(写化学式)。
(2)求样品中Ca(OH)2的质量分数_____。(写出计算过程)
21.实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶段加入,溶液液的pH的变化如图所示。试回答:
(1)a点溶液中含有的离子有____________________________。
(2)当pH=7时,消耗NaOH溶液中NaOH的质量为____________。
(3)计算稀H2SO4的溶质质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.C
6.C
7.A
8.D
9.B
10.A
11. 分子是在不断运动的 醋酸
12. NaOH+HCl=NaCl+H2O 红色溶液变为无色,pH逐渐减小至小于7 NaCl、HCl
13. 可以吸收硝酸钾溶液中挥发出的水分,使饱和溶液中的溶剂减少,溶质析出 等于
14. 放热 2H2O2H2↑+O2↑ 做食品干燥剂
15. Fe2O3+3CO2Fe+3CO2 Fe2O3+6HCl=2FeCl3+3H2O NaOH
4Fe(OH)2+O2+2H2O=4Fe(OH)3
16. B D C ②
17. b管中的液面升高到一定高度后保持不变 NaOH溶液 b管中的液面上下移动 b管能调节装置内的压强
18. 染有石蕊的纸条变红色 固体溶解,有气泡产生
19.(1)酸(2)0.2~0.4(3)不能;氢氧化钠有很强的腐蚀性(4)2片
20.(1)HCl、CaCl2(2)74%
21.(1)Na+、H+、 SO42-
(2)0.8
(3)9.8%
答案第1页,共2页
答案第1页,共2页
