第12章 盐 单元测试-2021-2022学年九年级化学京改版(2013)下册(word版 含答案)
文档属性
| 名称 | 第12章 盐 单元测试-2021-2022学年九年级化学京改版(2013)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 120.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 11:04:18 | ||
图片预览


文档简介
第12章盐章末复习题—2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列实验能用来验证质量守恒定律、且能看到天平保持平衡现象的是
A.在空气中对铜片加热
B.氯化钠和硝酸钾混合
C.铜和硝酸银溶液混合
D.红磷在空气中燃烧
2.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
3.下列选项中物质的俗称、化学式、类别、用途对应正确的是
A.烧碱、Na2CO3、碱、制玻璃 B.生石灰、CaO、化合物、作干燥剂
C.食盐、NaCl、盐、除铁锈 D.酒精、C2H6O、氧化物、作燃料
4.星期天,小明同学回家发现自家田里的小麦出现大面积倒伏现象,就向其父母提出了一条合理化建议:明年应在小麦生长期增施抗倒伏的化肥,你认为增施的化肥是
A.NH4NO3 B.KCl C.Ca(H2PO4)2 D.CO(NH2)2
5.在pH=3的溶液中,下列离子可以大量共存的是
A.Cu2+ K+ NO
B.Ag+ Na+ Cl-
C.Na+ Ba2+ OH-
D.K+ Ba 2+ SO
6.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
7.化学实验探究活动中,小明对某溶液溶质成分的几种猜测中合理的是( )
A.H2SO4 NaOH NaCl B.KNO3 NaCl CuSO4
C.Na2CO3 NH4Cl HCl D.MgCl2 Na2SO4 KOH
8.已知,常温下氯化钙、氯化钠的水溶液均呈中性,向含有盐酸和氯化钙的混合溶液中逐滴滴入过量的x,溶液pH与滴入x的量的关系如图所示,则x可能是下列物质中的( )
A.水 B.氢氧化钠溶液 C.纯碱溶液 D.硝酸银溶液
9.要鉴别NaCl、MgCl2、酚酞三瓶无色溶液,可选用下列试剂中的
A.AgNO3溶液 B.HCl溶液 C.石蕊试液 D.NaOH溶液
10.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
11.某钠盐溶液中含有Cl﹣、OH﹣、CO32﹣三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来,正确的实验操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A.①②④②③ B.④②①②③ C.③②①②④ D.④②③②①
二、简答题
12.(1)生活中处处有化学.请按要求将下列各组物质的序号填到横线上;①尿素、磷铵、硫酸钾;②塑料、合成纤维、合成橡胶;③铜、钢材、铝合金;④无机盐、糖类、维生素;⑤天然气、汽油、煤.
常用作燃料的是_____;常见的金属材料是_____;常见的有机合成材料是_____;人类重要的营养素是_____;常用的化学肥料是_____.
(2)锂(Li)电池因质量轻、能量密度高、充电快被广泛应用.锂原子核内有_____个质子,在反应中容易_____(填“得到”或“失去”)1个电子,锂离子符号为_____.
13.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
14.凉山州初中化学实验试题:向酸性硫酸铜溶液中滴加氢氧化钠溶液,出现了如下图关系。
(1)试写出Ot1线段发生的化学反应方程式。
(2)写出生成蓝色沉淀的化学方程式。
三、推断题
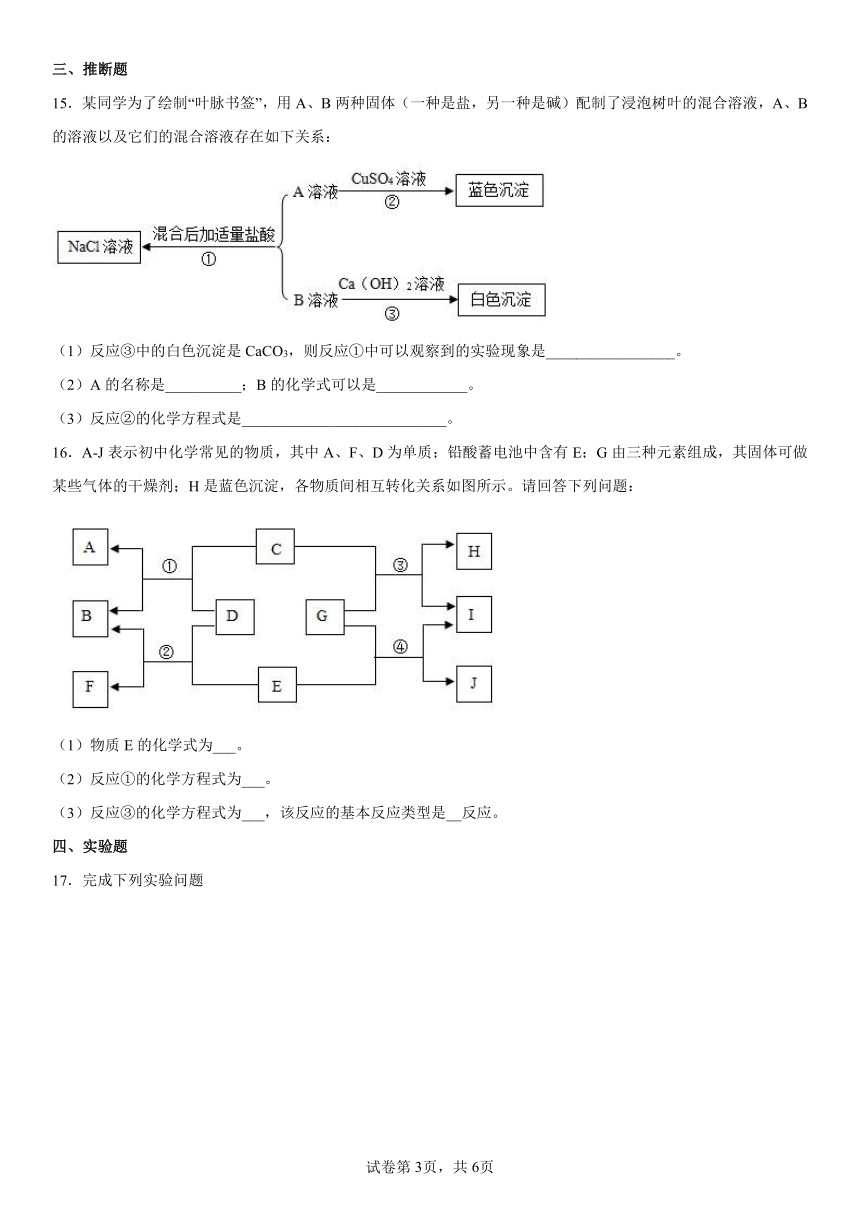
15.某同学为了绘制“叶脉书签”,用A、B两种固体(一种是盐,另一种是碱)配制了浸泡树叶的混合溶液,A、B的溶液以及它们的混合溶液存在如下关系:
(1)反应③中的白色沉淀是CaCO3,则反应①中可以观察到的实验现象是_________________。
(2)A的名称是__________;B的化学式可以是____________。
(3)反应②的化学方程式是___________________________。
16.A-J表示初中化学常见的物质,其中A、F、D为单质;铅酸蓄电池中含有E;G由三种元素组成,其固体可做某些气体的干燥剂;H是蓝色沉淀,各物质间相互转化关系如图所示。请回答下列问题:
(1)物质E的化学式为___。
(2)反应①的化学方程式为___。
(3)反应③的化学方程式为___,该反应的基本反应类型是__反应。
四、实验题
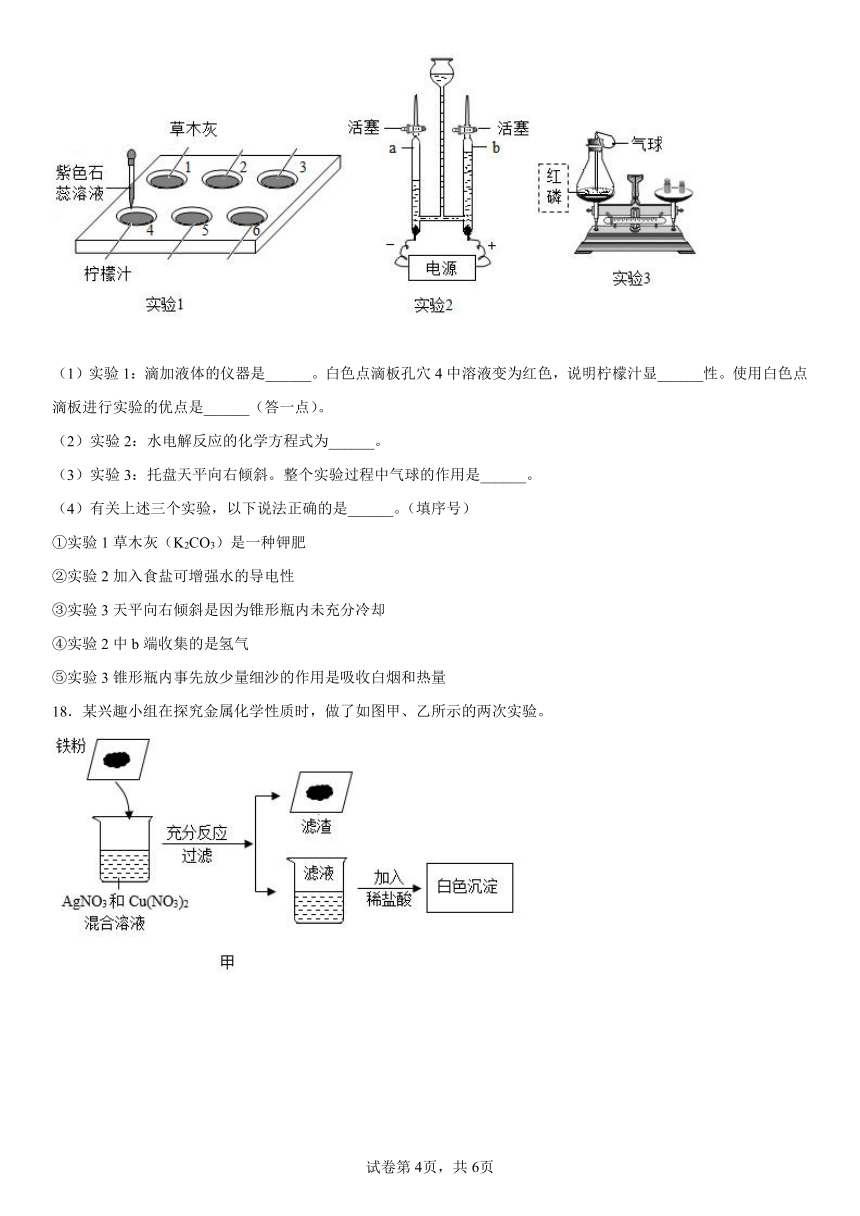
17.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
18.某兴趣小组在探究金属化学性质时,做了如图甲、乙所示的两次实验。
(1)甲实验中滤渣的成分是______,产生白色沉淀的化学反应方程式为______。
(2)乙实验中滤液中含有的金属离子为______(填离子符号)。
19.利用下图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是_______。A中观察到的现象是_______。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是_______。
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.某石灰矿运来125t的石灰石,高温煅烧至质量不再减少,冷却称得剩余固体的质量为81t,已知石灰石中杂质不分解,石灰石中的主要成分碳酸钙高温煅烧得到氧化钙和二氧化碳。试求:(写出计算过程)
(1)生成的气体质量;
(2)这种石灰石的纯度。
22.某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到50g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是145.6g。将所得溶液蒸干,得到15.6g硫酸钠。试计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中硫酸钠的质量分数(计算结果精确到0.1%)
23.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.B
4.B
5.A
6.C
7.B
8.C
9.D
10.C
11.B
12. ⑤ ③ ② ④ ① 3 失去 Li+
13. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
14.(1)H2SO4+2NaOH=== Na2SO4+2H2O
15.(1)有气泡产生(2)氢氧化钠 Na2CO3
16. H2SO4 Fe+CuSO4=FeSO4+Cu CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 复分解
17. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
18. 银 Fe2+
19.
导管口有气泡冒出,澄清石灰水变浑浊 CaCl2、NaCl
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)125t-81t=44t;
(2)解:设这种石灰石的纯度为x
答:这种石灰石的纯度为80%
22.(1);(2)11.7%
23.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列实验能用来验证质量守恒定律、且能看到天平保持平衡现象的是
A.在空气中对铜片加热
B.氯化钠和硝酸钾混合
C.铜和硝酸银溶液混合
D.红磷在空气中燃烧
2.下列化学肥料中属于复合肥料的是
A.硫酸钾(K2SO4) B.磷酸二氢钾(KH2PO4)
C.硝酸铵(NH4NO3) D.尿素[CO(NH2)2]
3.下列选项中物质的俗称、化学式、类别、用途对应正确的是
A.烧碱、Na2CO3、碱、制玻璃 B.生石灰、CaO、化合物、作干燥剂
C.食盐、NaCl、盐、除铁锈 D.酒精、C2H6O、氧化物、作燃料
4.星期天,小明同学回家发现自家田里的小麦出现大面积倒伏现象,就向其父母提出了一条合理化建议:明年应在小麦生长期增施抗倒伏的化肥,你认为增施的化肥是
A.NH4NO3 B.KCl C.Ca(H2PO4)2 D.CO(NH2)2
5.在pH=3的溶液中,下列离子可以大量共存的是
A.Cu2+ K+ NO
B.Ag+ Na+ Cl-
C.Na+ Ba2+ OH-
D.K+ Ba 2+ SO
6.下列物质的用途,利用了其物理性质的是
A.生石灰用作干燥剂 B.铁粉用作食品保鲜吸氧剂
C.氦气填充飞艇 D.小苏打用于治疗胃酸过多
7.化学实验探究活动中,小明对某溶液溶质成分的几种猜测中合理的是( )
A.H2SO4 NaOH NaCl B.KNO3 NaCl CuSO4
C.Na2CO3 NH4Cl HCl D.MgCl2 Na2SO4 KOH
8.已知,常温下氯化钙、氯化钠的水溶液均呈中性,向含有盐酸和氯化钙的混合溶液中逐滴滴入过量的x,溶液pH与滴入x的量的关系如图所示,则x可能是下列物质中的( )
A.水 B.氢氧化钠溶液 C.纯碱溶液 D.硝酸银溶液
9.要鉴别NaCl、MgCl2、酚酞三瓶无色溶液,可选用下列试剂中的
A.AgNO3溶液 B.HCl溶液 C.石蕊试液 D.NaOH溶液
10.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
11.某钠盐溶液中含有Cl﹣、OH﹣、CO32﹣三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来,正确的实验操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A.①②④②③ B.④②①②③ C.③②①②④ D.④②③②①
二、简答题
12.(1)生活中处处有化学.请按要求将下列各组物质的序号填到横线上;①尿素、磷铵、硫酸钾;②塑料、合成纤维、合成橡胶;③铜、钢材、铝合金;④无机盐、糖类、维生素;⑤天然气、汽油、煤.
常用作燃料的是_____;常见的金属材料是_____;常见的有机合成材料是_____;人类重要的营养素是_____;常用的化学肥料是_____.
(2)锂(Li)电池因质量轻、能量密度高、充电快被广泛应用.锂原子核内有_____个质子,在反应中容易_____(填“得到”或“失去”)1个电子,锂离子符号为_____.
13.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
14.凉山州初中化学实验试题:向酸性硫酸铜溶液中滴加氢氧化钠溶液,出现了如下图关系。
(1)试写出Ot1线段发生的化学反应方程式。
(2)写出生成蓝色沉淀的化学方程式。
三、推断题
15.某同学为了绘制“叶脉书签”,用A、B两种固体(一种是盐,另一种是碱)配制了浸泡树叶的混合溶液,A、B的溶液以及它们的混合溶液存在如下关系:
(1)反应③中的白色沉淀是CaCO3,则反应①中可以观察到的实验现象是_________________。
(2)A的名称是__________;B的化学式可以是____________。
(3)反应②的化学方程式是___________________________。
16.A-J表示初中化学常见的物质,其中A、F、D为单质;铅酸蓄电池中含有E;G由三种元素组成,其固体可做某些气体的干燥剂;H是蓝色沉淀,各物质间相互转化关系如图所示。请回答下列问题:
(1)物质E的化学式为___。
(2)反应①的化学方程式为___。
(3)反应③的化学方程式为___,该反应的基本反应类型是__反应。
四、实验题
17.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
18.某兴趣小组在探究金属化学性质时,做了如图甲、乙所示的两次实验。
(1)甲实验中滤渣的成分是______,产生白色沉淀的化学反应方程式为______。
(2)乙实验中滤液中含有的金属离子为______(填离子符号)。
19.利用下图装置进行实验(夹持装置略去)。实验前K1、K2和K3均已关闭。
(1)打开K1和K2,滴入部分碳酸钠溶液,关闭K1。B中发生反应的化学方程式是_______。A中观察到的现象是_______。
(2)关闭K2、打开K3和K1,滴入碳酸钠溶液,关闭K1。观察到B中的液体流入C中,一段时间后,C中溶液澄清且无色,此时C中一定含有的溶质是_______。
五、计算题
20.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
21.某石灰矿运来125t的石灰石,高温煅烧至质量不再减少,冷却称得剩余固体的质量为81t,已知石灰石中杂质不分解,石灰石中的主要成分碳酸钙高温煅烧得到氧化钙和二氧化碳。试求:(写出计算过程)
(1)生成的气体质量;
(2)这种石灰石的纯度。
22.某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到50g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是145.6g。将所得溶液蒸干,得到15.6g硫酸钠。试计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中硫酸钠的质量分数(计算结果精确到0.1%)
23.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.B
4.B
5.A
6.C
7.B
8.C
9.D
10.C
11.B
12. ⑤ ③ ② ④ ① 3 失去 Li+
13. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
14.(1)H2SO4+2NaOH=== Na2SO4+2H2O
15.(1)有气泡产生(2)氢氧化钠 Na2CO3
16. H2SO4 Fe+CuSO4=FeSO4+Cu CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 复分解
17. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
18. 银 Fe2+
19.
导管口有气泡冒出,澄清石灰水变浑浊 CaCl2、NaCl
20.(1) 大 快 (或 小 慢) (2)75%
21.(1)125t-81t=44t;
(2)解:设这种石灰石的纯度为x
答:这种石灰石的纯度为80%
22.(1);(2)11.7%
23.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
答案第1页,共2页
答案第1页,共2页
