2021-2022学年高二下学期化学苏教版(2019)选择性必修3-4.2.2羧酸的性质与应用课件(17张ppt)
文档属性
| 名称 | 2021-2022学年高二下学期化学苏教版(2019)选择性必修3-4.2.2羧酸的性质与应用课件(17张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
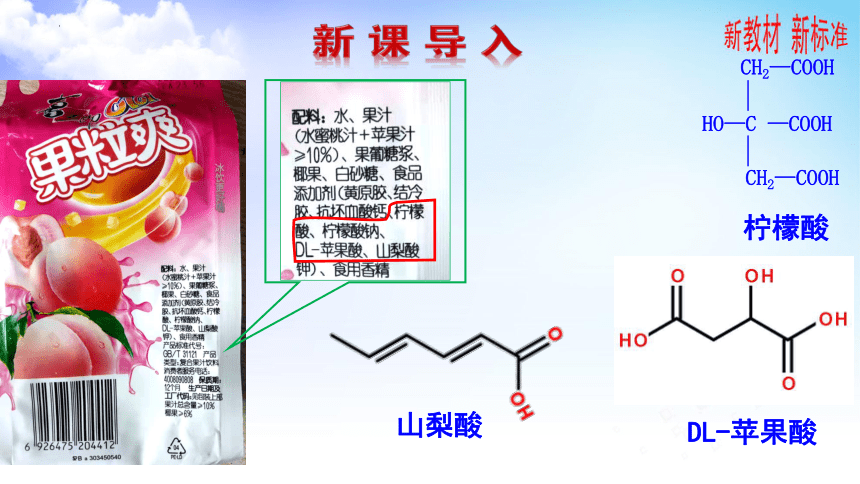
第二单元 羧酸的性质及应用
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
2、羧酸的分类:
烃基饱和度
羧基数目
不饱和脂肪酸
一元羧酸
二元羧酸
多元羧酸
碳原子个数
低级脂肪酸
高级脂肪酸
一、羧酸
1、羧酸的概念:
由烃基(或氢原子)与羧基相连构成的有机化合物。
饱和脂肪酸
羧基连烃基不同
脂肪酸
芳香酸
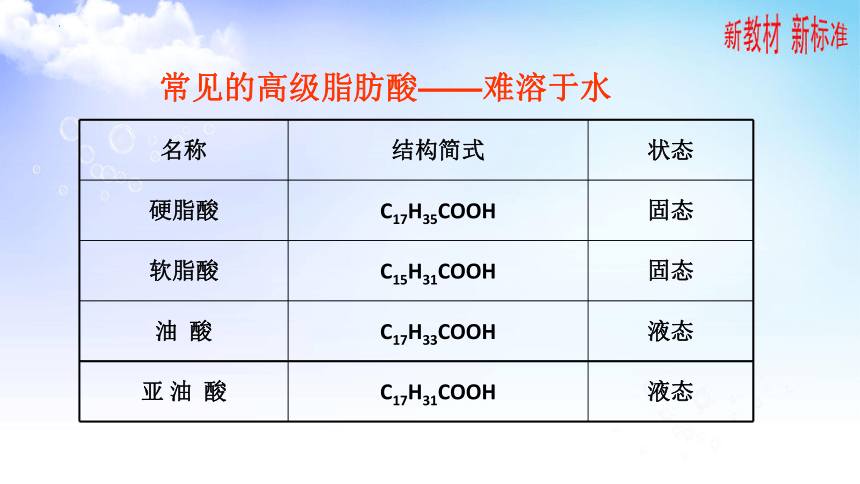
常见的高级脂肪酸——难溶于水
名称 结构简式 状态
硬脂酸 C17H35COOH 固态
软脂酸 C15H31COOH 固态
油 酸 C17H33COOH 液态
亚 油 酸 C17H31COOH 液态
二、乙酸的性质
1、乙酸的物理性质
状态:
气味:
溶解性:
溶沸点:
无色液体
有强烈刺激性气味
易溶于水
易挥发、温度低于16.6℃时呈冰状晶体,无水乙酸俗称冰醋酸。
结构分析
羧基
1.断裂氢氧键(酸性)
2.断裂碳氧单键(酯化反应)
3.断裂碳氧双键
受-OH的影响,碳氧双键不易断,不能发生加成反应
①
②
③
2、乙酸的结构及化学性质
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH + 2Na = 2CH3COONa+H2↑
CH3COOH + NaOH = CH3COONa+ H2O
D、与某些盐反应:
A、使紫色石蕊试液变红
B、与活泼金属反应
C、与碱反应:
(1)羧酸的酸性(具有酸的通性)
酸性强弱比较:乙酸>碳酸>苯酚
CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
不能
不能
能
酯化机理:酸脱羟基,醇脱氢
+C2H5-18OH
浓硫酸
△
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
(2)羧酸的酯化反应(可逆反应)
乙酸酯化反应的特点:反应速率小;反应是可逆的。
思考:酯化反应是一个可逆反应,如果要增大乙酸乙酯的产率,你有哪些方法?
(1)增大反应物的浓度
增大乙醇的用量
(2)除去反应生成的水
采用浓硫酸吸水
(3)及时分离出反应生成的乙酸乙酯
蒸馏出乙酸乙酯
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
△
饱和NaOH溶液
乙醇 90%醋酸溶液 浓硫酸
练习:指出该制取乙酸乙酯装置中的错误
酯类的水解反应
酸性水解:
CH3COOC2H5 + H2O CH3COOH + C2H5OH
稀硫酸
碱性水解:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
△
酯的碱性水解更加彻底
三、甲酸的性质
1、甲酸的物理性质
甲酸,又称作蚁酸。无色而有刺激气味的液体,沸点为100.5℃,熔点为8.4℃,可与水、乙醇等混溶。甲酸是饱和一元酸中酸性最强的酸。
小卡片:被蚂蚁咬伤以后,由于蚂蚁会分泌一种化学物质主要成分是甲酸,可以引起皮肤黏膜刺激症状。蚂蚁咬了处理方法:可外涂肥皂水清洗伤口或3%-10%的氨水、5%-10%碳酸氢钠溶液。
甲酸的结构
O
H—C—O—H
醛基
羧基
具有醛的性质:还原性
具有羧酸的性质:酸性、发生酯化反应
CH2 - C-OH
CH2CH2-OH
O
浓硫酸
△
CH2
CH2
C
CH2
O
O
+H2O
浓硫酸
△
+2CH3COOH
CH2OH
CH2OH
CH2OOCCH3
CH2OOCCH3
+2H2O
二乙酸乙二酯
四、羧酸性质应用
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
缩聚物
乳酸分子
可降解塑料袋
第二单元 羧酸的性质及应用
HO—C —COOH
CH2—COOH
CH2—COOH
柠檬酸
DL-苹果酸
山梨酸
2、羧酸的分类:
烃基饱和度
羧基数目
不饱和脂肪酸
一元羧酸
二元羧酸
多元羧酸
碳原子个数
低级脂肪酸
高级脂肪酸
一、羧酸
1、羧酸的概念:
由烃基(或氢原子)与羧基相连构成的有机化合物。
饱和脂肪酸
羧基连烃基不同
脂肪酸
芳香酸
常见的高级脂肪酸——难溶于水
名称 结构简式 状态
硬脂酸 C17H35COOH 固态
软脂酸 C15H31COOH 固态
油 酸 C17H33COOH 液态
亚 油 酸 C17H31COOH 液态
二、乙酸的性质
1、乙酸的物理性质
状态:
气味:
溶解性:
溶沸点:
无色液体
有强烈刺激性气味
易溶于水
易挥发、温度低于16.6℃时呈冰状晶体,无水乙酸俗称冰醋酸。
结构分析
羧基
1.断裂氢氧键(酸性)
2.断裂碳氧单键(酯化反应)
3.断裂碳氧双键
受-OH的影响,碳氧双键不易断,不能发生加成反应
①
②
③
2、乙酸的结构及化学性质
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH + 2Na = 2CH3COONa+H2↑
CH3COOH + NaOH = CH3COONa+ H2O
D、与某些盐反应:
A、使紫色石蕊试液变红
B、与活泼金属反应
C、与碱反应:
(1)羧酸的酸性(具有酸的通性)
酸性强弱比较:乙酸>碳酸>苯酚
CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
代表物 结构简式 酸性 与钠反应 与NaOH反应 与Na2CO3反应 与NaHCO3反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
不能
不能
能
酯化机理:酸脱羟基,醇脱氢
+C2H5-18OH
浓硫酸
△
O
CH3-C-OH
+H2O
O
CH3-C-18O-C2H5
(2)羧酸的酯化反应(可逆反应)
乙酸酯化反应的特点:反应速率小;反应是可逆的。
思考:酯化反应是一个可逆反应,如果要增大乙酸乙酯的产率,你有哪些方法?
(1)增大反应物的浓度
增大乙醇的用量
(2)除去反应生成的水
采用浓硫酸吸水
(3)及时分离出反应生成的乙酸乙酯
蒸馏出乙酸乙酯
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
△
饱和NaOH溶液
乙醇 90%醋酸溶液 浓硫酸
练习:指出该制取乙酸乙酯装置中的错误
酯类的水解反应
酸性水解:
CH3COOC2H5 + H2O CH3COOH + C2H5OH
稀硫酸
碱性水解:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
△
酯的碱性水解更加彻底
三、甲酸的性质
1、甲酸的物理性质
甲酸,又称作蚁酸。无色而有刺激气味的液体,沸点为100.5℃,熔点为8.4℃,可与水、乙醇等混溶。甲酸是饱和一元酸中酸性最强的酸。
小卡片:被蚂蚁咬伤以后,由于蚂蚁会分泌一种化学物质主要成分是甲酸,可以引起皮肤黏膜刺激症状。蚂蚁咬了处理方法:可外涂肥皂水清洗伤口或3%-10%的氨水、5%-10%碳酸氢钠溶液。
甲酸的结构
O
H—C—O—H
醛基
羧基
具有醛的性质:还原性
具有羧酸的性质:酸性、发生酯化反应
CH2 - C-OH
CH2CH2-OH
O
浓硫酸
△
CH2
CH2
C
CH2
O
O
+H2O
浓硫酸
△
+2CH3COOH
CH2OH
CH2OH
CH2OOCCH3
CH2OOCCH3
+2H2O
二乙酸乙二酯
四、羧酸性质应用
缩聚反应:有机化合物分子间脱去小分子获得高分子化合物的反应。
缩聚物
乳酸分子
可降解塑料袋
