第6章常用的金属和盐-巩固练习题-2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第6章常用的金属和盐-巩固练习题-2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 110.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 16:17:36 | ||
图片预览



文档简介
第6章常用的金属和盐-巩固练习题-2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.金属材料在生产,生活中使用广泛。下列金属的用途利用了金属导电性的是
A.铜制电线 B.铁质铁锅 C.金制项链 D.铝制饮料罐
2.下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
3.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
4.下列防锈措施不合理的是
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
5.将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是
A.甲>铜>乙 B.乙>铜>甲 C.铜>甲>乙 D.甲>乙>铜
6.化学与人类的科学技术、生产生活密切相关。下列说法错误的是( )
A.钛合金可应用于火箭和航天飞机
B.头盔缓冲层中的塑料属于合成材料
C.垃圾分类有利于废旧金属的回收利用
D.霉变的花生经冲洗、蒸煮后仍可食用
7.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
8.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
9.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
10.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
11.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
二、简答题
12.生活处处是化学。请回答:
(1)下列水的净化方法中净化程度最高的是________(填字母序号)。
A静置沉淀 B吸附沉淀 C蒸馏 D过滤
(2)制衣行业大量使用合成纤维,可用______方法区别合成纤维和羊毛制品。
(3)过度使用化肥也会造成水污染,但为了提高农作物产量又必须合理使用化肥。某稻田禾苗出现泛黄现象,此时应及时追施________(填“氮肥”或“钾肥”)。
(4)燃气公司给用户输送燃气,在初次使用之前需要通入氮气,通入氮气的目的是什么?______________。关闭燃气开关灭火,运用的原理是______
(5)植树造林提高绿化面积可降低_____ (填“温室效应”或“白色污染”)。
13.下表是部分纯金属和合金的性质及用途。根据下表提供的数据:
纯金属 合金
铅 镉 铋 锡 焊锡 (铅锡合金) 武德合金(铅、铋、锡和镉合金)
熔点/℃ 327 321 271 183 232 70
主要用途 焊接金属 制电路保险丝、自动灭火和防爆安全装置等
你能得到的启示是_________;生活中,王明家里的保险丝坏了,家里没有保险丝了,他找来铅丝代替保险丝。这种做法______(填“正确”或“不正确”)。
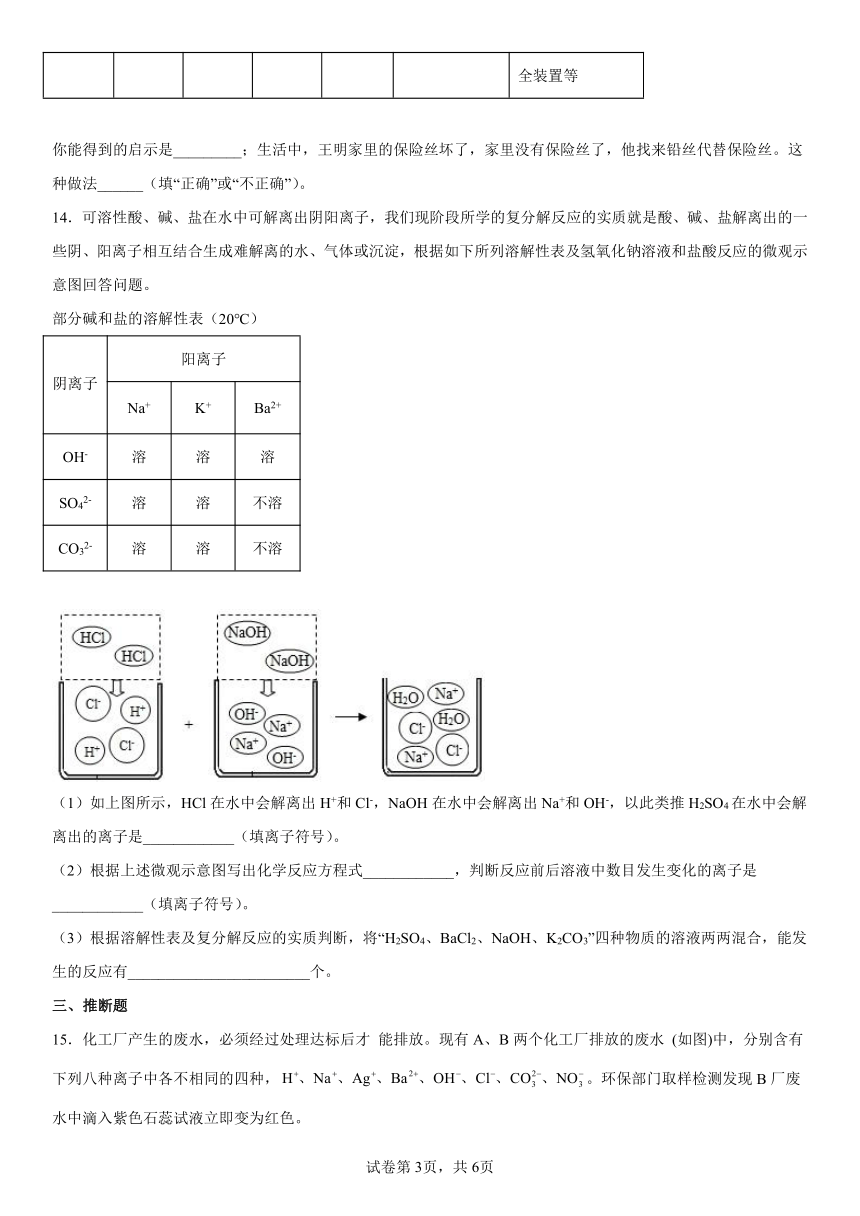
14.可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据如下所列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。
部分碱和盐的溶解性表(20℃)
阴离子 阳离子
Na+ K+ Ba2+
OH- 溶 溶 溶
SO42- 溶 溶 不溶
CO32- 溶 溶 不溶
(1)如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是____________(填离子符号)。
(2)根据上述微观示意图写出化学反应方程式____________,判断反应前后溶液中数目发生变化的离子是____________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“H2SO4、BaCl2、NaOH、K2CO3”四种物质的溶液两两混合,能发生的反应有________________________个。
三、推断题
15.化工厂产生的废水,必须经过处理达标后才 能排放。现有A、B两个化工厂排放的废水 (如图)中,分别含有下列八种离子中各不相同的四种,。环保部门取样检测发现B厂废水中滴入紫色石蕊试液立即变为红色。
(1)试判断A厂废水中含有的四种离子是______。
(2)为减少废水的污染,可将A、B两工厂的废水按一定比例混合充分反应后过滤,向滤液中滴加少量的盐酸,只发现有气泡逸出,则该滤液中一定含有的阳离子是______,一定含有的阴离子是______。
16.某化学小组用一定量AgNO3和Al(NO3)3的混合溶液进行了下图实验,已知溶液甲呈蓝色。
(1)向固体乙上滴加盐酸时____________(填“有”或“没有”)气泡产生。
(2)溶液甲中一定含有哪些溶质?(写化学式)__________________
(3)请写出该实验过程中所发生反应的化学方程式。______________________
四、实验题
17.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
18.利用生活中的物品进行实验是化学学习和探究的一种途径.回忆一年来在家里做过的化学小实验,选择你认为最理想的一次填写表格:
实验名称(或目的) 实验步骤 实验现象及结论
________ ________ ________
通过这次实验,你有哪些收获? ________
19.实验室对含有MgCl2的粗盐进行提纯,步骤如图”:
(1)步骤①中,称量50g粗盐需补充的主要仪器是___________。
(2)步骤②中,玻璃棒的作用是________。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2,反应的化学方程式是__________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是______(填字母)。
A稀盐酸
B稀硫酸
C稀硝酸
(5)步骤⑥的操作名称是_______,当__________时,停止加热。
五、计算题
20.小刚同学想测定黄铜(铜锌合金)中铜的质量分数,他取20g黄铜样品,加入足量稀硫酸,反应后生成了0.2g气体,请你帮他计算该合金中铜元素的质量分数。
21.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
22.金属锰大量用于制造锰钢。地壳中含锰的矿石有软锰矿,软锰矿的主要成分是二氧化锰。金属锰可用软锰矿跟铝反应来制取,其反应为3MnO2+4Al2Al2O3+3Mn。
(1)用100t含MnO278.3%的软锰矿石,可冶炼出多少t锰(准确至0.1t,下同)。
(2)实际冶炼出的锰是含有5%杂质的粗锰,则实际得到多少t粗锰。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.D
4.B
5.A
6.D
7.C
8.D
9.C
10.C
11.D
12. C 燃烧闻气味 氮肥 赶走里面的空气,防止点燃时发生爆炸 清除可燃物 温室效应
13. 合金的熔点比其成分金属低 不正确
14. H+、SO42- HCl+NaOH═NaCl+H2O H+、OH- 4
15. 、、、 和
16. 没有 Al( NO3) 3、Zn( NO3)2、Cu(NO3 ) 2 Cu + 2 AgNO3 = Cu (NO3) 2 + 2 Ag
Zn +2AgNO3 = Zn(NO3)2 +2Ag
17. 金属活动性,活动性越强,反应速率越快 金属与酸的接触面,接触面越大,反应越快 酸的浓度,酸的浓度越大,反应越快
18. 用食醋除暖水瓶里的水垢 取适量的食醋放入开水瓶中,振荡 产生大量的气泡,水垢逐渐消失,说明食醋可以除去暖水瓶中的水垢 化学无处不在,我们可以利用所学的化学知识解决某些问题
19. 托盘天平 搅拌,加速粗盐的溶解 A 蒸发 当蒸发皿中出现较多固体
20.解:设锌的质量为x
x=6.5g
铜的质量分数为。
答:该合金中铜元素的质量分数67.5%。
21.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
解得:x=21.2g,y=23.4g,
22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
22.(1)49.5t;(2)52.1t
答案第1页,共2页
答案第1页,共2页
一、单选题
1.金属材料在生产,生活中使用广泛。下列金属的用途利用了金属导电性的是
A.铜制电线 B.铁质铁锅 C.金制项链 D.铝制饮料罐
2.下列有关废旧金属回收的意义,说法错误的是( )
A.耗费大量人力物力,得不偿失
B.是保护金属资源的重要途径
C.可以减少废旧金属对环境的污染
D.可以节约宝贵的金属资源
3.下列实验现象的描述中正确的是
A.红磷燃烧,产生大量白烟,生成五氧化二磷
B.将铁丝伸入盛有氧气的集气瓶中,铁丝剧烈燃烧,火星四射,生成黑色固体
C.将氢氧化钠溶液滴加入硫酸铜溶液中,生成白色沉淀
D.碳酸钠固体和稀盐酸反应,生成能使澄清石灰水变浑浊的气体
4.下列防锈措施不合理的是
A.钢管存放在干燥的地方
B.用盐水清洗菜刀
C.及时清除铁制品表面的锈渍
D.在铁管表面镀上一层不易锈蚀的金属
5.将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是
A.甲>铜>乙 B.乙>铜>甲 C.铜>甲>乙 D.甲>乙>铜
6.化学与人类的科学技术、生产生活密切相关。下列说法错误的是( )
A.钛合金可应用于火箭和航天飞机
B.头盔缓冲层中的塑料属于合成材料
C.垃圾分类有利于废旧金属的回收利用
D.霉变的花生经冲洗、蒸煮后仍可食用
7.某农技站货架上待售的化肥有NH4NO3、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是( )
A.氮肥 B.磷肥 C.钾肥 D.复合肥料
8.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
9.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
10.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
11.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
二、简答题
12.生活处处是化学。请回答:
(1)下列水的净化方法中净化程度最高的是________(填字母序号)。
A静置沉淀 B吸附沉淀 C蒸馏 D过滤
(2)制衣行业大量使用合成纤维,可用______方法区别合成纤维和羊毛制品。
(3)过度使用化肥也会造成水污染,但为了提高农作物产量又必须合理使用化肥。某稻田禾苗出现泛黄现象,此时应及时追施________(填“氮肥”或“钾肥”)。
(4)燃气公司给用户输送燃气,在初次使用之前需要通入氮气,通入氮气的目的是什么?______________。关闭燃气开关灭火,运用的原理是______
(5)植树造林提高绿化面积可降低_____ (填“温室效应”或“白色污染”)。
13.下表是部分纯金属和合金的性质及用途。根据下表提供的数据:
纯金属 合金
铅 镉 铋 锡 焊锡 (铅锡合金) 武德合金(铅、铋、锡和镉合金)
熔点/℃ 327 321 271 183 232 70
主要用途 焊接金属 制电路保险丝、自动灭火和防爆安全装置等
你能得到的启示是_________;生活中,王明家里的保险丝坏了,家里没有保险丝了,他找来铅丝代替保险丝。这种做法______(填“正确”或“不正确”)。
14.可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据如下所列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。
部分碱和盐的溶解性表(20℃)
阴离子 阳离子
Na+ K+ Ba2+
OH- 溶 溶 溶
SO42- 溶 溶 不溶
CO32- 溶 溶 不溶
(1)如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是____________(填离子符号)。
(2)根据上述微观示意图写出化学反应方程式____________,判断反应前后溶液中数目发生变化的离子是____________(填离子符号)。
(3)根据溶解性表及复分解反应的实质判断,将“H2SO4、BaCl2、NaOH、K2CO3”四种物质的溶液两两混合,能发生的反应有________________________个。
三、推断题
15.化工厂产生的废水,必须经过处理达标后才 能排放。现有A、B两个化工厂排放的废水 (如图)中,分别含有下列八种离子中各不相同的四种,。环保部门取样检测发现B厂废水中滴入紫色石蕊试液立即变为红色。
(1)试判断A厂废水中含有的四种离子是______。
(2)为减少废水的污染,可将A、B两工厂的废水按一定比例混合充分反应后过滤,向滤液中滴加少量的盐酸,只发现有气泡逸出,则该滤液中一定含有的阳离子是______,一定含有的阴离子是______。
16.某化学小组用一定量AgNO3和Al(NO3)3的混合溶液进行了下图实验,已知溶液甲呈蓝色。
(1)向固体乙上滴加盐酸时____________(填“有”或“没有”)气泡产生。
(2)溶液甲中一定含有哪些溶质?(写化学式)__________________
(3)请写出该实验过程中所发生反应的化学方程式。______________________
四、实验题
17.某实验小组为了探究影响金属与酸反应快慢的因素,进行了下列活动。
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸产生气体快
根据以上三个实验现象可得出的结论是:____________;_____________;____________。
18.利用生活中的物品进行实验是化学学习和探究的一种途径.回忆一年来在家里做过的化学小实验,选择你认为最理想的一次填写表格:
实验名称(或目的) 实验步骤 实验现象及结论
________ ________ ________
通过这次实验,你有哪些收获? ________
19.实验室对含有MgCl2的粗盐进行提纯,步骤如图”:
(1)步骤①中,称量50g粗盐需补充的主要仪器是___________。
(2)步骤②中,玻璃棒的作用是________。
(3)步骤③中,滴加过量NaOH溶液除去MgCl2,反应的化学方程式是__________。
(4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是______(填字母)。
A稀盐酸
B稀硫酸
C稀硝酸
(5)步骤⑥的操作名称是_______,当__________时,停止加热。
五、计算题
20.小刚同学想测定黄铜(铜锌合金)中铜的质量分数,他取20g黄铜样品,加入足量稀硫酸,反应后生成了0.2g气体,请你帮他计算该合金中铜元素的质量分数。
21.某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答:
(1)生成CO2的质量_____。
(2)22.8g样品中氯化钠的质量为_____。
(3)计算所得溶液中溶质的质量分数_________。(写出解题过程,计算结果精确到0.1%)
22.金属锰大量用于制造锰钢。地壳中含锰的矿石有软锰矿,软锰矿的主要成分是二氧化锰。金属锰可用软锰矿跟铝反应来制取,其反应为3MnO2+4Al2Al2O3+3Mn。
(1)用100t含MnO278.3%的软锰矿石,可冶炼出多少t锰(准确至0.1t,下同)。
(2)实际冶炼出的锰是含有5%杂质的粗锰,则实际得到多少t粗锰。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.D
4.B
5.A
6.D
7.C
8.D
9.C
10.C
11.D
12. C 燃烧闻气味 氮肥 赶走里面的空气,防止点燃时发生爆炸 清除可燃物 温室效应
13. 合金的熔点比其成分金属低 不正确
14. H+、SO42- HCl+NaOH═NaCl+H2O H+、OH- 4
15. 、、、 和
16. 没有 Al( NO3) 3、Zn( NO3)2、Cu(NO3 ) 2 Cu + 2 AgNO3 = Cu (NO3) 2 + 2 Ag
Zn +2AgNO3 = Zn(NO3)2 +2Ag
17. 金属活动性,活动性越强,反应速率越快 金属与酸的接触面,接触面越大,反应越快 酸的浓度,酸的浓度越大,反应越快
18. 用食醋除暖水瓶里的水垢 取适量的食醋放入开水瓶中,振荡 产生大量的气泡,水垢逐渐消失,说明食醋可以除去暖水瓶中的水垢 化学无处不在,我们可以利用所学的化学知识解决某些问题
19. 托盘天平 搅拌,加速粗盐的溶解 A 蒸发 当蒸发皿中出现较多固体
20.解:设锌的质量为x
x=6.5g
铜的质量分数为。
答:该合金中铜元素的质量分数67.5%。
21.(1)由图象和质量守恒定律可知,生成二氧化碳的质量为:178.8g﹣170.0g=8.8g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
解得:x=21.2g,y=23.4g,
22.8g样品中氯化钠的质量为:22.8g﹣21.2g=1.6g
(3)完全反应后所得氯化钠溶液的溶质质量分数14.7%
故答为:(1)8.8;
(2)22.8g样品中氯化钠的质量为1.6g;
(3)所得溶液中溶质的质量分数为14.7%。
22.(1)49.5t;(2)52.1t
答案第1页,共2页
答案第1页,共2页
