2021-2022学年高一下学期化学人教版(2019)必修第二册7.1.1有机化合物中碳原子的成键特点和烷烃的结构 课件(23张)
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册7.1.1有机化合物中碳原子的成键特点和烷烃的结构 课件(23张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 16:59:24 | ||
图片预览


文档简介
(共23张PPT)
第七章 有机化合物
第一节 认识有机化合物
第1课时 有机化合物中碳原子的成键特点和烷烃的结构
学
习
目
标
1.通过认识有机物中碳原子的成键特点,从微观的化学键视角探析有机物的分子结构。
2.通过认识有机物的同分异构现象,从分子结构的多样性角度探析有机物性质的多样性。
3.通过认识烷烃的命名法和同系物的概念,从物质分类的角度辩识烷烃的结构和性质特点。
4.以烷烃的代表物甲烷的结构为模型,认识烷烃的结构。
从物质分类、化学键、有机分子结构的多样性角度辩识和探析有机物的结构和性质。
重
点
难
点
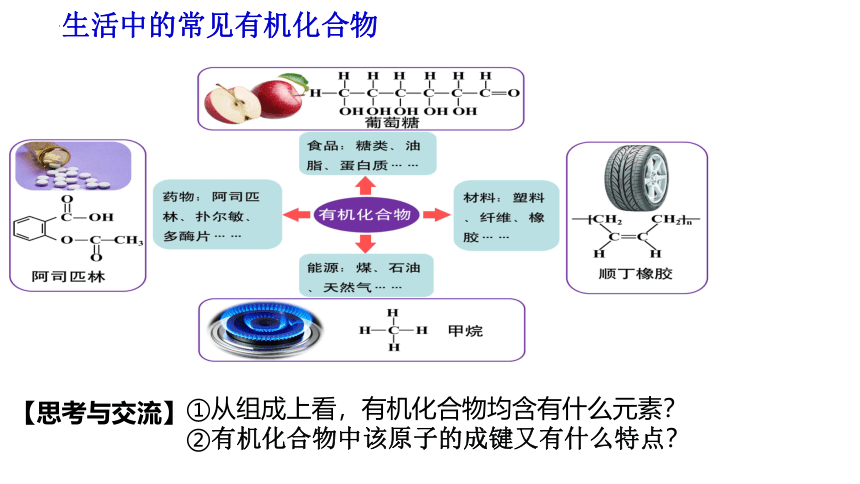
生活中的常见有机化合物
①从组成上看,有机化合物均含有什么元素?
②有机化合物中该原子的成键又有什么特点?
【思考与交流】
①CO ②CH4 ③C2H5OH(乙醇) ④H2CO3 ⑤CCl4 ⑥C6H12O6(葡萄糖) ⑦KSCN ⑧NaHCO3 ⑨CO(NH2)2(尿素) ⑩C2H2
【练习】1.下列物质属于有机物的是_____________。
②③⑤⑥⑨⑩
有机化合物:
一般把含碳元素的化合物称为有机化合物,简称有机物。
【注意】碳单质、CO、CO2、H2CO3、碳酸盐、碳酸氢盐、HCN及其盐、HSCN及其盐、碳化物(如:SiC)等不具有有机物的性质,因此这些物质属于无机物。
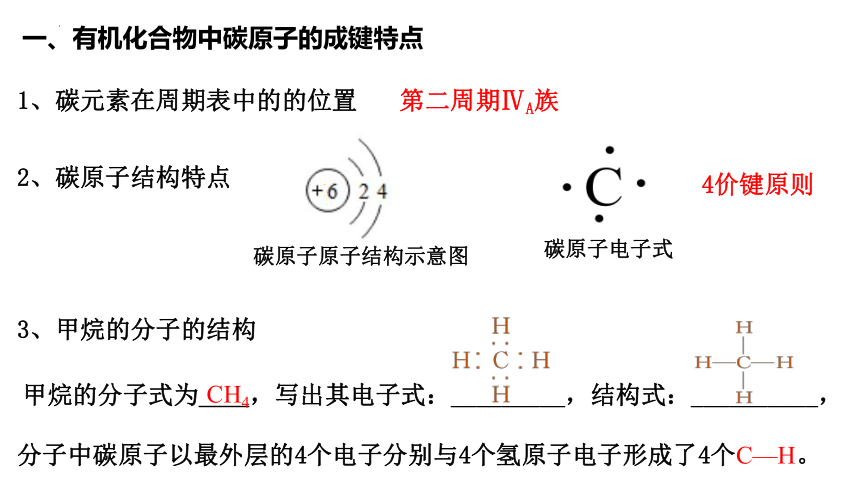
一、有机化合物中碳原子的成键特点
2、碳原子结构特点
碳原子原子结构示意图
碳原子电子式
1、碳元素在周期表中的的位置
第二周期ⅣA族
甲烷的分子式为 ,写出其电子式:_________,结构式:__________,
3、甲烷的分子的结构
分子中碳原子以最外层的4个电子分别与4个氢原子电子形成了4个C—H。
4价键原则
CH4
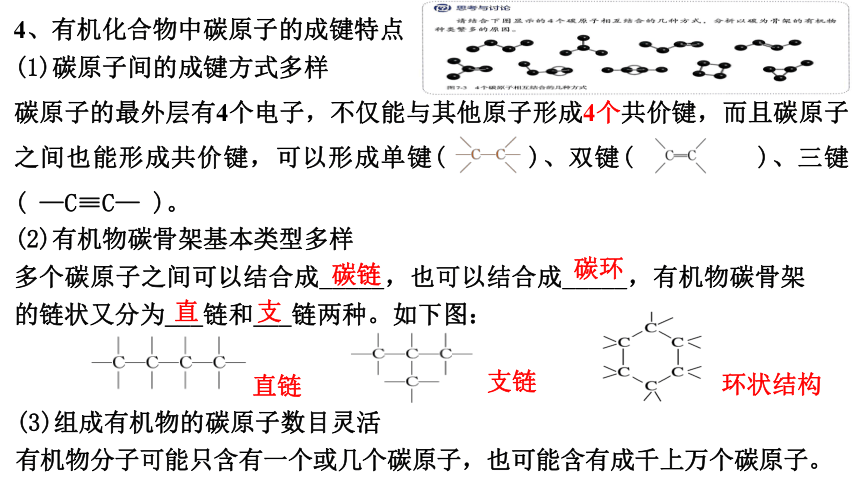
(1)碳原子间的成键方式多样
碳原子的最外层有4个电子,不仅能与其他原子形成4个共价键,而且碳原子之间也能形成共价键,可以形成单键( )、双键( )、三键( —C≡C— )。
4、有机化合物中碳原子的成键特点
(2)有机物碳骨架基本类型多样
多个碳原子之间可以结合成_____,也可以结合成_____,有机物碳骨架的链状又分为___链和___链两种。如下图:
碳链
碳环
直
支
直链
支链
环状结构
(3)组成有机物的碳原子数目灵活
有机物分子可能只含有一个或几个碳原子,也可能含有成千上万个碳原子。
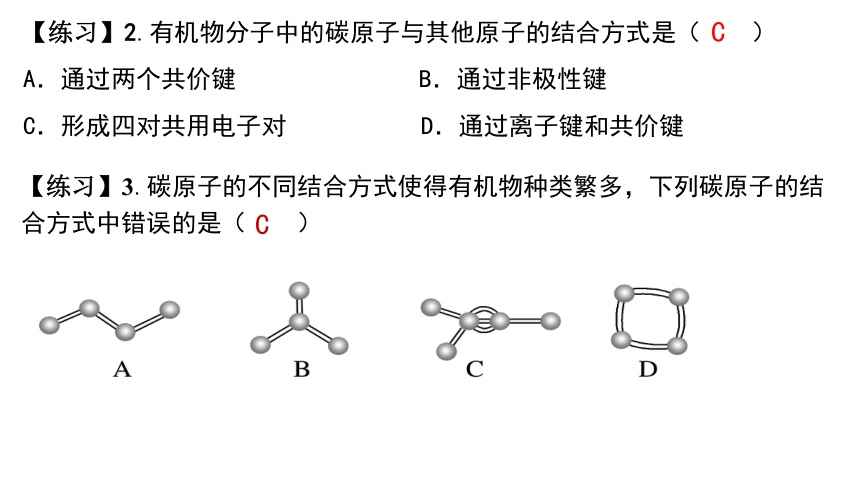
【练习】3.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
【练习】2.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键 B.通过非极性键
C.形成四对共用电子对 D.通过离子键和共价键
C
C
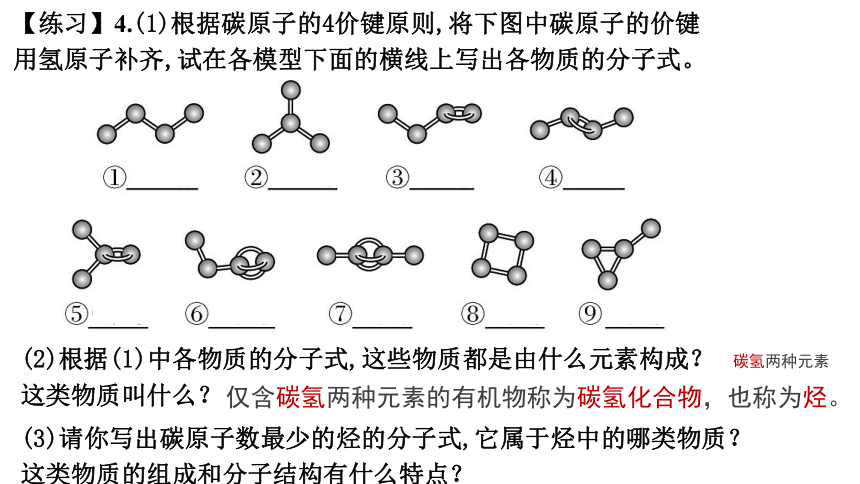
【练习】4.(1)根据碳原子的4价键原则,将下图中碳原子的价键用氢原子补齐,试在各模型下面的横线上写出各物质的分子式。
(2)根据(1)中各物质的分子式,这些物质都是由什么元素构成?这类物质叫什么?
仅含碳氢两种元素的有机物称为碳氢化合物,也称为烃。
碳氢两种元素
(3)请你写出碳原子数最少的烃的分子式,它属于烃中的哪类物质?这类物质的组成和分子结构有什么特点?
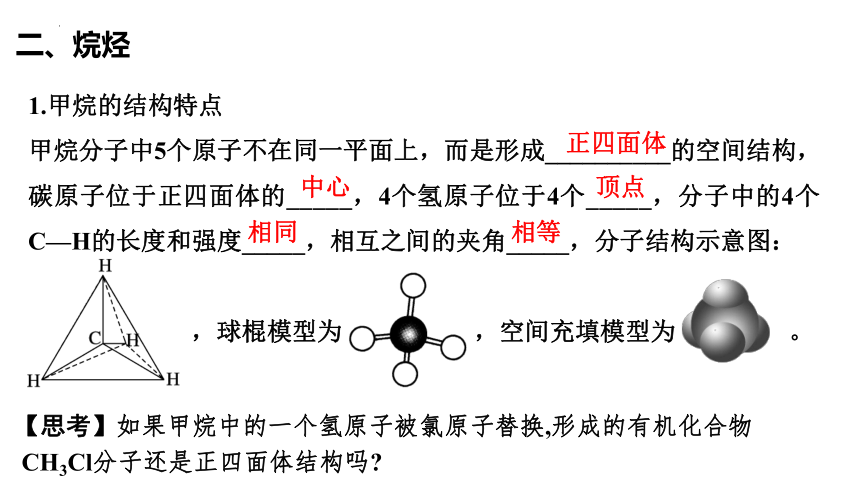
1.甲烷的结构特点
甲烷分子中5个原子不在同一平面上,而是形成__________的空间结构,碳原子位于正四面体的_____,4个氢原子位于4个_____,分子中的4个C—H的长度和强度_____,相互之间的夹角_____,分子结构示意图:
,球棍模型为 ,空间充填模型为 。
二、烷烃
正四面体
中心
顶点
相同
相等
【思考】如果甲烷中的一个氢原子被氯原子替换,形成的有机化合物
CH3Cl分子还是正四面体结构吗
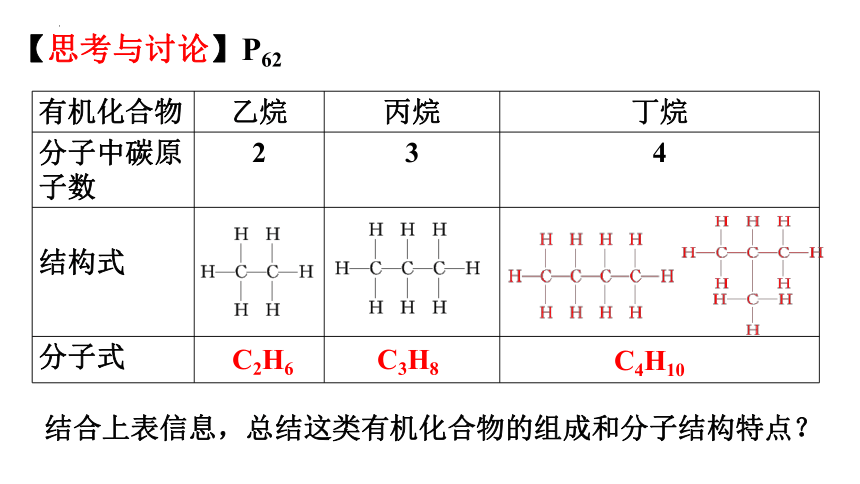
有机化合物 乙烷 丙烷 丁烷
分子中碳原子数 2 3 4
结构式
分子式
C2H6
C3H8
C4H10
【思考与讨论】P62
结合上表信息,总结这类有机化合物的组成和分子结构特点?
(1)概念:碳原子之间都以碳碳单键结合,剩余的价键均用于与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也称为烷烃。
“饱和状态” 碳原子的四个共价键分别连接4个原子。
2.烷烃的结构
【练习】5.下图中哪些是饱和烃?
(烷烃)
饱和烃
饱和链烃
饱和环烃
环状烷烃
链状烷烃
①②⑧⑨
丙烷
乙烷
丁烷
结构式:
结构简式:
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH3
CH3CH3
CH3-CH2-CH3
CH3CH2CH3
CH3-CH2-CH2-CH3
CH3CH2CH2CH3
C2H6
C3H8
C4H10
分子式:
烷烃的分子通式:
CnH2n+2(n≥1)
(1)链状烷烃的组成
3.链状烷烃
(2)链状烷烃的结构特征
①碳原子间都以C-C相连成链状、其余都是C-H键;
②每个C原子都连有4个原子,都为饱和碳原子;
③除乙烷外,其余烷烃的碳链均为非直线型,呈锯齿状;
④单键可以转动;
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称
(3)链状烷烃的命名
(1)分子中碳原子数不多于10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,后面加“烷”,称为某烷,如C4H10称为丁烷。
(2)分子中碳原子数在10以上时,以汉字表示碳原子数,后面加“烷”,称为某烷,如C15H32称为十五烷。
习惯命名法:以烷烃分子中碳原子数命名。
甲烷
乙烷
丙烷
丁烷
戊烷
己烷
庚烷
辛烷
壬烷
癸烷
(3)对于碳原子数相同而结构不同的烷烃,一般在烷烃名称前面加正、异、新来区别。
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
正:不带支链; 异:带一个支链; 新:带两个支链
正戊烷
异戊烷
新戊烷
CH3CH2CH2CH3
例: 丁烷 C4H10
正丁烷
异丁烷
戊烷 C5H12
同:同类物质,通式同,组成元素同
差:组成上相差n个CH2原子团
①碳原子数不同
②分子式不同
③相对分子质量相差14n
似:结构相似(化学键类型相似)
(4)同系物
定义:结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
化学性质相似物理性质不同
【练习】6.下列物质中属于同系物的是_________。
① CH2=CH-CH3 ②CH4 ③CH3CH2CH3 ④CH3(CH2)5CH(CH3)CH3 ⑤
CH2—CH2
CH2—CH2
②③④
【练习】7.根据各物质的分子式,用序号填空。
分子式相同的物质有:①和 ;③和 ;⑥和 。
②
④、⑤、⑧、⑨
⑦
(5)同分异构体
a.概念
①同分异构现象:化合物具有相同的_______,但具有不同_____的现象。
分子式
结构
②同分异构体:具有同分异构现象的化合物。
b.同分异构体种数
①随着碳原子数的增加,烷烃的同分异构体的种数也就越多。
②甲烷、乙烷、丙烷无同分异构体。丁烷有2种,戊烷有3种,己烷有5种。
c.性质
同分异构体之间的性质有差异,如正丁烷和异丁烷的熔沸点不相同。
支链越多,熔沸点越低。
同分异构现象的广泛存在也是有机物种类繁多的重要原因之一
d.烷烃同分异构体的书写
主链由长到短,支链由整到散,位置由心到边。
方法:
步骤:
(以书写C5H12同分异构体为例)
①将分子中全部碳原子连成直链作为主链。C—C—C—C—C
②从主链一端取下一个碳原子作为支链(即甲基),依次
连在主链中心对称线(虚线)一侧的各个碳原子上。
③从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即2个甲基)依次连在主链中心对称线一侧或两侧的各个碳原子上。
注意:
甲基不能连在第一个碳上,乙基不能连在第二个碳上。以此类推。
【练习】8.书写己烷的同分异构体
④根据碳四价键原则,补上氢原子。
概念 内 涵 比较对象 实例
同位素
同素异形体
同系物
同分异构体
质子数相同,中子数
不同的原子。
原子
氕、氚
同一元素形成的不同单质
单质
O2、O3
结构相似,组成上差1个或n个CH2的化合物
有机物
C2H6、C4H10
相同分子式,不同结构的化合物
有机物
CH3(CH2)3CH3、
C(CH3)4
【归纳对比】
【练习】9.有下列各组物质(在横线上填相应的序号):
①O2和O3 ②H2、D2、T2 ③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH2CH3
⑤癸烷和十六烷 ⑥CH3CH2CH3和CH3CH2CH2CH(CH3)C2H5
⑧(CH3)2CHCH(CH3)2和(CH3)2CH(CH2)2CH3
(1)互为同位素的是__________。
(2)互为同系物的是____________。
(3)互为同素异形体的是__________。
(4)互为同分异构体的是__________。
(5)为同一种物质的是________。
③
④⑤⑥
①
⑧
⑦
【课堂检测】某些有机化合物的模型如图所示。
回答下列问题:
(1)属于空间充填模型的是__________;
(2)表示同一种有机化合物的是__________;
(3)存在同分异构体的是_____,写出其同分异构体的结构简式:_________;(4)属于同系物的有 ;
(5)含碳量最低的是_____,含氢量最低的分子中氢元素的质量分数是____。
乙、丙
甲、丙
戊
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
甲、乙、丁、戊/丙、乙、丁、戊
甲
戊
第七章 有机化合物
第一节 认识有机化合物
第1课时 有机化合物中碳原子的成键特点和烷烃的结构
学
习
目
标
1.通过认识有机物中碳原子的成键特点,从微观的化学键视角探析有机物的分子结构。
2.通过认识有机物的同分异构现象,从分子结构的多样性角度探析有机物性质的多样性。
3.通过认识烷烃的命名法和同系物的概念,从物质分类的角度辩识烷烃的结构和性质特点。
4.以烷烃的代表物甲烷的结构为模型,认识烷烃的结构。
从物质分类、化学键、有机分子结构的多样性角度辩识和探析有机物的结构和性质。
重
点
难
点
生活中的常见有机化合物
①从组成上看,有机化合物均含有什么元素?
②有机化合物中该原子的成键又有什么特点?
【思考与交流】
①CO ②CH4 ③C2H5OH(乙醇) ④H2CO3 ⑤CCl4 ⑥C6H12O6(葡萄糖) ⑦KSCN ⑧NaHCO3 ⑨CO(NH2)2(尿素) ⑩C2H2
【练习】1.下列物质属于有机物的是_____________。
②③⑤⑥⑨⑩
有机化合物:
一般把含碳元素的化合物称为有机化合物,简称有机物。
【注意】碳单质、CO、CO2、H2CO3、碳酸盐、碳酸氢盐、HCN及其盐、HSCN及其盐、碳化物(如:SiC)等不具有有机物的性质,因此这些物质属于无机物。
一、有机化合物中碳原子的成键特点
2、碳原子结构特点
碳原子原子结构示意图
碳原子电子式
1、碳元素在周期表中的的位置
第二周期ⅣA族
甲烷的分子式为 ,写出其电子式:_________,结构式:__________,
3、甲烷的分子的结构
分子中碳原子以最外层的4个电子分别与4个氢原子电子形成了4个C—H。
4价键原则
CH4
(1)碳原子间的成键方式多样
碳原子的最外层有4个电子,不仅能与其他原子形成4个共价键,而且碳原子之间也能形成共价键,可以形成单键( )、双键( )、三键( —C≡C— )。
4、有机化合物中碳原子的成键特点
(2)有机物碳骨架基本类型多样
多个碳原子之间可以结合成_____,也可以结合成_____,有机物碳骨架的链状又分为___链和___链两种。如下图:
碳链
碳环
直
支
直链
支链
环状结构
(3)组成有机物的碳原子数目灵活
有机物分子可能只含有一个或几个碳原子,也可能含有成千上万个碳原子。
【练习】3.碳原子的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是( )
【练习】2.有机物分子中的碳原子与其他原子的结合方式是( )
A.通过两个共价键 B.通过非极性键
C.形成四对共用电子对 D.通过离子键和共价键
C
C
【练习】4.(1)根据碳原子的4价键原则,将下图中碳原子的价键用氢原子补齐,试在各模型下面的横线上写出各物质的分子式。
(2)根据(1)中各物质的分子式,这些物质都是由什么元素构成?这类物质叫什么?
仅含碳氢两种元素的有机物称为碳氢化合物,也称为烃。
碳氢两种元素
(3)请你写出碳原子数最少的烃的分子式,它属于烃中的哪类物质?这类物质的组成和分子结构有什么特点?
1.甲烷的结构特点
甲烷分子中5个原子不在同一平面上,而是形成__________的空间结构,碳原子位于正四面体的_____,4个氢原子位于4个_____,分子中的4个C—H的长度和强度_____,相互之间的夹角_____,分子结构示意图:
,球棍模型为 ,空间充填模型为 。
二、烷烃
正四面体
中心
顶点
相同
相等
【思考】如果甲烷中的一个氢原子被氯原子替换,形成的有机化合物
CH3Cl分子还是正四面体结构吗
有机化合物 乙烷 丙烷 丁烷
分子中碳原子数 2 3 4
结构式
分子式
C2H6
C3H8
C4H10
【思考与讨论】P62
结合上表信息,总结这类有机化合物的组成和分子结构特点?
(1)概念:碳原子之间都以碳碳单键结合,剩余的价键均用于与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也称为烷烃。
“饱和状态” 碳原子的四个共价键分别连接4个原子。
2.烷烃的结构
【练习】5.下图中哪些是饱和烃?
(烷烃)
饱和烃
饱和链烃
饱和环烃
环状烷烃
链状烷烃
①②⑧⑨
丙烷
乙烷
丁烷
结构式:
结构简式:
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH3
CH3CH3
CH3-CH2-CH3
CH3CH2CH3
CH3-CH2-CH2-CH3
CH3CH2CH2CH3
C2H6
C3H8
C4H10
分子式:
烷烃的分子通式:
CnH2n+2(n≥1)
(1)链状烷烃的组成
3.链状烷烃
(2)链状烷烃的结构特征
①碳原子间都以C-C相连成链状、其余都是C-H键;
②每个C原子都连有4个原子,都为饱和碳原子;
③除乙烷外,其余烷烃的碳链均为非直线型,呈锯齿状;
④单键可以转动;
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称
(3)链状烷烃的命名
(1)分子中碳原子数不多于10时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,后面加“烷”,称为某烷,如C4H10称为丁烷。
(2)分子中碳原子数在10以上时,以汉字表示碳原子数,后面加“烷”,称为某烷,如C15H32称为十五烷。
习惯命名法:以烷烃分子中碳原子数命名。
甲烷
乙烷
丙烷
丁烷
戊烷
己烷
庚烷
辛烷
壬烷
癸烷
(3)对于碳原子数相同而结构不同的烷烃,一般在烷烃名称前面加正、异、新来区别。
CH3CH2CH2CH2CH3
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
正:不带支链; 异:带一个支链; 新:带两个支链
正戊烷
异戊烷
新戊烷
CH3CH2CH2CH3
例: 丁烷 C4H10
正丁烷
异丁烷
戊烷 C5H12
同:同类物质,通式同,组成元素同
差:组成上相差n个CH2原子团
①碳原子数不同
②分子式不同
③相对分子质量相差14n
似:结构相似(化学键类型相似)
(4)同系物
定义:结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
化学性质相似物理性质不同
【练习】6.下列物质中属于同系物的是_________。
① CH2=CH-CH3 ②CH4 ③CH3CH2CH3 ④CH3(CH2)5CH(CH3)CH3 ⑤
CH2—CH2
CH2—CH2
②③④
【练习】7.根据各物质的分子式,用序号填空。
分子式相同的物质有:①和 ;③和 ;⑥和 。
②
④、⑤、⑧、⑨
⑦
(5)同分异构体
a.概念
①同分异构现象:化合物具有相同的_______,但具有不同_____的现象。
分子式
结构
②同分异构体:具有同分异构现象的化合物。
b.同分异构体种数
①随着碳原子数的增加,烷烃的同分异构体的种数也就越多。
②甲烷、乙烷、丙烷无同分异构体。丁烷有2种,戊烷有3种,己烷有5种。
c.性质
同分异构体之间的性质有差异,如正丁烷和异丁烷的熔沸点不相同。
支链越多,熔沸点越低。
同分异构现象的广泛存在也是有机物种类繁多的重要原因之一
d.烷烃同分异构体的书写
主链由长到短,支链由整到散,位置由心到边。
方法:
步骤:
(以书写C5H12同分异构体为例)
①将分子中全部碳原子连成直链作为主链。C—C—C—C—C
②从主链一端取下一个碳原子作为支链(即甲基),依次
连在主链中心对称线(虚线)一侧的各个碳原子上。
③从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即2个甲基)依次连在主链中心对称线一侧或两侧的各个碳原子上。
注意:
甲基不能连在第一个碳上,乙基不能连在第二个碳上。以此类推。
【练习】8.书写己烷的同分异构体
④根据碳四价键原则,补上氢原子。
概念 内 涵 比较对象 实例
同位素
同素异形体
同系物
同分异构体
质子数相同,中子数
不同的原子。
原子
氕、氚
同一元素形成的不同单质
单质
O2、O3
结构相似,组成上差1个或n个CH2的化合物
有机物
C2H6、C4H10
相同分子式,不同结构的化合物
有机物
CH3(CH2)3CH3、
C(CH3)4
【归纳对比】
【练习】9.有下列各组物质(在横线上填相应的序号):
①O2和O3 ②H2、D2、T2 ③12C和14C ④CH3CH2CH2CH3和(CH3)2CHCH2CH3
⑤癸烷和十六烷 ⑥CH3CH2CH3和CH3CH2CH2CH(CH3)C2H5
⑧(CH3)2CHCH(CH3)2和(CH3)2CH(CH2)2CH3
(1)互为同位素的是__________。
(2)互为同系物的是____________。
(3)互为同素异形体的是__________。
(4)互为同分异构体的是__________。
(5)为同一种物质的是________。
③
④⑤⑥
①
⑧
⑦
【课堂检测】某些有机化合物的模型如图所示。
回答下列问题:
(1)属于空间充填模型的是__________;
(2)表示同一种有机化合物的是__________;
(3)存在同分异构体的是_____,写出其同分异构体的结构简式:_________;(4)属于同系物的有 ;
(5)含碳量最低的是_____,含氢量最低的分子中氢元素的质量分数是____。
乙、丙
甲、丙
戊
CH3CHCH2CH3
CH3
CH3
CH3CCH3
CH3
甲、乙、丁、戊/丙、乙、丁、戊
甲
戊
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
