3.2.1 离子键的形成同步练习(word含答案)
文档属性
| 名称 | 3.2.1 离子键的形成同步练习(word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 171.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-06 20:36:10 | ||
图片预览




文档简介
专题3第二单元第一课时离子键的形成同步练习
一、单选题(共17题)
1.南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子的化学式为。下列关于全氮阴离子盐的说法正确的是( )
A.每个含有26个电子 B.的摩尔质量为
C.全氮阴离子盐既含离子键又含共价键 D.全氮阴离子盐可能属于电解质,也可能属于非电解质
2.下列化合物的电子式书写正确的是( )
A.Ca2+ B.Na
C. D.K+
3.下列物质中,含有离子键的是( )
A.Cl2 B.HCl C.CaCl2 D.HClO
4.离子键是( )
A.原子间通过电子的静电作用 B.阴、阳离子间的静电吸引
C.阴、阳离子间的静电作用 D.阳离子之间通过电子的强烈作用
5.下列说法不正确的是( )
①阳离子都是由一个金属原子失去电子而形成的
②阳离子核外电子排布一定与稀有气体元素原子相同
③离子键是阴阳离子之间的静电吸引作用
④在化合物CaCl2中,两个氯离子之间也存在离子键
A.①④ B.②④ C.①②③ D.①②③④
6.下列说法正确的是( )
A.工业上生产水泥和玻璃都要用石灰石做原料 B.玻璃钢是一种合金材料
C.除去氨气中的水蒸气可用无水氯化钙可做干燥剂 D.溶于水可以导电的化合物一定是离子化合物
7.下列说法正确的是( )
A.形成离子键的阴、阳离子间只存在静电吸引力
B.第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物
C.离子化合物的熔点一定比共价化合物的熔点高
D.金属元素与非金属元素化合时,不一定形成离子键
8.下列说法中正确的是( )
A.HF、HCl、HBr、HI的稳定性依次减弱,还原性也依次减弱
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C.CO2、PCl3分子中所有原子都满足最外层8电子结构
D.NaHSO4溶于水时发生NaHSO4=Na++H++ SO,此时破坏的只有离子键
9.已知R、X、Y、Z是四种原子序数依次增大的主族元素,其中R是短周期元素中原子半径最小的,Z最外层电子数是次外层电子数的3倍。四种元素组成某种离子的结构如图所示。下列说法不正确的是( )
A.原子半径:
B.简单氢化物的沸点:
C.四种元素所形成的化合物不可能含离子键
D.四种元素可共同形成多种既能与酸反应又能与碱反应的化合物
10.锶(Sr)元素与镁元素是同主族元素,下列说法错误的是( )
A.单质Sr保存在煤油中 B.的碱性比强
C.是离子晶体 D.的分解温度比低
11.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列“纯碱:Na2CO3”的分类不正确的是( )
A.离子化合物 B.碳酸盐 C.钠盐 D.碱
12.构成氧化钠的微粒是( )
A.氧原子和钠原子 B.氧化钠分子 C.氧离子和钠离子 D.金属钠和非金属氧
13.下列化学用语表达正确的是( )
A.乙烯的实验式:
B.电镀铜时,铁制镀件上的电极反应式:
C.在水中的电离方程式:
D.用电子式表示的形成过程:
14.下列表示电子式的形成过程正确的是( )
A. B.
C. D.
15.下列关于化学概念的理解错误的是( )
A.互为同分异构体的物质化学性质可能相似,可能差别较大
B.离子化合物中离子键的强弱同时影响物理性质和化学性质
C.酸碱中和生成1mol水放出的热量与溶液浓度、酸碱的强弱等因素有关
D.常温下的气体摩尔体积一定大于
16.短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )
A.化合物Z2O2是只含离子键的离子化合物 B.工业上制备Y的单质可以电解熔融的YX3
C.最高价氧化物对应水化物的碱性:Z>Y D.常温下,Y和Z的单质均能溶于浓硫酸
17.元素W、X、Y、Z的原子序数依次增大,W、X位于短周期,Y、Z位于第四周期,X的焰色反应为黄色。由于83Y会发生放射性衰变转化为83Z,从W、X、Y组成的某化合物中发现存在Z元素,其变化可用如图表示,设NA为阿伏加德罗常数值。下列说法错误的是( )
A.8.3g 83Y比8.3g 83Z的中子数多0.1NA
B.X2YW4和XZW4中均含有离子键和共价键
C.原子半径比较: Z>Y>X>W
D.最高价氧化物对应水化物的酸性: Z> Y
二、综合题(共4题)
18.氮、磷、砷(As)、锑(Sb)、铋(B)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置是__。Mc的中子数为__。
已知:P(s,白磷)=P(s,黑磷)△H=-39.3kJ/mol;P(s,白磷)=P(s,红磷)△H=-17.6kJ/mol,由此推知,其中最稳定的磷单质是__。
(2)氮和磷氢化物性质的比较:
热稳定性:PH3__(填“>”或“<")NH3,沸点:P2H4__(填“>”或“<")N2H4,判断依据是__ 。
(3)PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是__(填序号)。
a.含离子键、共价键 b.能与水发生水解反应 c.不能与NaOH反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式__ ,因此,配制SbCl3溶液应__ 。
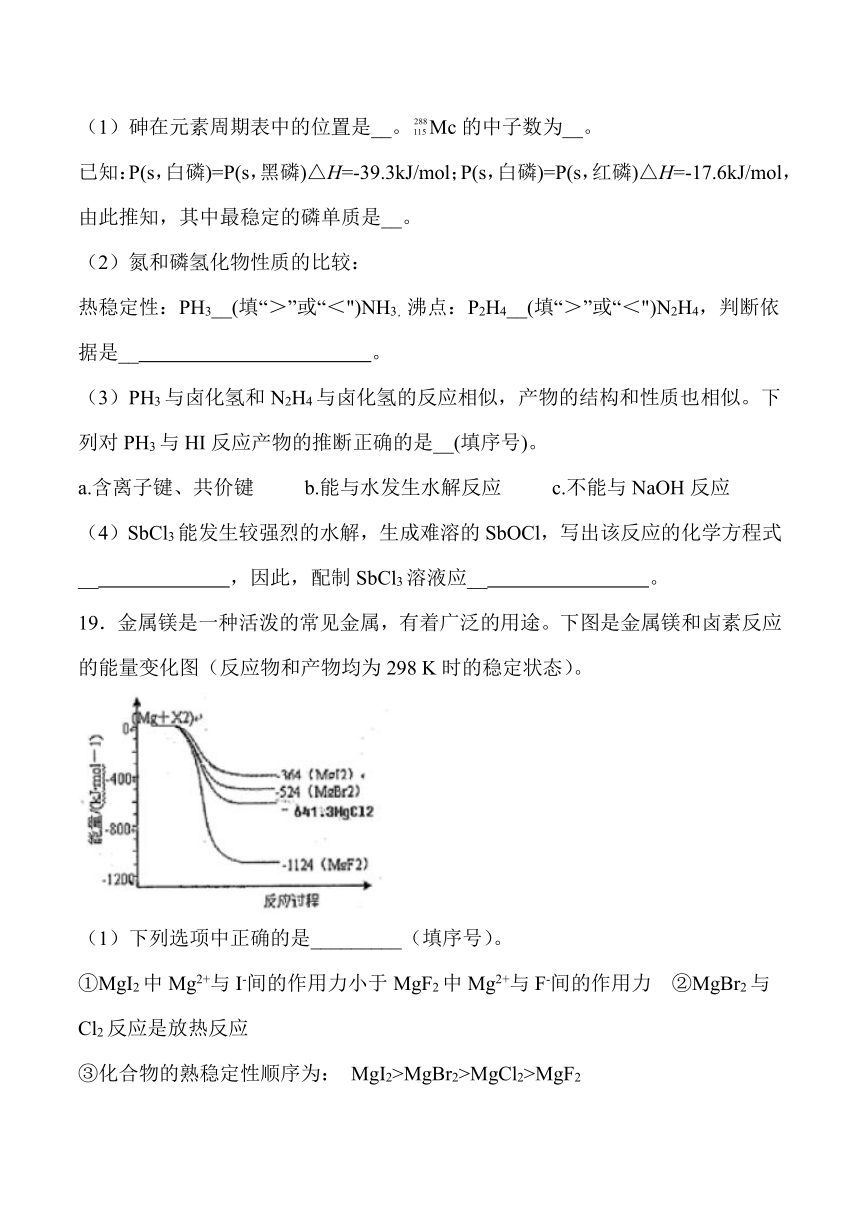
19.金属镁是一种活泼的常见金属,有着广泛的用途。下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力 ②MgBr2与Cl2反应是放热反应
③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2
(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;
(3)若容器中剩余二氧化碳,则残留固体物质_________
A 一定只有MgO B 一定有MgO,可能有C
C 一定有MgO和C D 一定有C,可能有MgO
(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
20.现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下单质分子为双原子分子,分子中含有3对共用电子对
Y M层比K层少1个电子
Z 第三周期元素的金属离子中半径最小
⑴元素Y与元素Z相比,金属性较强的是 ________(用元素符号表示)。下列能证明这一事实的是 _________(填字母)。
a、Y单质的熔点比Z单质低 b、Y的化合价比Z低
c、Y单质与水反应比Z单质剧烈 d、Y的最高价氧化物对应的水化物的碱性比Z的强
⑵T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,用电子式表示该化合物的形成过程:_________________________________________。
⑶元素T和氢元素以原子个数比为1∶1形成化合物Q,元素X与氢元素以原子个数比为1∶2形成常用于火箭燃料的化合物W, Q与W发生反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:_____________________________。
⑷Z单质的晶胞结构如图乙所示,原子之间相对位置关系的平面图如图丙所示。
若已知Z原子半径为d,据上图计算,Z原子采取的面心立方堆积的空间利用率为_____。
21.某待测溶液中可能含有、、、、、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
肯定存在的离子
肯定没有的离子
化学式或离子符号
_______
_______
(2)写出沉淀A三种可能的情况:______________________________,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为________________。
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是_____________________。
参考答案
1.C
2.D
3.C
4.C
5.D
6.A
7.D
8.C
9.C
10.D
11.D
12.C
13.D
14.D
15.D
16.C
17.C
18.(1)第四周期VA族 173 黑鳞
(2) < < N2H4分子间可以形成氢键,P2H4分子间不能形成氢键
(3) ab
(4) 加入盐酸,抑制SbCl3的水解
19.(1)①②
(2) MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol
(3) B
(4) g b>V(O2)>
(5) (a+)<m<(a+) <m<
20.(1)Na cd
(2)
(3) N2H4 + 2H2O2 = N2 + 4H2O
(4) 74%
21.(1) Br-
(2) BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4 3BaSO3+2H++2NO3-===2NO↑+3BaSO4↓+H2O
(3)做焰色反应实验,观察到黄色火焰,则说明是钠
一、单选题(共17题)
1.南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子的化学式为。下列关于全氮阴离子盐的说法正确的是( )
A.每个含有26个电子 B.的摩尔质量为
C.全氮阴离子盐既含离子键又含共价键 D.全氮阴离子盐可能属于电解质,也可能属于非电解质
2.下列化合物的电子式书写正确的是( )
A.Ca2+ B.Na
C. D.K+
3.下列物质中,含有离子键的是( )
A.Cl2 B.HCl C.CaCl2 D.HClO
4.离子键是( )
A.原子间通过电子的静电作用 B.阴、阳离子间的静电吸引
C.阴、阳离子间的静电作用 D.阳离子之间通过电子的强烈作用
5.下列说法不正确的是( )
①阳离子都是由一个金属原子失去电子而形成的
②阳离子核外电子排布一定与稀有气体元素原子相同
③离子键是阴阳离子之间的静电吸引作用
④在化合物CaCl2中,两个氯离子之间也存在离子键
A.①④ B.②④ C.①②③ D.①②③④
6.下列说法正确的是( )
A.工业上生产水泥和玻璃都要用石灰石做原料 B.玻璃钢是一种合金材料
C.除去氨气中的水蒸气可用无水氯化钙可做干燥剂 D.溶于水可以导电的化合物一定是离子化合物
7.下列说法正确的是( )
A.形成离子键的阴、阳离子间只存在静电吸引力
B.第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物
C.离子化合物的熔点一定比共价化合物的熔点高
D.金属元素与非金属元素化合时,不一定形成离子键
8.下列说法中正确的是( )
A.HF、HCl、HBr、HI的稳定性依次减弱,还原性也依次减弱
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C.CO2、PCl3分子中所有原子都满足最外层8电子结构
D.NaHSO4溶于水时发生NaHSO4=Na++H++ SO,此时破坏的只有离子键
9.已知R、X、Y、Z是四种原子序数依次增大的主族元素,其中R是短周期元素中原子半径最小的,Z最外层电子数是次外层电子数的3倍。四种元素组成某种离子的结构如图所示。下列说法不正确的是( )
A.原子半径:
B.简单氢化物的沸点:
C.四种元素所形成的化合物不可能含离子键
D.四种元素可共同形成多种既能与酸反应又能与碱反应的化合物
10.锶(Sr)元素与镁元素是同主族元素,下列说法错误的是( )
A.单质Sr保存在煤油中 B.的碱性比强
C.是离子晶体 D.的分解温度比低
11.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列“纯碱:Na2CO3”的分类不正确的是( )
A.离子化合物 B.碳酸盐 C.钠盐 D.碱
12.构成氧化钠的微粒是( )
A.氧原子和钠原子 B.氧化钠分子 C.氧离子和钠离子 D.金属钠和非金属氧
13.下列化学用语表达正确的是( )
A.乙烯的实验式:
B.电镀铜时,铁制镀件上的电极反应式:
C.在水中的电离方程式:
D.用电子式表示的形成过程:
14.下列表示电子式的形成过程正确的是( )
A. B.
C. D.
15.下列关于化学概念的理解错误的是( )
A.互为同分异构体的物质化学性质可能相似,可能差别较大
B.离子化合物中离子键的强弱同时影响物理性质和化学性质
C.酸碱中和生成1mol水放出的热量与溶液浓度、酸碱的强弱等因素有关
D.常温下的气体摩尔体积一定大于
16.短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )
A.化合物Z2O2是只含离子键的离子化合物 B.工业上制备Y的单质可以电解熔融的YX3
C.最高价氧化物对应水化物的碱性:Z>Y D.常温下,Y和Z的单质均能溶于浓硫酸
17.元素W、X、Y、Z的原子序数依次增大,W、X位于短周期,Y、Z位于第四周期,X的焰色反应为黄色。由于83Y会发生放射性衰变转化为83Z,从W、X、Y组成的某化合物中发现存在Z元素,其变化可用如图表示,设NA为阿伏加德罗常数值。下列说法错误的是( )
A.8.3g 83Y比8.3g 83Z的中子数多0.1NA
B.X2YW4和XZW4中均含有离子键和共价键
C.原子半径比较: Z>Y>X>W
D.最高价氧化物对应水化物的酸性: Z> Y
二、综合题(共4题)
18.氮、磷、砷(As)、锑(Sb)、铋(B)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置是__。Mc的中子数为__。
已知:P(s,白磷)=P(s,黑磷)△H=-39.3kJ/mol;P(s,白磷)=P(s,红磷)△H=-17.6kJ/mol,由此推知,其中最稳定的磷单质是__。
(2)氮和磷氢化物性质的比较:
热稳定性:PH3__(填“>”或“<")NH3,沸点:P2H4__(填“>”或“<")N2H4,判断依据是__ 。
(3)PH3与卤化氢和N2H4与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是__(填序号)。
a.含离子键、共价键 b.能与水发生水解反应 c.不能与NaOH反应
(4)SbCl3能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式__ ,因此,配制SbCl3溶液应__ 。
19.金属镁是一种活泼的常见金属,有着广泛的用途。下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。
(1)下列选项中正确的是_________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力 ②MgBr2与Cl2反应是放热反应
③化合物的熟稳定性顺序为: MgI2>MgBr2>MgCl2>MgF2
(2)请写出在一定条件下液溴与氟化镁固体反应的热化学方程式: ___________。
已知,金属镁在点燃的条件下能与二氧化碳反应:2Mg+CO2→2MgO+C,现将a克镁放在盛有b L(标准状态下)二氧化碳和氧气的混合气体的密闭容器中充分燃烧;
(3)若容器中剩余二氧化碳,则残留固体物质_________
A 一定只有MgO B 一定有MgO,可能有C
C 一定有MgO和C D 一定有C,可能有MgO
(4)若反应容器中有氧气剩余,则容器内剩余固体的质量为_________,出现此种状况,容器中原来b L混合气体中氧气的体积应满足(用含a的代数式)__________。
(5)若容器中无气体剩余,残留固体中含有镁,则残留固体m的取值范围_________;若容器中无气体剩余,残留固体中没有镁剩余,则残留固体m的取值范围_________。
20.现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下单质分子为双原子分子,分子中含有3对共用电子对
Y M层比K层少1个电子
Z 第三周期元素的金属离子中半径最小
⑴元素Y与元素Z相比,金属性较强的是 ________(用元素符号表示)。下列能证明这一事实的是 _________(填字母)。
a、Y单质的熔点比Z单质低 b、Y的化合价比Z低
c、Y单质与水反应比Z单质剧烈 d、Y的最高价氧化物对应的水化物的碱性比Z的强
⑵T、X、Y、Z中有两种元素能形成既有离子键又有非极性键的化合物,用电子式表示该化合物的形成过程:_________________________________________。
⑶元素T和氢元素以原子个数比为1∶1形成化合物Q,元素X与氢元素以原子个数比为1∶2形成常用于火箭燃料的化合物W, Q与W发生反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:_____________________________。
⑷Z单质的晶胞结构如图乙所示,原子之间相对位置关系的平面图如图丙所示。
若已知Z原子半径为d,据上图计算,Z原子采取的面心立方堆积的空间利用率为_____。
21.某待测溶液中可能含有、、、、、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
肯定存在的离子
肯定没有的离子
化学式或离子符号
_______
_______
(2)写出沉淀A三种可能的情况:______________________________,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为________________。
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是_____________________。
参考答案
1.C
2.D
3.C
4.C
5.D
6.A
7.D
8.C
9.C
10.D
11.D
12.C
13.D
14.D
15.D
16.C
17.C
18.(1)第四周期VA族 173 黑鳞
(2) < < N2H4分子间可以形成氢键,P2H4分子间不能形成氢键
(3) ab
(4) 加入盐酸,抑制SbCl3的水解
19.(1)①②
(2) MgF2(s)+Br2(l)=MgBr2(s)+ F2(g) △H=+600kJ/mol
(3) B
(4) g b>V(O2)>
(5) (a+)<m<(a+) <m<
20.(1)Na cd
(2)
(3) N2H4 + 2H2O2 = N2 + 4H2O
(4) 74%
21.(1) Br-
(2) BaSO3;BaSO3、BaSO4;BaCO3、BaSO4;BaCO3、BaSO3;BaSO3、BaCO3、BaSO4 3BaSO3+2H++2NO3-===2NO↑+3BaSO4↓+H2O
(3)做焰色反应实验,观察到黄色火焰,则说明是钠
