第3章简单的有机化合物——基础巩固2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析)
文档属性
| 名称 | 第3章简单的有机化合物——基础巩固2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 702.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 00:00:00 | ||
图片预览



文档简介
第3章简单的有机化合物
一、选择题(共16题)
1.食醋的主要成分是
A.乙酸 B.乙醇 C.油脂 D.苯
2.下列说法不正确的是
A.NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂
B.还原铁粉可用作食品袋内的抗氧化剂
C.水玻璃可用于生产黏合剂和防火剂
D.盐析可提纯蛋白质并保持其生理活性
3.甘油是一种常用的有机溶剂,可与水以任意体积比互溶,密度约为1.26g/mL,沸点约为290℃。分离水和甘油应采用的方法是
A.蒸馏 B.蒸发 C.过滤 D.萃取、分液
4.分子中有3个-CH3的C7H16,其可能的结构有
A.3种 B.4种 C.5种 D.6种
5.下列变化中,气体被还原的是
A.水蒸气使CuSO4变蓝 B.Cl2使FeCl2溶液变黄
C.CH2=CH2使溴水褪色 D.H2S使H2SO3溶液变浊
6.下列除去杂质的操作或方法中,能达到最终目的的是
选项 主要成分(杂质) 实验操作或方法
A 甲烷(乙烯) 将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶
B 碳酸氢钠溶液(碳酸钠) 向混合溶液中滴加适量稀盐酸
C 乙酸乙酯(乙酸) 将混合液加入饱和碳酸钠溶液中,振荡、静置、分液
D 二氧化碳(氯化氢) 将混合气体通过盛有饱和碳酸钠溶液的洗气瓶
A.A B.B C.C D.D
7.汽车尾气催化转化器中发生的反应有、。下列有关化学用语错误的是
A.氮气的电子式: B.的结构式:
C.氧的原子结构示意图: D.中子数为18的硫原子:
8.泛酸又称为维生素B5,在人体内参与糖、油脂、蛋白质的代谢过程,具有抗脂质过氧化作用,其结构如下,下列有关该化合物的说法不正确的是
A.该物质可发生水解反应,水解产物均能发生缩聚反应
B.该物质在浓硫酸、Al2O3或 P2O5等催化剂作用下可发生脱水反应,生成碳碳双键
C.该物质在铜、银等催化剂存在下可以被氧气氧化生成醛基和酮羰基
D.1 mol该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH
9.新冠病毒由蛋白质和核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是
A.高温可使新冠病毒失去活性
B.医用酒精中乙醇的体积分数为95%
C.新冠病毒扩散到空气中不可能形成胶体
D.“84”消毒液(主要成分NaClO)中加入浓盐酸可以增强消毒效果
10.下列说法正确的是( )
A.室温时甲烷能与浓盐酸发生取代反应
B.乙烯和乙醇使酸性KMnO4溶液褪色的原理相同
C.苯与甲苯分子中所有原子均位于同一平面
D.葡萄糖、果糖和蔗糖都可以发生水解反应
11.现有下列两套实验装置,用于实验室制取乙酸乙酯或乙酸丁酯。下列说法错误的是
A.图I装置用于制取乙酸乙酯,图II 装置用于制取乙酸丁酯
B.导管a和导管b的作用都是冷凝回流
C.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
D.加入过量的乙酸可以提高醇的转化率
12.下列说法中不正确的是
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
②汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
A.②③⑤ B.①②④ C.③④⑥ D.③④⑤
13.环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
14.胡妥油(D)是香料的原料,它可由 A 合成得到:
下列说法正确的是
A.有机物 B 的分子式为 C11H19O3
B.1mol B 与足量的 Na 反应可产生 11.2LH 2 (已换算成标准状况)
C.有机物 C 的所有同分异构体中可能有芳香族化合物存在
D.一定条件下,A分别可以发生加成、取代、氧化等反应
15.白黎芦醇具有抗氧化和预防心血管疾病的作用,下列有关白黎芦醇的说法正确的是
A.白黎芦醇能与NaHCO3溶液反应
B.分子中共含有8种化学环境不同的氢原子
C.1 mol白黎芦醇最多能与7 mol氢气加成
D.1 mol白黎芦醇最多能反应溴水中的3.5 molBr2
16.海洋生物体内含有丰富的药物活性物质,从一种海生动物体内提取某种有机活性固体物的流程如下:
下列说法正确的是
A.步骤I的操作在蒸发皿中进行
B.步骤Ⅱ中主要操作名称为分液
C.步骤Ⅲ中振荡分液漏斗时尖嘴向上倾斜
D.步骤V所得乙苯可返回步骤Ⅱ循环利用
二、综合题
17.甲烷的物理性质
颜色 气味 状态 密度 水溶性
_______ _______ _______ 比空气_______ _______
18.乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
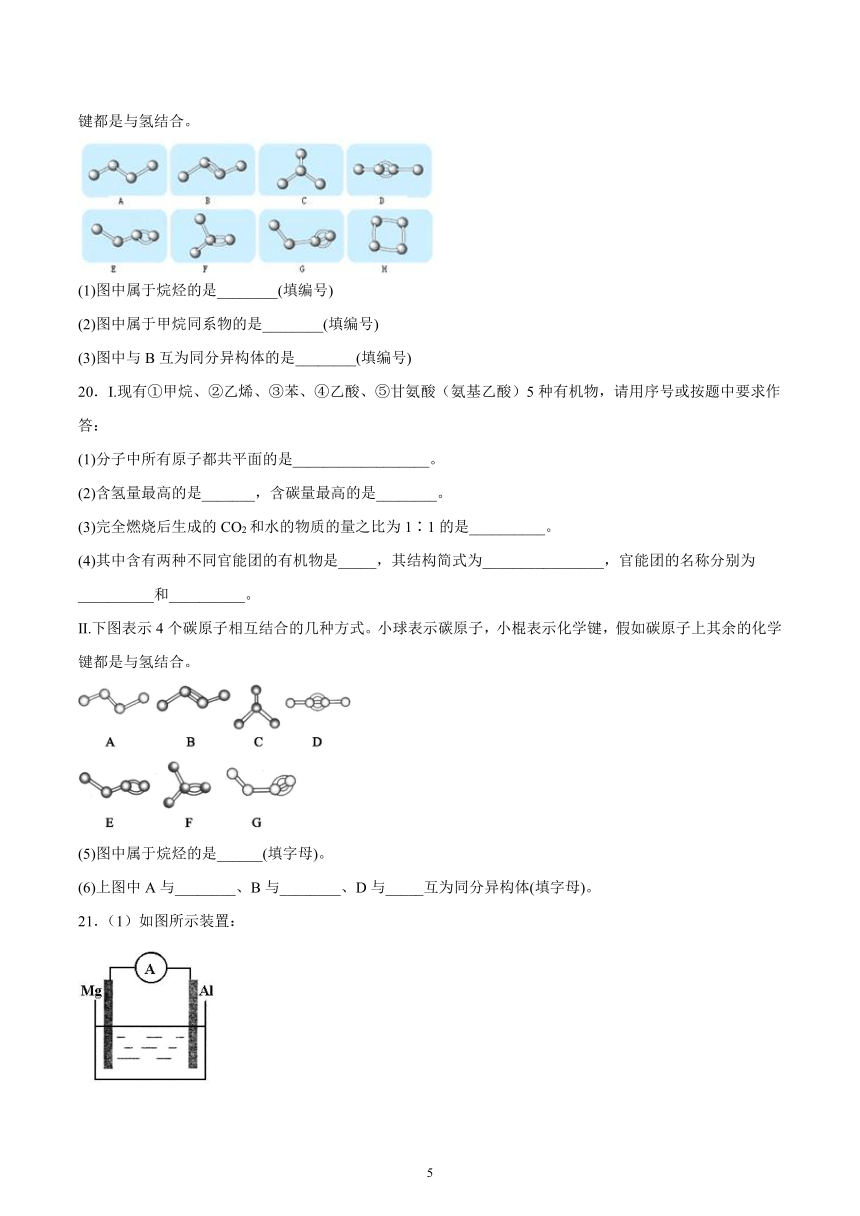
19.如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是________(填编号)
(2)图中属于甲烷同系物的是________(填编号)
(3)图中与B互为同分异构体的是________(填编号)
20.Ⅰ.现有①甲烷、②乙烯、③苯、④乙酸、⑤甘氨酸(氨基乙酸)5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子都共平面的是__________________。
(2)含氢量最高的是_______,含碳量最高的是________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的是__________。
(4)其中含有两种不同官能团的有机物是_____,其结构简式为________________,官能团的名称分别为__________和__________。
Ⅱ.下图表示4个碳原子相互结合的几种方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(5)图中属于烷烃的是______(填字母)。
(6)上图中A与________、B与________、D与_____互为同分异构体(填字母)。
21.(1)如图所示装置:
若烧杯中溶液为稀硫酸,则观察到的现象为_____________。
若烧杯中溶液为氢氧化钠溶液,则负极电极式是_____________。
(2)油脂在人体内的化学变化主要是在脂肪酶的催化下,进行水解,生成____________________。
(3)蛋白质的鉴别方法是_____________________________。
(4)淀粉的水解反应方程式是________________________,欲检验淀粉水解情况所需试剂是(水解液已调至碱性)_____________________。
22.如图是四种常见有机物的比例模型,请回答下列问题:
(1)丁的俗名是____,医疗上用于消毒的浓度是____。
(2)上述物质中,____(填名称)是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小。向其中加入溴水,振荡静置后,观察到的现象是____
(3)乙与溴的四氯化碳溶液反应的生成物名称为____。写出在一定条件下,乙发生聚合反应生成高分子化合物的化学方程式:____
(4)甲是我国已启动的“西气东输”工程中的“气”(指天然气)的主要成分,其电子式为____,结构式为____,分子里各原子的空间分布呈____结构。
(5)用甲作燃料的碱性燃料电池中,电极材料为多孔情性金属电极,则负极的电极反应式为____
23.有下列各组物质:① 和 ;②石墨和足球烯;③正丁烷和异丁烷;④丙烷和庚烷;⑤和 ⑥CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3.用序号填空:
(1)___________组互为同位素。
(2)___________组互为同素异形体。
(3)___________组属于同系物。
(4)___________组互为同分异构体。
(5)___________组是同一物质。
24.生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:
资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量(沸点57.6℃)和HC1(沸点-84.7℃)
(1)流程①焦炭体现了___________(填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________。
流程④制备高纯硅的装置如图(热源及夹持装置略去):
(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________(填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________(填试剂名称);装置C中的烧瓶需要加热,其目的是___________。
(5)反应一段时间后,装置D中观察到的现象是___________。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________,该流程中能够循环利用的物质是___________。
试卷第1页,共3页
7
参考答案:
1.A
【详解】
食醋的主要成分式醋酸,即乙酸(CH3COOH),故答案选A。
2.A
【详解】
A、碳酸氢钠做膨松剂不是因为与碱反应,是因为碳酸氢钠受热分解产生二氧化碳气体,A错误;
B、还原铁粉具有还原性,易和氧气反应,常用来作食品内的吸氧剂,B正确;
C、水玻璃是硅酸钠的水溶液,具有黏性,可作粘合剂;硅酸钠溶液涂刷木材,能渗入缝隙中,固化的硅凝胶能堵塞毛细孔通道,提高材料的密度和强度,因此可以有效的防火,故C正确;
D、盐析为是指加浓无机盐溶液降低蛋白质的溶解,促进蛋白质变成沉淀析出,可逆过程,不影响蛋白质的活性,故D正确;
答案选A。
3.A
【详解】
甘油和水互溶,不能用过滤、分液的方法分离,而二者沸点不同,可用蒸馏的方法分离,故选A。
4.A
【详解】
C7H16属于烷烃,分子中有3个-CH3,则分子中含有1条支链,
若支链为-CH3,则有CH3CH(CH3)CH2CH2CH2CH3、CH3CH2CH(CH3)CH2CH2CH3;
若支链为-CH2CH3,则有:(CH3CH2)3CH,支链不可能有3个碳原子,符合条件的同分异构体有3种,故合理选项是A。
5.B
【详解】
A、水蒸气使CuSO4变蓝过程的反应为:CuSO4+5H2O= CuSO4·5H2O,此过程不涉及还原反应,故A不符合题意;
B、Cl2使FeCl2溶液变黄过程的反应为:2Fe2++Cl2=2Fe3++2Cl-,Cl元素化合价降低,Cl2被还原,故B符合题意;
C、CH2=CH2使溴水褪色过程的反应为:CH2=CH2+Br2→CH2BrCH2Br,乙烯中C元素化合价升高,乙烯被氧化,故C不符合题意;
D、H2S使H2SO3溶液变浊过程的反应为:H2S+H2SO3=S↓+3H2O,H2S中S元素化合价升高,H2S被氧化,故D不符合题意;
故答案为B。
6.C
【详解】
A.酸性高锰酸钾溶液会将乙烯氧化为二氧化碳,使甲烷中又混入二氧化碳气体,不能达到除杂目的,A不符合题意;
B.适量稀盐酸与碳酸钠反应可生成碳酸氢钠,但会引入新的杂质氯化钠,不能达到最终目的,B不符合题意;
C.饱和碳酸钠可中和乙酸,并降低乙酸乙酯在水中的溶解度,最后静置、分液,能达到实验目的,C符合题意;
D.饱和碳酸钠溶液即可以与HCl反应,也可以与二氧化碳反应,不能达到除杂目的,D不符合题意;
故选C。
7.D
【详解】
A.N原子之间形成三对共用电子对,达8电子稳定结构,氮气电子式为 ,选项A正确;
B.CO2中碳原子与氧原子之间是双键,结构式:O═C═O,选项B正确;
C.氧原子的原子核内含有8个质子,原子核外含有8个电子,氧的原子结构示意图为: ,选项C正确;
D.中子数为18的硫原子应表示为,选项D错误。
答案选D。
8.B
【详解】
A.含有肽键,可发生水解,水解可生成羧基和氨基,可发生缩聚反应,故A正确;
B.含有羟基,与羟基相连碳的邻位碳上无氢,不能发生消去反应,故B错误;
C.含有2个羟基,可在催化条件下发生氧化生成醛基和羰基,故C正确;
D.能与氢氧化钠溶液反应的为羧基和肽键,则l mo l 该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH,故D正确;
故选:B。
9.A
【详解】
A.高温可以使蛋白质变性,使其失去生理活性,杀死病毒,故A正确;
B.医疗卫生机构用75%(体积分数)的酒精杀菌消毒,故B错误;
C.胶体粒子的直径在1~100nm之间,而新冠病毒直径大约在60~140nm,所以直径60~100nm之间的新冠病毒扩散到空气中可以形成胶体,故C错误;
D.84消毒液(主要成分NaClO)本身具有强氧化性,加入浓盐酸会产生有毒的氯气,不能混用,故D错误;
故选A。
10.B
【详解】
A.甲烷和浓盐酸不反应,选项A错误;
B.乙烯和乙醇均能与酸性KMnO4溶液发生氧化反应而使其褪色,反应的原理相同,选项B正确;
C.甲苯中存在甲基,所以氢原子不可能与碳原子在同一平面上,选项C错误;
D.因二糖、多糖能发生水解,单糖不能发生水解,葡萄糖、果糖是单糖,蔗糖是二糖,选项D错误;
答案选B。
11.B
【详解】
A、乙酸丁酯分子量大溶沸点高,不易转移出去,故采用冷凝回流少量的反应物和产物,乙酸乙酯沸点低易挥发出收集在试管中,A正确;
B、b是冷凝回流,a是导气,B错误;
C、Na2CO3溶液反应掉未反应的酸和溶解醇,C正确;
D、反应为可逆反应,增加一种反应物的量可以提高另一种反应物的转化率,D正确。
答案选B。
12.B
【详解】
①若把铜线和铝线绞接在一起与潮湿的空气接触形成原电池,加快铝导线的腐蚀,错误;
②汽车尾气中含有能污染空气的氮的氧化物,原因是空气中的氮气和氧气在汽缸中放电条件下生成NO,错误;
③葡萄糖中含有醛基,与新制氢氧化铜共热生成氧化亚铜砖红色沉淀,可用新制备Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖,正确;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解的亚硫酸被空气中的氧气氧化为硫酸,错误;
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝胶体,正确;
⑥“水滴石空”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故,正确;
综上,①②④错误,答案选B。
13.BD
【详解】
A.b含有饱和碳原子,具有甲烷的结构特征,则所有原子不可能都在一个平面内,故A错误;
B.b含碳碳双键,可发生加成、氧化、加聚反应,故B正确;
C.p中与溴原子相连的碳原子邻位碳原子上没有氢原子,p不能发生消去反应,故C错误;
D.m的分子式为C7H8O,m的属于芳香族化合物的同分异构体含苯环、还含1个O、1个C,为苯甲醚、苯甲醇、邻甲基苯酚、间甲基苯酚、对甲基苯酚,共5种,故D正确;
故答案选BD。
14.CD
【详解】
A.有机物B的分子式为C11H18O3,故A错误;
B.B中含有羧基和醇羟基,1mol B含有1mol羧基和1mol醇羟基,与足量的Na反应可产生1mol氢气,标准状况下体积为22.4L,故B错误;
C.有机物C中含碳碳双键、C=O键、2个环状结构,不饱和度为4,则同分异构体中可能存在芳香族化合物,故C正确;
D.A中含有碳碳双键,可发生加成反应、氧化反应,含有甲基、亚甲基,可以发生取代反应,含有羧基,可发生酯化反应等,故D正确;
答案选CD。
15.BC
【详解】
A. 分子中含有酚羟基和碳碳双键,均不能和NaHCO3溶液反应,A项错误;
B. 白藜芦醇中不同环境的氢原子的个数可表示如图: ,故共含有8种化学环境不同的氢原子,B项正确;
C. 1 mol白藜芦醇分子中2mol苯环最多能与6 mol氢气发生加成反应,1 mol碳碳双键可和1 mol氢气加成,故1 mol白黎芦醇最多能与7 mol氢气加成,C项正确;
D. 1 mol白黎芦醇分子中苯环上羟基邻对位的取代反应消耗5molBr2,碳碳双键与溴的加成反应消耗1molBr2,故最多能反应溴水中的6 molBr2,D项错误;
答案选BC。
16.CD
【详解】
A.步骤I为研磨,研磨操作需要在研钵中进行,故A错误;
B.经过步骤Ⅱ得到溶液和不溶物,步骤Ⅱ是过滤,故B错误;
C.步骤Ⅲ为萃取分液,振荡分液漏斗时尖嘴需要向上倾斜,并及时放气,故C正确;
D.步骤V是蒸馏,分离出来的乙苯可返回步骤Ⅱ中循环利用,故D正确;
故选CD。
17. 无色 无味 气体 小 难溶
【详解】
甲烷是无色无味的气体,密度比空气小,难溶于水,故答案为:无色;无味;气体;小;难溶。
18. 羧基 A
【详解】
(1)CH3COOH的官能团为—COOH,名称为羧基;
(2)化合物A为乙烯,官能团是碳碳双键,该物质既可以与溴水发生加成反应使溴水褪色,也可以被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液。而化合物B是乙醇,官能团是羟基,只能被酸性高锰酸钾溶液氧化而使溶液褪色,不能与溴水发生反应。故既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的物质序号是A。
19. ACH AC EFH
【详解】
(1)图中属于烷烃的是分子中不含有不饱和键的链状烃,故选ACH。答案为:ACH;
(2)图中属于甲烷同系物的是分子中只含有单键的链状烃(甲烷除外),故选AC。答案为:AC;
(3)图中B的分子式为C4H8,与B互为同分异构体的是EFH。答案为:EFH。
20. ②、③ ① ③ ②、④ ⑤ H2NCH2COOH 羧基(或氨基) 氨基(或羧基) A、C C EF G
【详解】
Ⅰ.(1)甲烷、乙酸和甘氨酸分子中均含有饱和碳原子,分子中所有原子不可能都共平面;乙烯和苯是平面形结构,分子中所有原子都共平面,答案选②③。
(2)根据有机物分子式可判断含氢量最高的是甲烷,答案选①;含碳量最高的是苯,答案选③。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1,这说明有机物分子中碳氢原子的个数之比是1∶2,符合条件的是乙烯和乙酸,答案选②④。
(5)甲烷和苯不含有官能团,乙烯含有碳碳双键,乙酸含有羧基,甘氨酸含有氨基和羧基,则含有两种不同官能团的有机物是甘氨酸,其结构简式为H2NCH2COOH。
Ⅱ.根据有机物的结构模型可知A是正丁烷,B是2-丁烯,C是异丁烷,D是2-丁炔,E是1-丁烯,F是2-甲基-1-丙烯,G是1-丁炔。则
(5)图中属于烷烃的是正丁烷和异丁烷,答案选AC。
(6)分子式相同,结构不同的化合物互为同分异构体,则上图中A与C、B与EF、D与G互为同分异构体。
21. 镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转 Al+4OH--3e-=+2H2O 高级脂肪酸和甘油 蛋白质的颜色反应(加浓硝酸变黄)或者烧焦时的特殊气味进行鉴别 碘水和新制的Cu(OH)2悬浊液(或碘水和银氨溶液)
【详解】
(1)若烧杯中溶液为稀硫酸,则该原电池总反应为,镁为原电池的负极,镁失去电子被氧化,铝为正极,氢离子在铝电极上得电子被还原,产生氢气,此过程中化学能转化为电能,则观察到的现象为镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;若烧杯中溶液为氢氧化钠溶液,则该原电池总反应为:,Al为原电池的负极,Al失去电子被氧化,在碱性溶液中生成偏铝酸根,则负极电极式是Al+4OH--3e-=+2H2O;答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;Al+4OH--3e-=+2H2O;
(2)油脂的成分为高级脂肪酸的甘油酯,在人体内的脂肪酶的催化下,进行水解,生成高级脂肪酸和甘油;答案为:高级脂肪酸和甘油;
(3)利用蛋白质的特征反应即可鉴别:蛋白质灼烧时有羽毛烧焦的特殊气味或有颜色反应;答案为:蛋白质的颜色反应(加浓硝酸变黄)或者烧焦时的特殊气味进行鉴别;
(4)淀粉与稀硫酸溶液共热时可发生水解反应,稀硫酸是催化剂,故水解的方程式是;欲检验淀粉水解情况,主要是检测水解液中是否还有淀粉残留、是否有还原性糖葡萄糖生成,检测淀粉需要碘水,检测葡萄糖所需试剂是在碱性溶液中加入新制的Cu(OH)2悬浊液(或银氨溶液);答案为:淀粉的水解反应方程;碘水和新制的Cu(OH)2悬浊液(或碘水和银氨溶液)。
22. 酒精 75% 苯 液体分层,上层为橙色,下层为无色 1,2﹣二溴乙烷 nCH2=CH2 正四面体 CH4+10OH﹣﹣8e﹣=+7H2O
【详解】
(1)丁为CH3CH2OH,俗名为酒精;医疗上用体积分数为75%的酒精进行消毒;
(2)上述物质中,苯是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小;溴在苯中的溶解度更大,所以苯可以萃取溴水中的溴,苯密度比水小,所以萃取分层后,有机层在上层,观察到的现象为液体分层,上层为橙色,下层为无色;
(3)乙为CH2=CH2,可以与溴发生加成反应生成BrCH2CH2Br,名称为1,2﹣二溴乙烷;乙烯中含有碳碳双键,可以发生加聚反应,化学方程式为nCH2=CH2;
(4)甲为CH4,电子式为,结构式为;分子里各原子的空间分布呈正四面体结构;
(5)甲烷燃料电池甲烷被氧气氧化成二氧化碳和水,所以通入甲烷的一极为负极,电解质溶液呈碱性,则生成的二氧化碳会和氢氧根反应生成碳酸根,所以电极反应式为CH4+10OH﹣﹣8e﹣=+7H2O。
23.(1)①(2)②(3)④(4)③⑥(5)⑤
【分析】
(1) 和为碳元素的两种不同的核素,属于同位素,故选①;
(2)石墨和足球烯为碳元素形成的两种不同的单质,属于同素异形体,故选②;
(3)丙烷和庚烷都属于烷烃,结构相似,分子组成相差4个CH2,属于同系物,故选④;
(4)正丁烷和异丁烷分子式均为C4H10,但结构不同,二者互为同分异构体,CH3-CH2-CH2-CH3和CH3-CH(CH3)CH3的分子式均为C4H10,但结构不同,二者互为同分异构体,故选③⑥;
(5)由于甲烷是正四面体结构,与碳原子直接相连的H原子两两相邻,所以其二溴代物只有一种,即和为同一种物质,故选⑤。
24.(1)还原性(2)蒸馏(3)SiHCl3+H2Si+3HCl(4) abg 浓硫酸 使进入烧瓶的液态SiHCl3变为气体
(5)有固体物质生成(6) 排尽装置内的空气 HCl
【分析】
石英砂中主要成分为SiO2,与C在高温下反应生成粗Si,2C+SiO2Si+2CO↑,粗Si与HCl在300℃以上反应生成粗SiHCl3,粗SiHCl3中含有少量的SiCl4,根据二者沸点的不同,可以采取蒸馏的方法分离,纯SiHCl3在1084℃的条件下与H2反应生成纯Si,SiHCl3+H2Si+3HCl。
(1)根据分析,流程①的反应为2C+SiO2Si+2CO↑,C的化合价升高,是还原剂;
(2)根据分析,流程③提纯SiHCl3的操作是蒸馏;
(3)根据分析,流程④的化学反应为SiHCl3+H2Si+3HCl
(4)气体发生装置用于制备H2,属于固液不加热制气体的装置,因此需要烧瓶、分液漏斗、导管,故选abg;由于SiHCl3能与H2O剧烈反应,因此在制备SiHCl3时需将水除去,B装置中盛放能吸水的浓硫酸;进入烧瓶的SiHCl3为液体,需要变为气体进入D装置中发生反应,因此加热的目的是使进入烧瓶的液态SiHCl3变为气体;
(5)根据SiHCl3+H2Si+3HCl可知,反应一段时间后生成Si单质,为固体,故D中的现象为有固体物质生成;
(6)生成的Si可能被氧化,且反应中需要易燃的H2,因此需将装置中的空气排出,防止生成的Si被氧化,同时防止H2与O2混合加热发生爆炸;HCl是流程④的生成物,又是流程②的反应物,因此可以循环。
答案第1页,共2页
一、选择题(共16题)
1.食醋的主要成分是
A.乙酸 B.乙醇 C.油脂 D.苯
2.下列说法不正确的是
A.NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂
B.还原铁粉可用作食品袋内的抗氧化剂
C.水玻璃可用于生产黏合剂和防火剂
D.盐析可提纯蛋白质并保持其生理活性
3.甘油是一种常用的有机溶剂,可与水以任意体积比互溶,密度约为1.26g/mL,沸点约为290℃。分离水和甘油应采用的方法是
A.蒸馏 B.蒸发 C.过滤 D.萃取、分液
4.分子中有3个-CH3的C7H16,其可能的结构有
A.3种 B.4种 C.5种 D.6种
5.下列变化中,气体被还原的是
A.水蒸气使CuSO4变蓝 B.Cl2使FeCl2溶液变黄
C.CH2=CH2使溴水褪色 D.H2S使H2SO3溶液变浊
6.下列除去杂质的操作或方法中,能达到最终目的的是
选项 主要成分(杂质) 实验操作或方法
A 甲烷(乙烯) 将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶
B 碳酸氢钠溶液(碳酸钠) 向混合溶液中滴加适量稀盐酸
C 乙酸乙酯(乙酸) 将混合液加入饱和碳酸钠溶液中,振荡、静置、分液
D 二氧化碳(氯化氢) 将混合气体通过盛有饱和碳酸钠溶液的洗气瓶
A.A B.B C.C D.D
7.汽车尾气催化转化器中发生的反应有、。下列有关化学用语错误的是
A.氮气的电子式: B.的结构式:
C.氧的原子结构示意图: D.中子数为18的硫原子:
8.泛酸又称为维生素B5,在人体内参与糖、油脂、蛋白质的代谢过程,具有抗脂质过氧化作用,其结构如下,下列有关该化合物的说法不正确的是
A.该物质可发生水解反应,水解产物均能发生缩聚反应
B.该物质在浓硫酸、Al2O3或 P2O5等催化剂作用下可发生脱水反应,生成碳碳双键
C.该物质在铜、银等催化剂存在下可以被氧气氧化生成醛基和酮羰基
D.1 mol该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH
9.新冠病毒由蛋白质和核酸组成,直径大约在60~140nm,怕酒精,不耐高温。下列说法正确的是
A.高温可使新冠病毒失去活性
B.医用酒精中乙醇的体积分数为95%
C.新冠病毒扩散到空气中不可能形成胶体
D.“84”消毒液(主要成分NaClO)中加入浓盐酸可以增强消毒效果
10.下列说法正确的是( )
A.室温时甲烷能与浓盐酸发生取代反应
B.乙烯和乙醇使酸性KMnO4溶液褪色的原理相同
C.苯与甲苯分子中所有原子均位于同一平面
D.葡萄糖、果糖和蔗糖都可以发生水解反应
11.现有下列两套实验装置,用于实验室制取乙酸乙酯或乙酸丁酯。下列说法错误的是
A.图I装置用于制取乙酸乙酯,图II 装置用于制取乙酸丁酯
B.导管a和导管b的作用都是冷凝回流
C.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
D.加入过量的乙酸可以提高醇的转化率
12.下列说法中不正确的是
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
②汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
A.②③⑤ B.①②④ C.③④⑥ D.③④⑤
13.环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
14.胡妥油(D)是香料的原料,它可由 A 合成得到:
下列说法正确的是
A.有机物 B 的分子式为 C11H19O3
B.1mol B 与足量的 Na 反应可产生 11.2LH 2 (已换算成标准状况)
C.有机物 C 的所有同分异构体中可能有芳香族化合物存在
D.一定条件下,A分别可以发生加成、取代、氧化等反应
15.白黎芦醇具有抗氧化和预防心血管疾病的作用,下列有关白黎芦醇的说法正确的是
A.白黎芦醇能与NaHCO3溶液反应
B.分子中共含有8种化学环境不同的氢原子
C.1 mol白黎芦醇最多能与7 mol氢气加成
D.1 mol白黎芦醇最多能反应溴水中的3.5 molBr2
16.海洋生物体内含有丰富的药物活性物质,从一种海生动物体内提取某种有机活性固体物的流程如下:
下列说法正确的是
A.步骤I的操作在蒸发皿中进行
B.步骤Ⅱ中主要操作名称为分液
C.步骤Ⅲ中振荡分液漏斗时尖嘴向上倾斜
D.步骤V所得乙苯可返回步骤Ⅱ循环利用
二、综合题
17.甲烷的物理性质
颜色 气味 状态 密度 水溶性
_______ _______ _______ 比空气_______ _______
18.乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
19.如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是________(填编号)
(2)图中属于甲烷同系物的是________(填编号)
(3)图中与B互为同分异构体的是________(填编号)
20.Ⅰ.现有①甲烷、②乙烯、③苯、④乙酸、⑤甘氨酸(氨基乙酸)5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子都共平面的是__________________。
(2)含氢量最高的是_______,含碳量最高的是________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的是__________。
(4)其中含有两种不同官能团的有机物是_____,其结构简式为________________,官能团的名称分别为__________和__________。
Ⅱ.下图表示4个碳原子相互结合的几种方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(5)图中属于烷烃的是______(填字母)。
(6)上图中A与________、B与________、D与_____互为同分异构体(填字母)。
21.(1)如图所示装置:
若烧杯中溶液为稀硫酸,则观察到的现象为_____________。
若烧杯中溶液为氢氧化钠溶液,则负极电极式是_____________。
(2)油脂在人体内的化学变化主要是在脂肪酶的催化下,进行水解,生成____________________。
(3)蛋白质的鉴别方法是_____________________________。
(4)淀粉的水解反应方程式是________________________,欲检验淀粉水解情况所需试剂是(水解液已调至碱性)_____________________。
22.如图是四种常见有机物的比例模型,请回答下列问题:
(1)丁的俗名是____,医疗上用于消毒的浓度是____。
(2)上述物质中,____(填名称)是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小。向其中加入溴水,振荡静置后,观察到的现象是____
(3)乙与溴的四氯化碳溶液反应的生成物名称为____。写出在一定条件下,乙发生聚合反应生成高分子化合物的化学方程式:____
(4)甲是我国已启动的“西气东输”工程中的“气”(指天然气)的主要成分,其电子式为____,结构式为____,分子里各原子的空间分布呈____结构。
(5)用甲作燃料的碱性燃料电池中,电极材料为多孔情性金属电极,则负极的电极反应式为____
23.有下列各组物质:① 和 ;②石墨和足球烯;③正丁烷和异丁烷;④丙烷和庚烷;⑤和 ⑥CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3.用序号填空:
(1)___________组互为同位素。
(2)___________组互为同素异形体。
(3)___________组属于同系物。
(4)___________组互为同分异构体。
(5)___________组是同一物质。
24.生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:
资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量(沸点57.6℃)和HC1(沸点-84.7℃)
(1)流程①焦炭体现了___________(填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________。
流程④制备高纯硅的装置如图(热源及夹持装置略去):
(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________(填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________(填试剂名称);装置C中的烧瓶需要加热,其目的是___________。
(5)反应一段时间后,装置D中观察到的现象是___________。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________,该流程中能够循环利用的物质是___________。
试卷第1页,共3页
7
参考答案:
1.A
【详解】
食醋的主要成分式醋酸,即乙酸(CH3COOH),故答案选A。
2.A
【详解】
A、碳酸氢钠做膨松剂不是因为与碱反应,是因为碳酸氢钠受热分解产生二氧化碳气体,A错误;
B、还原铁粉具有还原性,易和氧气反应,常用来作食品内的吸氧剂,B正确;
C、水玻璃是硅酸钠的水溶液,具有黏性,可作粘合剂;硅酸钠溶液涂刷木材,能渗入缝隙中,固化的硅凝胶能堵塞毛细孔通道,提高材料的密度和强度,因此可以有效的防火,故C正确;
D、盐析为是指加浓无机盐溶液降低蛋白质的溶解,促进蛋白质变成沉淀析出,可逆过程,不影响蛋白质的活性,故D正确;
答案选A。
3.A
【详解】
甘油和水互溶,不能用过滤、分液的方法分离,而二者沸点不同,可用蒸馏的方法分离,故选A。
4.A
【详解】
C7H16属于烷烃,分子中有3个-CH3,则分子中含有1条支链,
若支链为-CH3,则有CH3CH(CH3)CH2CH2CH2CH3、CH3CH2CH(CH3)CH2CH2CH3;
若支链为-CH2CH3,则有:(CH3CH2)3CH,支链不可能有3个碳原子,符合条件的同分异构体有3种,故合理选项是A。
5.B
【详解】
A、水蒸气使CuSO4变蓝过程的反应为:CuSO4+5H2O= CuSO4·5H2O,此过程不涉及还原反应,故A不符合题意;
B、Cl2使FeCl2溶液变黄过程的反应为:2Fe2++Cl2=2Fe3++2Cl-,Cl元素化合价降低,Cl2被还原,故B符合题意;
C、CH2=CH2使溴水褪色过程的反应为:CH2=CH2+Br2→CH2BrCH2Br,乙烯中C元素化合价升高,乙烯被氧化,故C不符合题意;
D、H2S使H2SO3溶液变浊过程的反应为:H2S+H2SO3=S↓+3H2O,H2S中S元素化合价升高,H2S被氧化,故D不符合题意;
故答案为B。
6.C
【详解】
A.酸性高锰酸钾溶液会将乙烯氧化为二氧化碳,使甲烷中又混入二氧化碳气体,不能达到除杂目的,A不符合题意;
B.适量稀盐酸与碳酸钠反应可生成碳酸氢钠,但会引入新的杂质氯化钠,不能达到最终目的,B不符合题意;
C.饱和碳酸钠可中和乙酸,并降低乙酸乙酯在水中的溶解度,最后静置、分液,能达到实验目的,C符合题意;
D.饱和碳酸钠溶液即可以与HCl反应,也可以与二氧化碳反应,不能达到除杂目的,D不符合题意;
故选C。
7.D
【详解】
A.N原子之间形成三对共用电子对,达8电子稳定结构,氮气电子式为 ,选项A正确;
B.CO2中碳原子与氧原子之间是双键,结构式:O═C═O,选项B正确;
C.氧原子的原子核内含有8个质子,原子核外含有8个电子,氧的原子结构示意图为: ,选项C正确;
D.中子数为18的硫原子应表示为,选项D错误。
答案选D。
8.B
【详解】
A.含有肽键,可发生水解,水解可生成羧基和氨基,可发生缩聚反应,故A正确;
B.含有羟基,与羟基相连碳的邻位碳上无氢,不能发生消去反应,故B错误;
C.含有2个羟基,可在催化条件下发生氧化生成醛基和羰基,故C正确;
D.能与氢氧化钠溶液反应的为羧基和肽键,则l mo l 该物质与足量NaOH 溶液反应,最多可消耗2 mol NaOH,故D正确;
故选:B。
9.A
【详解】
A.高温可以使蛋白质变性,使其失去生理活性,杀死病毒,故A正确;
B.医疗卫生机构用75%(体积分数)的酒精杀菌消毒,故B错误;
C.胶体粒子的直径在1~100nm之间,而新冠病毒直径大约在60~140nm,所以直径60~100nm之间的新冠病毒扩散到空气中可以形成胶体,故C错误;
D.84消毒液(主要成分NaClO)本身具有强氧化性,加入浓盐酸会产生有毒的氯气,不能混用,故D错误;
故选A。
10.B
【详解】
A.甲烷和浓盐酸不反应,选项A错误;
B.乙烯和乙醇均能与酸性KMnO4溶液发生氧化反应而使其褪色,反应的原理相同,选项B正确;
C.甲苯中存在甲基,所以氢原子不可能与碳原子在同一平面上,选项C错误;
D.因二糖、多糖能发生水解,单糖不能发生水解,葡萄糖、果糖是单糖,蔗糖是二糖,选项D错误;
答案选B。
11.B
【详解】
A、乙酸丁酯分子量大溶沸点高,不易转移出去,故采用冷凝回流少量的反应物和产物,乙酸乙酯沸点低易挥发出收集在试管中,A正确;
B、b是冷凝回流,a是导气,B错误;
C、Na2CO3溶液反应掉未反应的酸和溶解醇,C正确;
D、反应为可逆反应,增加一种反应物的量可以提高另一种反应物的转化率,D正确。
答案选B。
12.B
【详解】
①若把铜线和铝线绞接在一起与潮湿的空气接触形成原电池,加快铝导线的腐蚀,错误;
②汽车尾气中含有能污染空气的氮的氧化物,原因是空气中的氮气和氧气在汽缸中放电条件下生成NO,错误;
③葡萄糖中含有醛基,与新制氢氧化铜共热生成氧化亚铜砖红色沉淀,可用新制备Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖,正确;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解的亚硫酸被空气中的氧气氧化为硫酸,错误;
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝胶体,正确;
⑥“水滴石空”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故,正确;
综上,①②④错误,答案选B。
13.BD
【详解】
A.b含有饱和碳原子,具有甲烷的结构特征,则所有原子不可能都在一个平面内,故A错误;
B.b含碳碳双键,可发生加成、氧化、加聚反应,故B正确;
C.p中与溴原子相连的碳原子邻位碳原子上没有氢原子,p不能发生消去反应,故C错误;
D.m的分子式为C7H8O,m的属于芳香族化合物的同分异构体含苯环、还含1个O、1个C,为苯甲醚、苯甲醇、邻甲基苯酚、间甲基苯酚、对甲基苯酚,共5种,故D正确;
故答案选BD。
14.CD
【详解】
A.有机物B的分子式为C11H18O3,故A错误;
B.B中含有羧基和醇羟基,1mol B含有1mol羧基和1mol醇羟基,与足量的Na反应可产生1mol氢气,标准状况下体积为22.4L,故B错误;
C.有机物C中含碳碳双键、C=O键、2个环状结构,不饱和度为4,则同分异构体中可能存在芳香族化合物,故C正确;
D.A中含有碳碳双键,可发生加成反应、氧化反应,含有甲基、亚甲基,可以发生取代反应,含有羧基,可发生酯化反应等,故D正确;
答案选CD。
15.BC
【详解】
A. 分子中含有酚羟基和碳碳双键,均不能和NaHCO3溶液反应,A项错误;
B. 白藜芦醇中不同环境的氢原子的个数可表示如图: ,故共含有8种化学环境不同的氢原子,B项正确;
C. 1 mol白藜芦醇分子中2mol苯环最多能与6 mol氢气发生加成反应,1 mol碳碳双键可和1 mol氢气加成,故1 mol白黎芦醇最多能与7 mol氢气加成,C项正确;
D. 1 mol白黎芦醇分子中苯环上羟基邻对位的取代反应消耗5molBr2,碳碳双键与溴的加成反应消耗1molBr2,故最多能反应溴水中的6 molBr2,D项错误;
答案选BC。
16.CD
【详解】
A.步骤I为研磨,研磨操作需要在研钵中进行,故A错误;
B.经过步骤Ⅱ得到溶液和不溶物,步骤Ⅱ是过滤,故B错误;
C.步骤Ⅲ为萃取分液,振荡分液漏斗时尖嘴需要向上倾斜,并及时放气,故C正确;
D.步骤V是蒸馏,分离出来的乙苯可返回步骤Ⅱ中循环利用,故D正确;
故选CD。
17. 无色 无味 气体 小 难溶
【详解】
甲烷是无色无味的气体,密度比空气小,难溶于水,故答案为:无色;无味;气体;小;难溶。
18. 羧基 A
【详解】
(1)CH3COOH的官能团为—COOH,名称为羧基;
(2)化合物A为乙烯,官能团是碳碳双键,该物质既可以与溴水发生加成反应使溴水褪色,也可以被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液。而化合物B是乙醇,官能团是羟基,只能被酸性高锰酸钾溶液氧化而使溶液褪色,不能与溴水发生反应。故既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的物质序号是A。
19. ACH AC EFH
【详解】
(1)图中属于烷烃的是分子中不含有不饱和键的链状烃,故选ACH。答案为:ACH;
(2)图中属于甲烷同系物的是分子中只含有单键的链状烃(甲烷除外),故选AC。答案为:AC;
(3)图中B的分子式为C4H8,与B互为同分异构体的是EFH。答案为:EFH。
20. ②、③ ① ③ ②、④ ⑤ H2NCH2COOH 羧基(或氨基) 氨基(或羧基) A、C C EF G
【详解】
Ⅰ.(1)甲烷、乙酸和甘氨酸分子中均含有饱和碳原子,分子中所有原子不可能都共平面;乙烯和苯是平面形结构,分子中所有原子都共平面,答案选②③。
(2)根据有机物分子式可判断含氢量最高的是甲烷,答案选①;含碳量最高的是苯,答案选③。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1,这说明有机物分子中碳氢原子的个数之比是1∶2,符合条件的是乙烯和乙酸,答案选②④。
(5)甲烷和苯不含有官能团,乙烯含有碳碳双键,乙酸含有羧基,甘氨酸含有氨基和羧基,则含有两种不同官能团的有机物是甘氨酸,其结构简式为H2NCH2COOH。
Ⅱ.根据有机物的结构模型可知A是正丁烷,B是2-丁烯,C是异丁烷,D是2-丁炔,E是1-丁烯,F是2-甲基-1-丙烯,G是1-丁炔。则
(5)图中属于烷烃的是正丁烷和异丁烷,答案选AC。
(6)分子式相同,结构不同的化合物互为同分异构体,则上图中A与C、B与EF、D与G互为同分异构体。
21. 镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转 Al+4OH--3e-=+2H2O 高级脂肪酸和甘油 蛋白质的颜色反应(加浓硝酸变黄)或者烧焦时的特殊气味进行鉴别 碘水和新制的Cu(OH)2悬浊液(或碘水和银氨溶液)
【详解】
(1)若烧杯中溶液为稀硫酸,则该原电池总反应为,镁为原电池的负极,镁失去电子被氧化,铝为正极,氢离子在铝电极上得电子被还原,产生氢气,此过程中化学能转化为电能,则观察到的现象为镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;若烧杯中溶液为氢氧化钠溶液,则该原电池总反应为:,Al为原电池的负极,Al失去电子被氧化,在碱性溶液中生成偏铝酸根,则负极电极式是Al+4OH--3e-=+2H2O;答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;Al+4OH--3e-=+2H2O;
(2)油脂的成分为高级脂肪酸的甘油酯,在人体内的脂肪酶的催化下,进行水解,生成高级脂肪酸和甘油;答案为:高级脂肪酸和甘油;
(3)利用蛋白质的特征反应即可鉴别:蛋白质灼烧时有羽毛烧焦的特殊气味或有颜色反应;答案为:蛋白质的颜色反应(加浓硝酸变黄)或者烧焦时的特殊气味进行鉴别;
(4)淀粉与稀硫酸溶液共热时可发生水解反应,稀硫酸是催化剂,故水解的方程式是;欲检验淀粉水解情况,主要是检测水解液中是否还有淀粉残留、是否有还原性糖葡萄糖生成,检测淀粉需要碘水,检测葡萄糖所需试剂是在碱性溶液中加入新制的Cu(OH)2悬浊液(或银氨溶液);答案为:淀粉的水解反应方程;碘水和新制的Cu(OH)2悬浊液(或碘水和银氨溶液)。
22. 酒精 75% 苯 液体分层,上层为橙色,下层为无色 1,2﹣二溴乙烷 nCH2=CH2 正四面体 CH4+10OH﹣﹣8e﹣=+7H2O
【详解】
(1)丁为CH3CH2OH,俗名为酒精;医疗上用体积分数为75%的酒精进行消毒;
(2)上述物质中,苯是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小;溴在苯中的溶解度更大,所以苯可以萃取溴水中的溴,苯密度比水小,所以萃取分层后,有机层在上层,观察到的现象为液体分层,上层为橙色,下层为无色;
(3)乙为CH2=CH2,可以与溴发生加成反应生成BrCH2CH2Br,名称为1,2﹣二溴乙烷;乙烯中含有碳碳双键,可以发生加聚反应,化学方程式为nCH2=CH2;
(4)甲为CH4,电子式为,结构式为;分子里各原子的空间分布呈正四面体结构;
(5)甲烷燃料电池甲烷被氧气氧化成二氧化碳和水,所以通入甲烷的一极为负极,电解质溶液呈碱性,则生成的二氧化碳会和氢氧根反应生成碳酸根,所以电极反应式为CH4+10OH﹣﹣8e﹣=+7H2O。
23.(1)①(2)②(3)④(4)③⑥(5)⑤
【分析】
(1) 和为碳元素的两种不同的核素,属于同位素,故选①;
(2)石墨和足球烯为碳元素形成的两种不同的单质,属于同素异形体,故选②;
(3)丙烷和庚烷都属于烷烃,结构相似,分子组成相差4个CH2,属于同系物,故选④;
(4)正丁烷和异丁烷分子式均为C4H10,但结构不同,二者互为同分异构体,CH3-CH2-CH2-CH3和CH3-CH(CH3)CH3的分子式均为C4H10,但结构不同,二者互为同分异构体,故选③⑥;
(5)由于甲烷是正四面体结构,与碳原子直接相连的H原子两两相邻,所以其二溴代物只有一种,即和为同一种物质,故选⑤。
24.(1)还原性(2)蒸馏(3)SiHCl3+H2Si+3HCl(4) abg 浓硫酸 使进入烧瓶的液态SiHCl3变为气体
(5)有固体物质生成(6) 排尽装置内的空气 HCl
【分析】
石英砂中主要成分为SiO2,与C在高温下反应生成粗Si,2C+SiO2Si+2CO↑,粗Si与HCl在300℃以上反应生成粗SiHCl3,粗SiHCl3中含有少量的SiCl4,根据二者沸点的不同,可以采取蒸馏的方法分离,纯SiHCl3在1084℃的条件下与H2反应生成纯Si,SiHCl3+H2Si+3HCl。
(1)根据分析,流程①的反应为2C+SiO2Si+2CO↑,C的化合价升高,是还原剂;
(2)根据分析,流程③提纯SiHCl3的操作是蒸馏;
(3)根据分析,流程④的化学反应为SiHCl3+H2Si+3HCl
(4)气体发生装置用于制备H2,属于固液不加热制气体的装置,因此需要烧瓶、分液漏斗、导管,故选abg;由于SiHCl3能与H2O剧烈反应,因此在制备SiHCl3时需将水除去,B装置中盛放能吸水的浓硫酸;进入烧瓶的SiHCl3为液体,需要变为气体进入D装置中发生反应,因此加热的目的是使进入烧瓶的液态SiHCl3变为气体;
(5)根据SiHCl3+H2Si+3HCl可知,反应一段时间后生成Si单质,为固体,故D中的现象为有固体物质生成;
(6)生成的Si可能被氧化,且反应中需要易燃的H2,因此需将装置中的空气排出,防止生成的Si被氧化,同时防止H2与O2混合加热发生爆炸;HCl是流程④的生成物,又是流程②的反应物,因此可以循环。
答案第1页,共2页
