3.2从化石燃料中获取有机化合物——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析)
文档属性
| 名称 | 3.2从化石燃料中获取有机化合物——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 699.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 00:00:00 | ||
图片预览


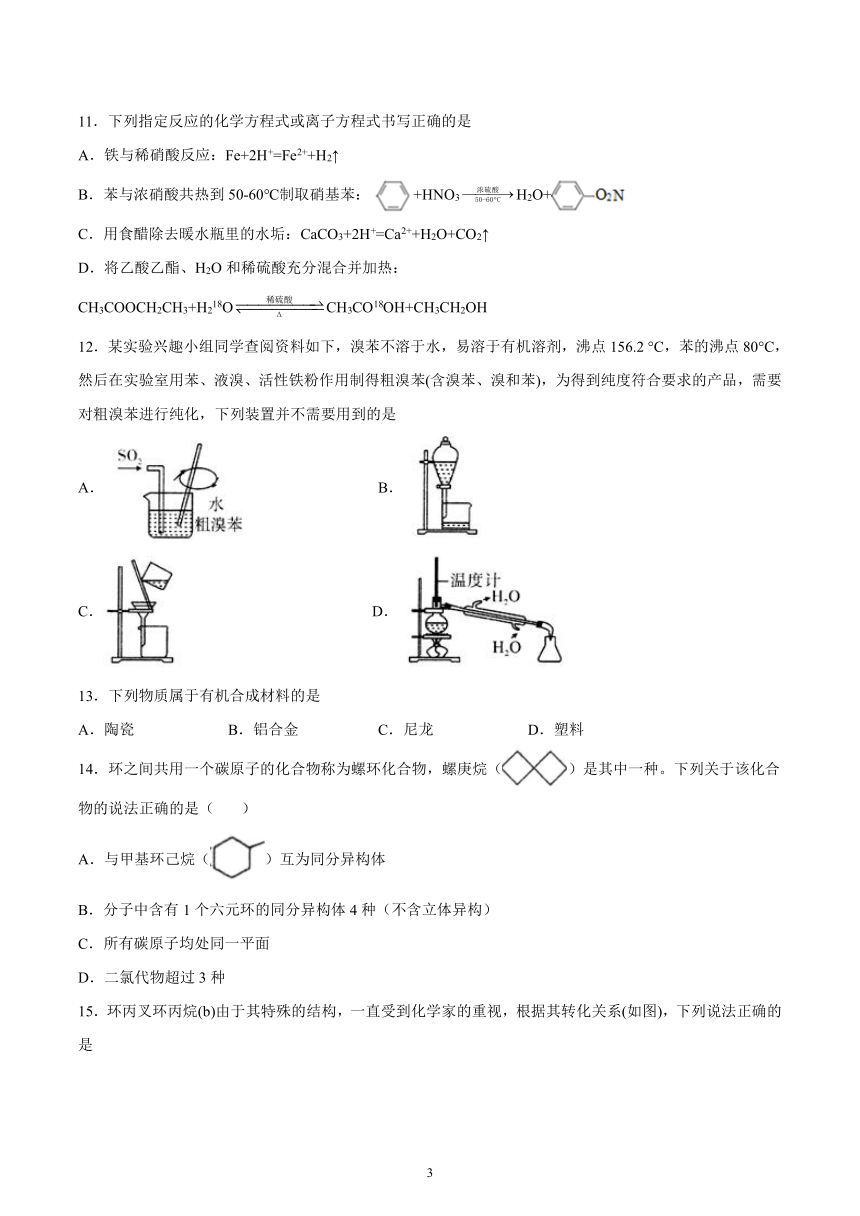

文档简介
3.2从化石燃料中获取有机化合物
一、选择题(共16题)
1.下列说法正确的是
A.积极开发使用可燃冰有助于减少碳排放
B.陈薇院士团队开发的腺病毒载体疫苗(Ad5—CoV疫苗)性质较稳定,该疫苗在常温下保存即可
C.“天和空间站”使用的碳纤维是一种新型有机高分子材料
D.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下发生分子间聚合而成像,该过程是化学变化
2.化学与生产、生活密切相关。下列说法正确的是
A.水泥、水玻璃、水晶均属于硅酸盐产品
B.医用酒精和葡萄糖注射液可用丁达尔效应区分
C.臭氧、二氧化氯均可代替氯水用于自来水消毒
D.工业合成氨、将氨气制成氮肥均属于氮的固定
3.如图是以石油为原料的部分转化流程图,下列说法正确的是( )
A.反应①与反应③反应类型相同 B.反应①与反应④反应类型相同
C.反应③与反应④反应类型相同 D.反应②与反应④反应类型相同
4.下列关于苯的性质的叙述中,不正确的是
A.苯是无色、带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与硝酸发生取代反应
D.苯不具有典型的双键,故不可能发生加成反应
5.某有机物X的结构简式为,下列有关该有机物的说法正确的是
A.分子式为C8H10O3
B.既可以发生加成反应又可以发生取代反应
C.分子中所有碳原子共面
D.含有两种官能团
6.如图是实验室模拟煤的干馏的实验装置:
下列有关叙述错误的是( )
A.图示左侧试管中发生了化学变化
B.实验后右侧试管中水溶液呈碱性,Y是黑色黏稠的煤焦油,上层X是粗苯等
C.气体Z易燃,可以还原氧化铜
D.Y是一种纯净物
7.下列说法正确的是
A.合成纤维和光导纤维都属于新型无机非金属材料
B.有机玻璃的主要成分属于有机高分子化合物
C.纯碱、烧碱、漂白粉都属于盐类
D.二氧化硫、硫酸、氢氧化钠都属于电解质
8.在下述条件下,能发生化学反应的是
A.甲烷与氧气混合并置于光照下
B.在密闭容器中使甲烷受热至1000℃以上
C.将甲烷通入KMnO4酸性溶液中
D.将甲烷通入热的强碱溶液中
9.所有原子处于同一平面的是( )
A. B. C. D.CH2=CH-CCH
10.下列叙述正确的是
A.高分子材料不能以石油。煤等化石燃料为原料进行生产
B.空间填充模型既可以表示甲烷分子,也可以表示四氯化碳分子
C.高分子材料中的有机物分子均呈链状结构
D.橡胶硫化的过程中发生了化学反应
11.下列指定反应的化学方程式或离子方程式书写正确的是
A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑
B.苯与浓硝酸共热到50-60℃制取硝基苯:+HNO3H2O+
C.用食醋除去暖水瓶里的水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.将乙酸乙酯、H2O和稀硫酸充分混合并加热:CH3COOCH2CH3+H218OCH3CO18OH+CH3CH2OH
12.某实验兴趣小组同学查阅资料如下,溴苯不溶于水,易溶于有机溶剂,沸点156.2 °C,苯的沸点80°C,然后在实验室用苯、液溴、活性铁粉作用制得粗溴苯(含溴苯、溴和苯),为得到纯度符合要求的产品,需要对粗溴苯进行纯化,下列装置并不需要用到的是
A. B.
C. D.
13.下列物质属于有机合成材料的是
A.陶瓷 B.铝合金 C.尼龙 D.塑料
14.环之间共用一个碳原子的化合物称为螺环化合物,螺庚烷()是其中一种。下列关于该化合物的说法正确的是( )
A.与甲基环己烷()互为同分异构体
B.分子中含有1个六元环的同分异构体4种(不含立体异构)
C.所有碳原子均处同一平面
D.二氯代物超过3种
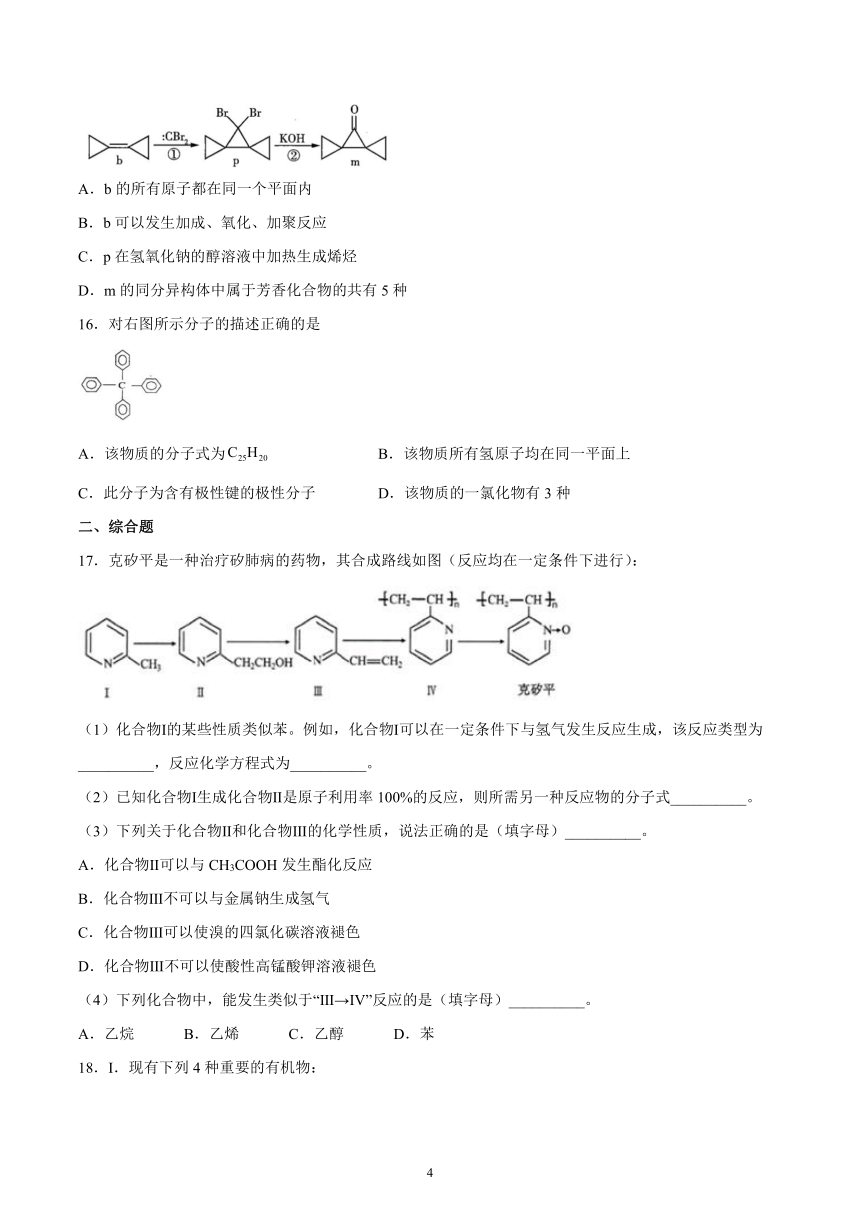
15.环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
16.对右图所示分子的描述正确的是
A.该物质的分子式为 B.该物质所有氢原子均在同一平面上
C.此分子为含有极性键的极性分子 D.该物质的一氯化物有3种
二、综合题
17.克矽平是一种治疗矽肺病的药物,其合成路线如图(反应均在一定条件下进行):
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以在一定条件下与氢气发生反应生成,该反应类型为__________,反应化学方程式为__________。
(2)已知化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,则所需另一种反应物的分子式__________。
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是(填字母)__________。
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅲ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)下列化合物中,能发生类似于“Ⅲ→Ⅳ”反应的是(填字母)__________。
A.乙烷 B.乙烯 C.乙醇 D.苯
18.Ⅰ.现有下列4种重要的有机物:
①②③④
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH )=______mol·L-1。
19.(1)下列各组物质属于同素异形体________;属于同位素是________;属于同一种物质是________;属于同系物是________。(写序号)
①红磷与白磷;②12C与14C;③S2与S8;④235U与238U;⑤干冰与二氧化碳;⑥CH4与CH3CH3;⑦ 与 ;⑧CH3CH=CH2和CH2=CH2。
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,请写出工业上用A制备酒精的化学方程式________。
(3)在一定体积的 18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积________ (填“大于”“小于”或“等于”)100 mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 KNO3溶液),则该反应的离子方程式_________。
20.Ⅰ.现有下列4种重要的有机物:
①②③④
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH )=______mol·L-1。
21.当前,从全球范围来看,人类所面临的挑战有健康问题、能源问题、粮食问题、环境问题等。化学家们希望从化学角度,通过化学方法解决这些问题,为人类的发展与进步作出更大的贡献。化学家们所研究的课题很多,其中包括:
①消除汽车尾气中的有害物质
②开发新型制冷剂取代氟利昂
③在无污染的条件下进行化学反应
④研制开发超导材料
⑤合成人造皮肤和血管
⑥开发新型、高效药品
⑦寻找高效催化剂在低能耗下分解水得到氢气和氧气
⑧合成高效化肥
⑨研制植物营养液进行无土栽培
(1)属于健康问题的有_______________(填序号,下同)。
(2)属于能源问题的有_______________。
(3)属于粮食问题的有_______________。
(4)属于环境问题的有_______________。
22.材料是人类赖以生存和发展的重要物质基础。图1是铁轨上高速运行的列车,图2是列车车厢内部场景。
部分材料类别如下:A.合金 B.玻璃 C.橡胶 D.塑料 E.合成纤维。用以上一种材料类别的字母标号填空:
(1)钢轨属于_______。
(2)车头上雨刮器的软性材料属于_______。
(3)透明车窗使用的主要材料是_______。
(4)座椅下方的电源插座面板属于_______。
(5)座椅上套的维纶面料属于_______。
23.乙烯在化工生产领域应用广泛。
(1)乙烯能合成很多有实用价值的有机物。
①试剂a是_____。
②反应Ⅰ的反应类型是_____。
(2)以原油为起始原料合成聚乙烯的路线如图所示。
①反应Ⅲ的化学方程式是_____。
②写出分子式符合C4H10的有机物的结构简式_____。
24.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题:
(1)乙烯的结构简式为___________。
(2)鉴别甲烷和乙烯的试剂是___________(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不可以通过乙烯发生加成反应得到的是___________(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)写出乙烯生成聚乙烯的化学反应方程式:___________。
试卷第1页,共3页
2
参考答案:
1.D
【详解】
A.可燃冰指天然气水合物,主要成分是甲烷,其燃烧无助于减少碳排放,A错误;
B.正常疫苗的储存温度为2-8度,超过这个温度后,会导致疫苗的变性,B错误;
C.碳纤维是一种碳单质,不是有机高分子材料,C错误;
D.芯片制造中的光刻技术是利用光敏树脂在曝光条件下发生分子间聚合而成像,该过程是化学变化,D正确;
故选D。
2.C
【详解】
水晶成分为二氧化硅,二氧化硅为氧化物,不属于硅酸盐,故A错误;
B.医用酒精和葡萄糖注射液都是溶液,都不产生丁达尔效应,故B错误;
C.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸具有氧化性、漂白性,臭氧具有氧化性,二者能使细菌、病毒等蛋白质变性可用于自来水消毒,故C正确;
D.将氨气制成氮肥属于不同氮的化合物之间转化,不属于氮的固定,故D错误;
故选:C。
3.B
【详解】
CH2=CH2与H2SO4(H—O—SO3H)反应生成C2H5O—SO3H,反应①是加成反应;C2H5O—SO3H与H2O(H—OH)反应生成H2SO4与C2H5OH,反应②是取代反应;丙烯(C3H6)经反应③④生成C3H5Br2Cl,增加了一个氯原子,两个溴原子,可推出反应③是取代反应,反应④是加成反应;因此反应①与反应④反应类型相同,为加成反应,故B正确。
综上所述,答案为B。
4.D
【详解】
A.苯是无色有特殊气味的液体,A正确;
B.苯是无色有特殊气味的液体,苯密度比水小,不溶于水,B正确;
C.苯与浓硝酸在浓硫酸、加热条件下,能与硝酸发生硝化反应,该反应也属于取代反应,C正确;
D.苯中碳碳键是介于单键和双键之间的独特的键,故苯能发生取代反应和加成反应,如苯可与在一定条件下,发生加成反应生成环己烷,D错误;
故选D。
5.B
【详解】
A.根据X的结构简式可知其分子式为C8H12O3,故A错误;
B.该物质含有碳碳双键可以发生加成反应,含有羧基、羟基,可以发生酯化反应,酯化反应属于取代反应,故B正确;
C.该物质中存在与同一饱和碳原子相连的3个碳原子,不可能所有碳原子共面,故C错误;
D.分子含有羧基、碳碳双键、羟基三种官能团,故D错误;
故答案为B。
6.D
【详解】
A. 煤的干馏是化学变化,故图示左侧试管中发生了化学变化,选项A正确;
B.煤的干馏产物煤焦油中一部分物质的密度比水大,而粗苯的密度比水小,试管中液体分为三层,因为出炉煤气中有氨气,所以水溶液呈碱性,选项B正确;
C.煤的干馏产物中含有、等气体,所以Z易燃,能还原氧化铜,选项C正确;
D.由于产物没有彻底分离,故X、Y、Z都是混合物,选项D错误。
答案选D。
7.B
【详解】
A. 合成纤维属于有机高分子化合物,不属于新型无机非金属材料,光导纤维主要成分是二氧化硅,属于新型无机非金属材料,故A错误;
B. 有机玻璃是通过聚合反应生成的高分子化合物,主要成分属于有机高分子化合物,故B正确;
C. 纯碱、漂白粉都属于盐类,烧碱属于碱,故C错误;
D. 硫酸、氢氧化钠都属于电解质,二氧化硫属于非电解质,故D错误;
故选B。
8.B
【详解】
A.甲烷在点燃的条件下能与氧气反应,甲烷与氧气混合并置于光照下不反应,故A不符合题意;
B.在密闭容器中使甲烷受热至1000℃以上能分解生成碳单质和氢气,故B符合题意;
C.甲烷的化学性质稳定,不能与KMnO4酸性溶液发生氧化反应,故C不符合题意;
D.甲烷的化学性质稳定,将甲烷通入热的强碱溶液中不反应,故D不符合题意;
答案选B。
9.D
【详解】
A.四氯化碳是正四面体结构,所有原子不可能处于同一平面,故A错误;
B.根据甲烷是正四面体结构分析,甲基是立体结构,所有原子不可能处于同一平面,故B错误;
C.因甲基是立体结构,所有原子不可能处于同一平面,故C错误;
D.碳碳双键是平面结构,碳碳三键是直线型结构,则该物质中所有原子都在一个平面上,故D正确;
故选D。
10.D
【详解】
A.人造的有机高分子材料,如三大合成材料是以石油、煤等化石燃料为原料进行生产的,故A错误;
B.氢原子比碳原子小,可以表示甲烷分子,但氯原子比碳原子大,则不可以表示四氯化碳分子,故B错误;
C.高分子材料中的有机物分子有呈链状结构结构的,也有呈网状结构的,故C错误;
D.橡胶硫化的过程中,结构发生改变,发生了化学反应,故D正确;
本题答案D。
11.D
【详解】
A.在稀硝酸中,的氧化能力比H+强,所以铁与稀硝酸反应,不能生成H2,A不正确;
B.苯与浓硝酸共热到50-60℃制取的硝基苯,其化学式应为,B不正确;
C.食醋的主要成分为醋酸,醋酸为弱酸,在离子方程式中应以化学式表示,C不正确;
D.乙酸乙酯水解时,应按酯化时的原路返回,即酯化时形成的酯分子中的C-O键,在水解时发生断裂,生成CH3CO18OH和CH3CH2OH,D正确;
故选D。
12.C
【详解】
A.除去Br2可以用SO2,原理是:Br2+SO2+2H2O ==H2SO4+2HBr,A项不选;
B.苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液,B项不选;
C.溴苯易溶于有机溶剂,过滤无法将苯和溴苯分离,不需要该装置,C项选;
D.溴苯的沸点是156. 2°C、苯的沸点是80°C,分离出溴苯用蒸馏,D项不选;
答案选C。
13.CD
【详解】
A.陶瓷为无机非金属材料,A与题意不符;
B.铝合金为金属材料,B与题意不符;
C.尼龙是聚酰胺纤维,属于有机合成材料,C符合题意;
D.塑料为有机合成材料,D符合题意;
答案为CD。
14.BD
【详解】
A. 螺庚烷()分子式为C7H12,甲基环己烷()分子式为C7H14,两者不互为同分异构体,故A错误;
B. 分子中含有1个六元环的同分异构体分别为,,共4种,故B正确;
C. 根据甲烷的结构分析得到中间的碳原子与周围四个碳原子不可能为同一平面,故C错误;
D. 螺庚烷二氯代物在同一个碳原子上,2种,在不同碳原子上、,因此螺庚烷二氯代物超过3种,故D正确。
综上所述,答案为BD。
15.BD
【详解】
A.b含有饱和碳原子,具有甲烷的结构特征,则所有原子不可能都在一个平面内,故A错误;
B.b含碳碳双键,可发生加成、氧化、加聚反应,故B正确;
C.p中与溴原子相连的碳原子邻位碳原子上没有氢原子,p不能发生消去反应,故C错误;
D.m的分子式为C7H8O,m的属于芳香族化合物的同分异构体含苯环、还含1个O、1个C,为苯甲醚、苯甲醇、邻甲基苯酚、间甲基苯酚、对甲基苯酚,共5种,故D正确;
故答案选BD。
16.AD
【详解】
A. 该物质有4个—C6H5和一个碳,因此分子式为,故A正确;
B. 该物质所有氢原子不可能在同一平面上,每个苯的顶点上连的氢原子与最中间的碳形成四面体结构,故B错误;
C. 此分子为含有极性键、非极性键的非极性分子,故C错误;
D. 该物质有对称性,四个苯环等位,苯环也有对称性,有三种位置的氢,如图,因此一氯化物有3种,故D正确。
综上所述,答案为AD。
17. 加成反应 +3H2 CH2O A、B、C B
【详解】
(1)化合物I的结构简式为,由某些性质类似苯可知, 在一定条件下与氢气发生反应生成,反应的化学方程式为+3H2
,故答案为:加成反应;+3H2;
(2)由化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应可知,与甲醛发生加成反应生成,甲醛的分子式为CH2O,故答案为:CH2O;
(3)A.因化合物Ⅱ分子中含有羟基,在浓硫酸作用下,可以和CH3COOH共热发生酯化反应,故正确;
B.化合物Ⅲ不含羟基、羧基等,不可以与金属钠生成氢气,故正确;
C.化合物Ⅲ的分子中含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,使溴的四氯化碳溶液褪色,故正确;
D.化合物Ⅲ的分子中含有碳碳双键,能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故错误;
ABC正确,故答案为:A、B、C;
(4)化合物Ⅲ含有碳碳双键,一定条件下,能发生加聚反应反应生成化合物Ⅳ,乙烯含有碳碳双键,与化合物Ⅲ性质相似,也能发生加聚反应生成聚乙烯,B正确,故答案为:B。
18. ③ ①②③ +NaOH 锌块 Fe3++3H2O Fe(OH)3+3H+ C 10-12
【详解】
I.(1)能与苯酚缩合成高分子化合物的是甲醛,其合成的高分子为酚醛树脂。答案为③。
(2)甲苯分子中,与苯环直接相连的碳原子上有H;苯甲醇分子中,与苯环直接相连的碳原子上有H,且还有羟基;甲醛分子中有醛基。具有以上这些结构特点的有机物,都能使酸性高锰酸钾溶液褪色,因此,能使酸性高锰酸钾溶液褪色的是①②③。
(3)④在强碱的醇溶液中共热可以发生消去反应生成丙烯,该反应的化学方程式为+NaOH。
Ⅱ.(1)海水会腐蚀铁质海轮外壳,为了防止其受海水的腐蚀,通常要在船体上连接较活泼的金属(比铁活泼),制造海轮时会在船底四周镶嵌锌块。
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是利用Fe3+的水解产物氢氧化铁胶体吸附水中的悬浮杂质,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+。
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,应设法让化学平衡向正反应方向移动,且不能消耗HClO。
A.NaOH与产物中的两种酸均可发生中和反应,A不合适;
B.浓HCl可以增大溶液中的氢离子浓度和氯离子浓度,使化学平衡向逆反应方向移动,B不合适;
C.CaCO3固体可以与盐酸反应,但其不与次氯酸反应,可以使化学平衡向正反应方向移动,C合适;
D.加入H2O不能增大次氯酸的浓度,D不合适;
E.SO2消耗氯气和次氯酸,不能增大次氯酸的浓度,E不合适。
综上所述,可以加入CaCO3固体,答案为C。
(4)常温下,0.01mol·L-1NaOH溶液,c(OH )=0.01mol·L-1,由水电离出的c(OH )=c(H+)110-12 mol·L-1。
19. ①③ ②④ ⑤⑦ ⑥⑧ CH2=CH2+H-OHCH3-CH2-OH 大于 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【详解】
(1)同素异形体是同一元素组成的不同性质的单质;同位素是质子数相同而中子数不同的原子;同一物质分子式相同,化学性质相同,物理性质可能不同;同系物是结构相似,在分子组成上形成1个或若干CH2原子团的物质;
①红磷与白磷是磷元素的两种不同性质的单质,二者互为同素异形体;
②12C与14C是C元素的两种不同的原子,二者互为同位素;
③S2与S8是硫元素的不同性质的单质,二者互为同素异形体;
④235U与238U的质子数相同,中子数不同,二者互为同位素;
⑤干冰是固体CO2,因此干冰与二氧化碳是同一物质;
⑥CH4与CH3CH3都属于烷烃,结构相似,在分子组成上形成1个CH2原子团,互为同系物;
⑦给出的物质结构可看作是甲烷分子中2个H原子被Cl原子取代产生的物质,由于甲烷是正四面体结构,分子中任何两个化学键都相邻,所以 与 表示的是同一物质;
⑧CH3CH=CH2和CH2=CH2都属于烯烃,结构相似,在分子组成上形成1个CH2原子团,二者互为同系物;
综上所述可知:属于同素异形体的是①③;属于同位素的是②④;属于同一种物质的是⑤⑦;属于同系物的是⑥⑧;
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯,结构简式是CH2=CH2,乙烯分子中含有不饱和的碳碳双键,与水在一定条件下发生加成反应制取乙醇(俗称酒精),该反应的化学方程式为:CH2=CH2+H-OHCH3-CH2-OH;
(3)Cu与浓硫酸在加热时反应产生CuSO4、SO2、H2O,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。在该反应中,每有2 mol H2SO4发生反应,其中就有1 mol被还原产生SO2,若被还原的硫酸为0.9 mol,则反应消耗硫酸的物质的量为n(H2SO4)=2×0.9 mol=1.8 mol,已知浓硫酸物质的量浓度为18 mol/L,则理论上需要浓硫酸体积V==0.1 L=100 mL,但由于只有浓硫酸在加热时能够与Cu反应,随着反应的进行,硫酸溶液浓度变稀,反应就不再发生,因此实际消耗浓硫酸的体积大于100 mL。在反应后的溶液中含有未反应的H2SO4,使溶液显酸性,在酸性条件下Cu、H+、NO3-会发生氧化还原反应,产生Cu2+、NO、H2O,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
20. ③ ①②③ +NaOH 锌块 Fe3++3H2O Fe(OH)3+3H+ C 10-12
【详解】
I.(1)能与苯酚缩合成高分子化合物的是甲醛,其合成的高分子为酚醛树脂。答案为③。
(2)甲苯分子中,与苯环直接相连的碳原子上有H;苯甲醇分子中,与苯环直接相连的碳原子上有H,且还有羟基;甲醛分子中有醛基。具有以上这些结构特点的有机物,都能使酸性高锰酸钾溶液褪色,因此,能使酸性高锰酸钾溶液褪色的是①②③。
(3)④在强碱的醇溶液中共热可以发生消去反应生成丙烯,该反应的化学方程式为+NaOH。
Ⅱ.(1)海水会腐蚀铁质海轮外壳,为了防止其受海水的腐蚀,通常要在船体上连接较活泼的金属(比铁活泼),制造海轮时会在船底四周镶嵌锌块。
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是利用Fe3+的水解产物氢氧化铁胶体吸附水中的悬浮杂质,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+。
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,应设法让化学平衡向正反应方向移动,且不能消耗HClO。
A.NaOH与产物中的两种酸均可发生中和反应,A不合适;
B.浓HCl可以增大溶液中的氢离子浓度和氯离子浓度,使化学平衡向逆反应方向移动,B不合适;
C.CaCO3固体可以与盐酸反应,但其不与次氯酸反应,可以使化学平衡向正反应方向移动,C合适;
D.加入H2O不能增大次氯酸的浓度,D不合适;
E.SO2消耗氯气和次氯酸,不能增大次氯酸的浓度,E不合适。
综上所述,可以加入CaCO3固体,答案为C。
(4)常温下,0.01mol·L-1NaOH溶液,c(OH )=0.01mol·L-1,由水电离出的c(OH )=c(H+)110-12 mol·L-1。
21. ⑤⑥ ④⑦ ⑧⑨ ①②③
【详解】
①消除汽车尾气中的有害物质,减少大气污染,属于环境问题;
②开发新型制冷剂取代氟利昂,减少大气污染,属于环境问题;
③在无污染的条件下进行化学反应,有利于保护环境,属于环境问题;
④研制开发超导材料,可节省能源,属于能源问题;
⑤合成人造皮肤和血管,促进人体健康,属于健康问题;
⑥开发新型、高效药品,保护人类健康,属于健康问题;
⑦寻找高效催化剂在低能耗下分解水得到氢气和氧气,属于能源问题;
⑧合成高效化肥,促进农作物生长,属于粮食问题;
⑨研制植物营养液进行无土栽培,促进粮食增产增收,属于粮食问题。
综合以上分析:
(1)属于健康问题的有⑤⑥。
(2)属于能源问题的有④⑦。
(3)属于粮食问题的有⑧⑨。
(4)属于环境问题的有①②③。答案为:⑤⑥;④⑦;⑧⑨;①②③。
22.(1)A
(2)C
(3)B
(4)D
(5)E
【分析】
(1)
钢轨属于金属材料,属于合金,答案选A。
(2)
车头上雨刮器的软性材料属于橡胶材料,答案选C。
(3)
透明车窗使用的主要材料是玻璃制成的,答案选B。
(4)
座椅下方的电源插座面板属于塑料制品,答案选D。
(5)
座椅上套的维纶面料属于合成纤维,答案选E。
23. HCl 加成反应 nCH2═CH2 CH3CH2CH2CH3、CH3CH(CH3)CH3
【详解】
(1)由物质结构可知,乙烯与HCl发生加成反应生成氯乙烷,乙烯生成环丁烷应该发生加成反应,故①试剂a为HCl,②反应I为加成反应,
答案为:HCl;加成反应;
(2)①丁烷裂解生成乙烯,乙烯发生加聚反应得到聚乙烯,反应Ⅲ的方程式为:
nCH2═CH2 ,
答案为:nCH2═CH2 ;
②分子式为C4H10的烷烃有正丁烷、异丁烷,结构简式为:CH3CH2CH2CH3、CH3CH(CH3)CH3。
答案为:CH3CH2CH2CH3、CH3CH(CH3)CH3。
24. CH2=CH2 BD B nCH2=CH2
【详解】
(1)乙烯分子式为C2H4,该分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,其电子式为,结构简式为CH2=CH2;
(2)甲烷与乙烯均不与硫酸反应,均不溶于水,但乙烯含有碳碳双键,可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色;也被酸性高锰酸钾发生氧化而使高锰酸钾溶液褪色;甲烷性质稳定,与溴的四氯化碳溶液和酸性高锰酸钾溶液都不反应,可以用溴的四氯化碳溶液水、酸性高锰酸钾溶液鉴别甲烷与乙烯;答案为:BD;
(3)乙烯与氢气加成生成乙烷,即CH2=CH2+H2CH3CH3,乙烯与水加成生成乙醇,即CH2=CH2+H2OCH3CH2OH,乙烯与溴化氢发生加成生成溴乙烷,即CH2=CH2+HBrCH3CH2Br,但是无法通过加成反应获得CH3CHCl2;答案为:ACD;
(4)乙烯通过加聚反应生成聚乙烯,故其反应的化学方程式为nCH2=CH2。
答案第1页,共2页
一、选择题(共16题)
1.下列说法正确的是
A.积极开发使用可燃冰有助于减少碳排放
B.陈薇院士团队开发的腺病毒载体疫苗(Ad5—CoV疫苗)性质较稳定,该疫苗在常温下保存即可
C.“天和空间站”使用的碳纤维是一种新型有机高分子材料
D.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下发生分子间聚合而成像,该过程是化学变化
2.化学与生产、生活密切相关。下列说法正确的是
A.水泥、水玻璃、水晶均属于硅酸盐产品
B.医用酒精和葡萄糖注射液可用丁达尔效应区分
C.臭氧、二氧化氯均可代替氯水用于自来水消毒
D.工业合成氨、将氨气制成氮肥均属于氮的固定
3.如图是以石油为原料的部分转化流程图,下列说法正确的是( )
A.反应①与反应③反应类型相同 B.反应①与反应④反应类型相同
C.反应③与反应④反应类型相同 D.反应②与反应④反应类型相同
4.下列关于苯的性质的叙述中,不正确的是
A.苯是无色、带有特殊气味的液体
B.常温下苯是一种不溶于水且密度小于水的液体
C.苯在一定条件下能与硝酸发生取代反应
D.苯不具有典型的双键,故不可能发生加成反应
5.某有机物X的结构简式为,下列有关该有机物的说法正确的是
A.分子式为C8H10O3
B.既可以发生加成反应又可以发生取代反应
C.分子中所有碳原子共面
D.含有两种官能团
6.如图是实验室模拟煤的干馏的实验装置:
下列有关叙述错误的是( )
A.图示左侧试管中发生了化学变化
B.实验后右侧试管中水溶液呈碱性,Y是黑色黏稠的煤焦油,上层X是粗苯等
C.气体Z易燃,可以还原氧化铜
D.Y是一种纯净物
7.下列说法正确的是
A.合成纤维和光导纤维都属于新型无机非金属材料
B.有机玻璃的主要成分属于有机高分子化合物
C.纯碱、烧碱、漂白粉都属于盐类
D.二氧化硫、硫酸、氢氧化钠都属于电解质
8.在下述条件下,能发生化学反应的是
A.甲烷与氧气混合并置于光照下
B.在密闭容器中使甲烷受热至1000℃以上
C.将甲烷通入KMnO4酸性溶液中
D.将甲烷通入热的强碱溶液中
9.所有原子处于同一平面的是( )
A. B. C. D.CH2=CH-CCH
10.下列叙述正确的是
A.高分子材料不能以石油。煤等化石燃料为原料进行生产
B.空间填充模型既可以表示甲烷分子,也可以表示四氯化碳分子
C.高分子材料中的有机物分子均呈链状结构
D.橡胶硫化的过程中发生了化学反应
11.下列指定反应的化学方程式或离子方程式书写正确的是
A.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑
B.苯与浓硝酸共热到50-60℃制取硝基苯:+HNO3H2O+
C.用食醋除去暖水瓶里的水垢:CaCO3+2H+=Ca2++H2O+CO2↑
D.将乙酸乙酯、H2O和稀硫酸充分混合并加热:CH3COOCH2CH3+H218OCH3CO18OH+CH3CH2OH
12.某实验兴趣小组同学查阅资料如下,溴苯不溶于水,易溶于有机溶剂,沸点156.2 °C,苯的沸点80°C,然后在实验室用苯、液溴、活性铁粉作用制得粗溴苯(含溴苯、溴和苯),为得到纯度符合要求的产品,需要对粗溴苯进行纯化,下列装置并不需要用到的是
A. B.
C. D.
13.下列物质属于有机合成材料的是
A.陶瓷 B.铝合金 C.尼龙 D.塑料
14.环之间共用一个碳原子的化合物称为螺环化合物,螺庚烷()是其中一种。下列关于该化合物的说法正确的是( )
A.与甲基环己烷()互为同分异构体
B.分子中含有1个六元环的同分异构体4种(不含立体异构)
C.所有碳原子均处同一平面
D.二氯代物超过3种
15.环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
16.对右图所示分子的描述正确的是
A.该物质的分子式为 B.该物质所有氢原子均在同一平面上
C.此分子为含有极性键的极性分子 D.该物质的一氯化物有3种
二、综合题
17.克矽平是一种治疗矽肺病的药物,其合成路线如图(反应均在一定条件下进行):
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以在一定条件下与氢气发生反应生成,该反应类型为__________,反应化学方程式为__________。
(2)已知化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应,则所需另一种反应物的分子式__________。
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是(填字母)__________。
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅲ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)下列化合物中,能发生类似于“Ⅲ→Ⅳ”反应的是(填字母)__________。
A.乙烷 B.乙烯 C.乙醇 D.苯
18.Ⅰ.现有下列4种重要的有机物:
①②③④
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH )=______mol·L-1。
19.(1)下列各组物质属于同素异形体________;属于同位素是________;属于同一种物质是________;属于同系物是________。(写序号)
①红磷与白磷;②12C与14C;③S2与S8;④235U与238U;⑤干冰与二氧化碳;⑥CH4与CH3CH3;⑦ 与 ;⑧CH3CH=CH2和CH2=CH2。
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,请写出工业上用A制备酒精的化学方程式________。
(3)在一定体积的 18 mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为 0.9 mol。则浓硫酸的实际体积________ (填“大于”“小于”或“等于”)100 mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如 KNO3溶液),则该反应的离子方程式_________。
20.Ⅰ.现有下列4种重要的有机物:
①②③④
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH )=______mol·L-1。
21.当前,从全球范围来看,人类所面临的挑战有健康问题、能源问题、粮食问题、环境问题等。化学家们希望从化学角度,通过化学方法解决这些问题,为人类的发展与进步作出更大的贡献。化学家们所研究的课题很多,其中包括:
①消除汽车尾气中的有害物质
②开发新型制冷剂取代氟利昂
③在无污染的条件下进行化学反应
④研制开发超导材料
⑤合成人造皮肤和血管
⑥开发新型、高效药品
⑦寻找高效催化剂在低能耗下分解水得到氢气和氧气
⑧合成高效化肥
⑨研制植物营养液进行无土栽培
(1)属于健康问题的有_______________(填序号,下同)。
(2)属于能源问题的有_______________。
(3)属于粮食问题的有_______________。
(4)属于环境问题的有_______________。
22.材料是人类赖以生存和发展的重要物质基础。图1是铁轨上高速运行的列车,图2是列车车厢内部场景。
部分材料类别如下:A.合金 B.玻璃 C.橡胶 D.塑料 E.合成纤维。用以上一种材料类别的字母标号填空:
(1)钢轨属于_______。
(2)车头上雨刮器的软性材料属于_______。
(3)透明车窗使用的主要材料是_______。
(4)座椅下方的电源插座面板属于_______。
(5)座椅上套的维纶面料属于_______。
23.乙烯在化工生产领域应用广泛。
(1)乙烯能合成很多有实用价值的有机物。
①试剂a是_____。
②反应Ⅰ的反应类型是_____。
(2)以原油为起始原料合成聚乙烯的路线如图所示。
①反应Ⅲ的化学方程式是_____。
②写出分子式符合C4H10的有机物的结构简式_____。
24.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题:
(1)乙烯的结构简式为___________。
(2)鉴别甲烷和乙烯的试剂是___________(填字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不可以通过乙烯发生加成反应得到的是___________(填字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)写出乙烯生成聚乙烯的化学反应方程式:___________。
试卷第1页,共3页
2
参考答案:
1.D
【详解】
A.可燃冰指天然气水合物,主要成分是甲烷,其燃烧无助于减少碳排放,A错误;
B.正常疫苗的储存温度为2-8度,超过这个温度后,会导致疫苗的变性,B错误;
C.碳纤维是一种碳单质,不是有机高分子材料,C错误;
D.芯片制造中的光刻技术是利用光敏树脂在曝光条件下发生分子间聚合而成像,该过程是化学变化,D正确;
故选D。
2.C
【详解】
水晶成分为二氧化硅,二氧化硅为氧化物,不属于硅酸盐,故A错误;
B.医用酒精和葡萄糖注射液都是溶液,都不产生丁达尔效应,故B错误;
C.氯水中氯气和水反应生成盐酸和次氯酸,次氯酸具有氧化性、漂白性,臭氧具有氧化性,二者能使细菌、病毒等蛋白质变性可用于自来水消毒,故C正确;
D.将氨气制成氮肥属于不同氮的化合物之间转化,不属于氮的固定,故D错误;
故选:C。
3.B
【详解】
CH2=CH2与H2SO4(H—O—SO3H)反应生成C2H5O—SO3H,反应①是加成反应;C2H5O—SO3H与H2O(H—OH)反应生成H2SO4与C2H5OH,反应②是取代反应;丙烯(C3H6)经反应③④生成C3H5Br2Cl,增加了一个氯原子,两个溴原子,可推出反应③是取代反应,反应④是加成反应;因此反应①与反应④反应类型相同,为加成反应,故B正确。
综上所述,答案为B。
4.D
【详解】
A.苯是无色有特殊气味的液体,A正确;
B.苯是无色有特殊气味的液体,苯密度比水小,不溶于水,B正确;
C.苯与浓硝酸在浓硫酸、加热条件下,能与硝酸发生硝化反应,该反应也属于取代反应,C正确;
D.苯中碳碳键是介于单键和双键之间的独特的键,故苯能发生取代反应和加成反应,如苯可与在一定条件下,发生加成反应生成环己烷,D错误;
故选D。
5.B
【详解】
A.根据X的结构简式可知其分子式为C8H12O3,故A错误;
B.该物质含有碳碳双键可以发生加成反应,含有羧基、羟基,可以发生酯化反应,酯化反应属于取代反应,故B正确;
C.该物质中存在与同一饱和碳原子相连的3个碳原子,不可能所有碳原子共面,故C错误;
D.分子含有羧基、碳碳双键、羟基三种官能团,故D错误;
故答案为B。
6.D
【详解】
A. 煤的干馏是化学变化,故图示左侧试管中发生了化学变化,选项A正确;
B.煤的干馏产物煤焦油中一部分物质的密度比水大,而粗苯的密度比水小,试管中液体分为三层,因为出炉煤气中有氨气,所以水溶液呈碱性,选项B正确;
C.煤的干馏产物中含有、等气体,所以Z易燃,能还原氧化铜,选项C正确;
D.由于产物没有彻底分离,故X、Y、Z都是混合物,选项D错误。
答案选D。
7.B
【详解】
A. 合成纤维属于有机高分子化合物,不属于新型无机非金属材料,光导纤维主要成分是二氧化硅,属于新型无机非金属材料,故A错误;
B. 有机玻璃是通过聚合反应生成的高分子化合物,主要成分属于有机高分子化合物,故B正确;
C. 纯碱、漂白粉都属于盐类,烧碱属于碱,故C错误;
D. 硫酸、氢氧化钠都属于电解质,二氧化硫属于非电解质,故D错误;
故选B。
8.B
【详解】
A.甲烷在点燃的条件下能与氧气反应,甲烷与氧气混合并置于光照下不反应,故A不符合题意;
B.在密闭容器中使甲烷受热至1000℃以上能分解生成碳单质和氢气,故B符合题意;
C.甲烷的化学性质稳定,不能与KMnO4酸性溶液发生氧化反应,故C不符合题意;
D.甲烷的化学性质稳定,将甲烷通入热的强碱溶液中不反应,故D不符合题意;
答案选B。
9.D
【详解】
A.四氯化碳是正四面体结构,所有原子不可能处于同一平面,故A错误;
B.根据甲烷是正四面体结构分析,甲基是立体结构,所有原子不可能处于同一平面,故B错误;
C.因甲基是立体结构,所有原子不可能处于同一平面,故C错误;
D.碳碳双键是平面结构,碳碳三键是直线型结构,则该物质中所有原子都在一个平面上,故D正确;
故选D。
10.D
【详解】
A.人造的有机高分子材料,如三大合成材料是以石油、煤等化石燃料为原料进行生产的,故A错误;
B.氢原子比碳原子小,可以表示甲烷分子,但氯原子比碳原子大,则不可以表示四氯化碳分子,故B错误;
C.高分子材料中的有机物分子有呈链状结构结构的,也有呈网状结构的,故C错误;
D.橡胶硫化的过程中,结构发生改变,发生了化学反应,故D正确;
本题答案D。
11.D
【详解】
A.在稀硝酸中,的氧化能力比H+强,所以铁与稀硝酸反应,不能生成H2,A不正确;
B.苯与浓硝酸共热到50-60℃制取的硝基苯,其化学式应为,B不正确;
C.食醋的主要成分为醋酸,醋酸为弱酸,在离子方程式中应以化学式表示,C不正确;
D.乙酸乙酯水解时,应按酯化时的原路返回,即酯化时形成的酯分子中的C-O键,在水解时发生断裂,生成CH3CO18OH和CH3CH2OH,D正确;
故选D。
12.C
【详解】
A.除去Br2可以用SO2,原理是:Br2+SO2+2H2O ==H2SO4+2HBr,A项不选;
B.苯和溴苯的混合液与无机溶液互不相溶,分液可得苯和溴苯的混合液,B项不选;
C.溴苯易溶于有机溶剂,过滤无法将苯和溴苯分离,不需要该装置,C项选;
D.溴苯的沸点是156. 2°C、苯的沸点是80°C,分离出溴苯用蒸馏,D项不选;
答案选C。
13.CD
【详解】
A.陶瓷为无机非金属材料,A与题意不符;
B.铝合金为金属材料,B与题意不符;
C.尼龙是聚酰胺纤维,属于有机合成材料,C符合题意;
D.塑料为有机合成材料,D符合题意;
答案为CD。
14.BD
【详解】
A. 螺庚烷()分子式为C7H12,甲基环己烷()分子式为C7H14,两者不互为同分异构体,故A错误;
B. 分子中含有1个六元环的同分异构体分别为,,共4种,故B正确;
C. 根据甲烷的结构分析得到中间的碳原子与周围四个碳原子不可能为同一平面,故C错误;
D. 螺庚烷二氯代物在同一个碳原子上,2种,在不同碳原子上、,因此螺庚烷二氯代物超过3种,故D正确。
综上所述,答案为BD。
15.BD
【详解】
A.b含有饱和碳原子,具有甲烷的结构特征,则所有原子不可能都在一个平面内,故A错误;
B.b含碳碳双键,可发生加成、氧化、加聚反应,故B正确;
C.p中与溴原子相连的碳原子邻位碳原子上没有氢原子,p不能发生消去反应,故C错误;
D.m的分子式为C7H8O,m的属于芳香族化合物的同分异构体含苯环、还含1个O、1个C,为苯甲醚、苯甲醇、邻甲基苯酚、间甲基苯酚、对甲基苯酚,共5种,故D正确;
故答案选BD。
16.AD
【详解】
A. 该物质有4个—C6H5和一个碳,因此分子式为,故A正确;
B. 该物质所有氢原子不可能在同一平面上,每个苯的顶点上连的氢原子与最中间的碳形成四面体结构,故B错误;
C. 此分子为含有极性键、非极性键的非极性分子,故C错误;
D. 该物质有对称性,四个苯环等位,苯环也有对称性,有三种位置的氢,如图,因此一氯化物有3种,故D正确。
综上所述,答案为AD。
17. 加成反应 +3H2 CH2O A、B、C B
【详解】
(1)化合物I的结构简式为,由某些性质类似苯可知, 在一定条件下与氢气发生反应生成,反应的化学方程式为+3H2
,故答案为:加成反应;+3H2;
(2)由化合物Ⅰ生成化合物Ⅱ是原子利用率100%的反应可知,与甲醛发生加成反应生成,甲醛的分子式为CH2O,故答案为:CH2O;
(3)A.因化合物Ⅱ分子中含有羟基,在浓硫酸作用下,可以和CH3COOH共热发生酯化反应,故正确;
B.化合物Ⅲ不含羟基、羧基等,不可以与金属钠生成氢气,故正确;
C.化合物Ⅲ的分子中含有碳碳双键,能与溴的四氯化碳溶液发生加成反应,使溴的四氯化碳溶液褪色,故正确;
D.化合物Ⅲ的分子中含有碳碳双键,能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故错误;
ABC正确,故答案为:A、B、C;
(4)化合物Ⅲ含有碳碳双键,一定条件下,能发生加聚反应反应生成化合物Ⅳ,乙烯含有碳碳双键,与化合物Ⅲ性质相似,也能发生加聚反应生成聚乙烯,B正确,故答案为:B。
18. ③ ①②③ +NaOH 锌块 Fe3++3H2O Fe(OH)3+3H+ C 10-12
【详解】
I.(1)能与苯酚缩合成高分子化合物的是甲醛,其合成的高分子为酚醛树脂。答案为③。
(2)甲苯分子中,与苯环直接相连的碳原子上有H;苯甲醇分子中,与苯环直接相连的碳原子上有H,且还有羟基;甲醛分子中有醛基。具有以上这些结构特点的有机物,都能使酸性高锰酸钾溶液褪色,因此,能使酸性高锰酸钾溶液褪色的是①②③。
(3)④在强碱的醇溶液中共热可以发生消去反应生成丙烯,该反应的化学方程式为+NaOH。
Ⅱ.(1)海水会腐蚀铁质海轮外壳,为了防止其受海水的腐蚀,通常要在船体上连接较活泼的金属(比铁活泼),制造海轮时会在船底四周镶嵌锌块。
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是利用Fe3+的水解产物氢氧化铁胶体吸附水中的悬浮杂质,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+。
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,应设法让化学平衡向正反应方向移动,且不能消耗HClO。
A.NaOH与产物中的两种酸均可发生中和反应,A不合适;
B.浓HCl可以增大溶液中的氢离子浓度和氯离子浓度,使化学平衡向逆反应方向移动,B不合适;
C.CaCO3固体可以与盐酸反应,但其不与次氯酸反应,可以使化学平衡向正反应方向移动,C合适;
D.加入H2O不能增大次氯酸的浓度,D不合适;
E.SO2消耗氯气和次氯酸,不能增大次氯酸的浓度,E不合适。
综上所述,可以加入CaCO3固体,答案为C。
(4)常温下,0.01mol·L-1NaOH溶液,c(OH )=0.01mol·L-1,由水电离出的c(OH )=c(H+)110-12 mol·L-1。
19. ①③ ②④ ⑤⑦ ⑥⑧ CH2=CH2+H-OHCH3-CH2-OH 大于 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【详解】
(1)同素异形体是同一元素组成的不同性质的单质;同位素是质子数相同而中子数不同的原子;同一物质分子式相同,化学性质相同,物理性质可能不同;同系物是结构相似,在分子组成上形成1个或若干CH2原子团的物质;
①红磷与白磷是磷元素的两种不同性质的单质,二者互为同素异形体;
②12C与14C是C元素的两种不同的原子,二者互为同位素;
③S2与S8是硫元素的不同性质的单质,二者互为同素异形体;
④235U与238U的质子数相同,中子数不同,二者互为同位素;
⑤干冰是固体CO2,因此干冰与二氧化碳是同一物质;
⑥CH4与CH3CH3都属于烷烃,结构相似,在分子组成上形成1个CH2原子团,互为同系物;
⑦给出的物质结构可看作是甲烷分子中2个H原子被Cl原子取代产生的物质,由于甲烷是正四面体结构,分子中任何两个化学键都相邻,所以 与 表示的是同一物质;
⑧CH3CH=CH2和CH2=CH2都属于烯烃,结构相似,在分子组成上形成1个CH2原子团,二者互为同系物;
综上所述可知:属于同素异形体的是①③;属于同位素的是②④;属于同一种物质的是⑤⑦;属于同系物的是⑥⑧;
(2)已知A的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯,结构简式是CH2=CH2,乙烯分子中含有不饱和的碳碳双键,与水在一定条件下发生加成反应制取乙醇(俗称酒精),该反应的化学方程式为:CH2=CH2+H-OHCH3-CH2-OH;
(3)Cu与浓硫酸在加热时反应产生CuSO4、SO2、H2O,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。在该反应中,每有2 mol H2SO4发生反应,其中就有1 mol被还原产生SO2,若被还原的硫酸为0.9 mol,则反应消耗硫酸的物质的量为n(H2SO4)=2×0.9 mol=1.8 mol,已知浓硫酸物质的量浓度为18 mol/L,则理论上需要浓硫酸体积V==0.1 L=100 mL,但由于只有浓硫酸在加热时能够与Cu反应,随着反应的进行,硫酸溶液浓度变稀,反应就不再发生,因此实际消耗浓硫酸的体积大于100 mL。在反应后的溶液中含有未反应的H2SO4,使溶液显酸性,在酸性条件下Cu、H+、NO3-会发生氧化还原反应,产生Cu2+、NO、H2O,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
20. ③ ①②③ +NaOH 锌块 Fe3++3H2O Fe(OH)3+3H+ C 10-12
【详解】
I.(1)能与苯酚缩合成高分子化合物的是甲醛,其合成的高分子为酚醛树脂。答案为③。
(2)甲苯分子中,与苯环直接相连的碳原子上有H;苯甲醇分子中,与苯环直接相连的碳原子上有H,且还有羟基;甲醛分子中有醛基。具有以上这些结构特点的有机物,都能使酸性高锰酸钾溶液褪色,因此,能使酸性高锰酸钾溶液褪色的是①②③。
(3)④在强碱的醇溶液中共热可以发生消去反应生成丙烯,该反应的化学方程式为+NaOH。
Ⅱ.(1)海水会腐蚀铁质海轮外壳,为了防止其受海水的腐蚀,通常要在船体上连接较活泼的金属(比铁活泼),制造海轮时会在船底四周镶嵌锌块。
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是利用Fe3+的水解产物氢氧化铁胶体吸附水中的悬浮杂质,Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+。
(3)自来水常用氯气杀菌消毒,Cl2+H2O HCl+HClO,要增大HClO的浓度,应设法让化学平衡向正反应方向移动,且不能消耗HClO。
A.NaOH与产物中的两种酸均可发生中和反应,A不合适;
B.浓HCl可以增大溶液中的氢离子浓度和氯离子浓度,使化学平衡向逆反应方向移动,B不合适;
C.CaCO3固体可以与盐酸反应,但其不与次氯酸反应,可以使化学平衡向正反应方向移动,C合适;
D.加入H2O不能增大次氯酸的浓度,D不合适;
E.SO2消耗氯气和次氯酸,不能增大次氯酸的浓度,E不合适。
综上所述,可以加入CaCO3固体,答案为C。
(4)常温下,0.01mol·L-1NaOH溶液,c(OH )=0.01mol·L-1,由水电离出的c(OH )=c(H+)110-12 mol·L-1。
21. ⑤⑥ ④⑦ ⑧⑨ ①②③
【详解】
①消除汽车尾气中的有害物质,减少大气污染,属于环境问题;
②开发新型制冷剂取代氟利昂,减少大气污染,属于环境问题;
③在无污染的条件下进行化学反应,有利于保护环境,属于环境问题;
④研制开发超导材料,可节省能源,属于能源问题;
⑤合成人造皮肤和血管,促进人体健康,属于健康问题;
⑥开发新型、高效药品,保护人类健康,属于健康问题;
⑦寻找高效催化剂在低能耗下分解水得到氢气和氧气,属于能源问题;
⑧合成高效化肥,促进农作物生长,属于粮食问题;
⑨研制植物营养液进行无土栽培,促进粮食增产增收,属于粮食问题。
综合以上分析:
(1)属于健康问题的有⑤⑥。
(2)属于能源问题的有④⑦。
(3)属于粮食问题的有⑧⑨。
(4)属于环境问题的有①②③。答案为:⑤⑥;④⑦;⑧⑨;①②③。
22.(1)A
(2)C
(3)B
(4)D
(5)E
【分析】
(1)
钢轨属于金属材料,属于合金,答案选A。
(2)
车头上雨刮器的软性材料属于橡胶材料,答案选C。
(3)
透明车窗使用的主要材料是玻璃制成的,答案选B。
(4)
座椅下方的电源插座面板属于塑料制品,答案选D。
(5)
座椅上套的维纶面料属于合成纤维,答案选E。
23. HCl 加成反应 nCH2═CH2 CH3CH2CH2CH3、CH3CH(CH3)CH3
【详解】
(1)由物质结构可知,乙烯与HCl发生加成反应生成氯乙烷,乙烯生成环丁烷应该发生加成反应,故①试剂a为HCl,②反应I为加成反应,
答案为:HCl;加成反应;
(2)①丁烷裂解生成乙烯,乙烯发生加聚反应得到聚乙烯,反应Ⅲ的方程式为:
nCH2═CH2 ,
答案为:nCH2═CH2 ;
②分子式为C4H10的烷烃有正丁烷、异丁烷,结构简式为:CH3CH2CH2CH3、CH3CH(CH3)CH3。
答案为:CH3CH2CH2CH3、CH3CH(CH3)CH3。
24. CH2=CH2 BD B nCH2=CH2
【详解】
(1)乙烯分子式为C2H4,该分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,其电子式为,结构简式为CH2=CH2;
(2)甲烷与乙烯均不与硫酸反应,均不溶于水,但乙烯含有碳碳双键,可与溴的四氯化碳溶液发生加成反应而使溴的四氯化碳溶液褪色;也被酸性高锰酸钾发生氧化而使高锰酸钾溶液褪色;甲烷性质稳定,与溴的四氯化碳溶液和酸性高锰酸钾溶液都不反应,可以用溴的四氯化碳溶液水、酸性高锰酸钾溶液鉴别甲烷与乙烯;答案为:BD;
(3)乙烯与氢气加成生成乙烷,即CH2=CH2+H2CH3CH3,乙烯与水加成生成乙醇,即CH2=CH2+H2OCH3CH2OH,乙烯与溴化氢发生加成生成溴乙烷,即CH2=CH2+HBrCH3CH2Br,但是无法通过加成反应获得CH3CHCl2;答案为:ACD;
(4)乙烯通过加聚反应生成聚乙烯,故其反应的化学方程式为nCH2=CH2。
答案第1页,共2页
