2.1化学键与物质构成——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析)
文档属性
| 名称 | 2.1化学键与物质构成——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 593.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 09:49:45 | ||
图片预览



文档简介
2.1化学键与物质构成
一、选择题(共16题)
1.下列表示物质结构的化学用语正确的是
A.H、D、T表示同一种核素
B.的形成过程:
C.的结构示意图:
D.的电子式
2.2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2CO+NaClO。下列有关化学用语表示错误的是( )
A.中子数为12的钠原子:Na B.Cl-的结构示意图:
C.CO2的结构式:O=C=O D.NaClO的电子式:
3.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物--定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
4.下列叙述中,不正确的是
A.HCl溶于水时要破坏离子键
B.CCl4和NH3都是只含有极性键的共价化合物
C.Na2O2是含有非极性键的离子化合物
D.CaO和NaCl晶体熔化时要破坏离子键
5.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
6.W、X、Y、Z四种元素在周期表中的位置如图所示,W为短周期元素,其核电荷数是周期序数的5倍。下列说法错误的是
W X Y
Z
A.简单离子半径: W>X> Y
B.W与Y至少能形成两种共价化合物
C.W与X的单质均存在同素异形体
D.X与Z原子序数相差8
7.下列分子中所有原子都满足最外层为8电子稳定结构的是
A.AlCl3 B.H2O C.SiCl4 D.PCl5
8.下列说法正确的是
A.HClO的结构式为H-Cl-O
B.还原性: >HCl,则非金属性:S>Cl
C.可用于除去废水中的和
D.氢氧化亚铁溶于过量稀硝酸时发生反应
9.下列说法正确的是
A.比稳定,是由于分子间存在氢键 B.物质中化学键被破坏,一定发生化学变化
C.晶体和中的化学键类型相同 D.熔化时破坏离子键和共价键
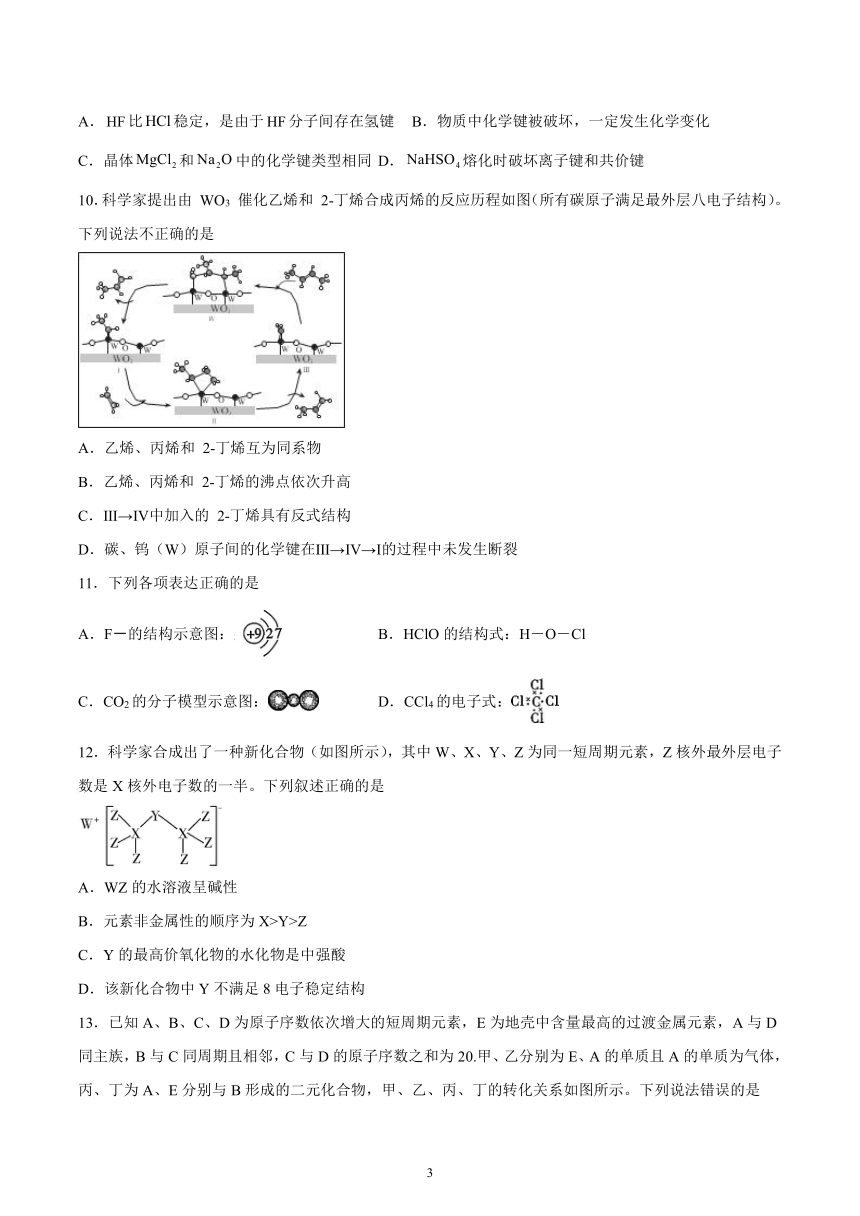
10.科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
11.下列各项表达正确的是
A.F-的结构示意图: B.HClO的结构式:H-O-Cl
C.CO2的分子模型示意图: D.CCl4的电子式:
12.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
13.已知A、B、C、D为原子序数依次增大的短周期元素,E为地壳中含量最高的过渡金属元素,A与D同主族,B与C同周期且相邻,C与D的原子序数之和为20.甲、乙分别为E、A的单质且A的单质为气体,丙、丁为A、E分别与B形成的二元化合物,甲、乙、丙、丁的转化关系如图所示。下列说法错误的是
A.A、B形成的一种化合物具有漂白性
B.常见的C的单质是一种无色无味的气体
C.B、D形成的离子化合物中可能含有非极性键
D.丁为黑色固体,且1mol甲与足量丙反应转移的电子数为
14.短周期主族元素W、E、X、Y的原子序数依次增大,它们位于三个不同的周期,E和X同周期。由E、X、Y组成的一种化合物——百菌清(M),是一种广谱保护性杀菌剂,结构式如图所示。下列说法错误的是
A.M属于共价化合物
B.常温下,最简单氢化物在水中的溶解性:
C.Y的最高价氧化物对应的水化物是弱酸
D.W、X、Y只能形成共价化合物
15.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。下列说法错误的是
A.Na3N是由离子键形成的离子化合物
B.Na3N与盐酸反应生成两种盐
C.Na3N与水的反应属于氧化还原反应
D.Na3N中两种粒子的半径:r(Na+)>r(N3-)
16.M元素的一个原子失去两个电子转移到R元素的两个原子中去,形成离子化合物,下列说法不正确的是
A.M与R形成化合物的化学式为MR2
B.M元素的原子半径一定比R元素的半径大
C.M与R形成的离子化合物一定溶于水
D.M与R形成的离子化合物的晶体熔融时能导电
二、综合题
17.金属材料在生活生产中应用极其广泛,回答下列问题。
(1)请写出Na2O2的电子式 _________ , _________ (填“是”或“不是”)碱性氧化物。
(2)工业上,粗盐需精制,为除去Ca2+需要加入的试剂为 _________ 。食盐中含有KIO3,可加入稀硫酸酸化的淀粉碘化钾溶液检测,若变蓝,则说明含有KIO3,写出相应反应的离子方程式 _________ 。等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)消毒效率最高的是 ________ 。“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓HCl)不能混用,原因是 _________ 。
(3)已知硼酸是一元弱酸,存在电离方程式H3BO3+H2O+H +,其与过量NaOH反应得到的盐的化学式为 _________ 。
(4)含重金属离子Cu2+的废水中,可加入Na2S溶液除去,写出Cu2+发生反应的离子方程式 ________ 。某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.87%,则x= ______ 。
18.现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:
请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
19.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨
(1)原子半径最小的元素是___(填元素名称),写出⑥的离子结构示意图___。
(2)③的单质的电子式为__。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___(填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____。
(6)③、④、⑥的原子半径由大到小的顺序为___(用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
a.溶液B的作用是___。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___。
20.按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是__________________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
21.请按要求完成下列填空。
(1)下列给定的物质中:① ②铝条 ③熔融氯化钠 ④乙醇。属于电解质的是_______(填编号)。
(2)写出金属钠投入水中反应的化学方程式_______。
(3)比较沸点:_______(填“>”“<”“=”)。
22.按要求写出:
(1)溴化钾电子式_____________________。
(2)硫化钠电子式_____________________。
(3)二氧化碳的电子式______________。
(4)铵根离子的电子式_____________。
(5)氮气的电子式______________。
(6)甲烷的结构式____________。
23.氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。回答下列问题:
(1)与氮元素不在同一周期的元素是___________(填标号)
a.氢 b.碳 c.氧 d.硅
(2)氨的电子式是___________。
(3)合成氨的化学方程式为(该反应为放热反应)。为了较快得到氨,工业上采用的措施是___________(填标号)。
a.使用催化剂 b.高压 c.低压 d.常温
(4)氨催化氧化生成是工业制硝酸的反应之一,写出该反应的化学方程式___________;、都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过反应转化为无污染的空气成分,则反应的化学方程式是___________。
24.根据所学知识,回答下列问题:
(1)用铂丝蘸取下列物质灼烧,焰色为紫色的是___________(填序号)
a.NaCl b. c.
(2)同温同压下,同体积的和气体中原子的个数比为___________。
(3)将溶于水配制成1L溶液。溶液中的物质的量浓度为___________;
(4)的结构式为___________。
试卷第1页,共3页
8
参考答案:
1.B
【详解】
A.H、D、T是同一种元素的三种核素,A错误;
B.的形成过程:,B正确;
C.氯离子是由氯原子得一个电子形成的,核电荷数仍为17,故氯离子的结构示意图为,C错误;
D.氯化铵为离子化合物,氯离子的最外层电子数必须标出,正确的电子式为,D错误。
故选:B。
2.D
【详解】
A. 钠是11号元素,中子数为12的钠原子,质量数为23:Na ,故A正确;
B. 氯的核电荷为17,最外层得到1个电子形成稳定结构,Cl-的结构示意图:,故B正确;
C. 二氧化碳的碳与氧形成四个共用电子对,CO2的结构式:O=C=O,故C正确;
D. NaClO是离子化合物,NaClO的电子式:,故D错误;
故选D。
3.C
【详解】
A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na2O,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
4.A
【详解】
A.HCl为分子晶体,溶于水破坏共价键,故A错误;
B.CCl4中含有C-Cl极性键,NH3中含有N-H极性键,则CCl4和NH3都是只含有极性键的共价化合物,故B正确;
C.Na2O2含有离子键和O-O非极性键,是含有非极性键的离子化合物,故C正确;
D.CaO和NaCl是离子晶体,存在离子键,晶体熔化时要破坏离子键,故D正确。
故选:A。
5.D
【详解】
A.Y为N,Z为O,Q为Na,则原子半径:Q>Y>Z,A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,B错误;
C.该化合物中存在离子键和共价键,C错误;
D.Q为Na,能与水、甲醇反应生成氢气,D正确。
故选D。
6.D
【详解】
A.简单离子核外电子排布相同,核电荷数越大,离子半径越小:W(P3-)>X(S2-)>Y(Cl-),A正确;
B.W(P)与Y(Cl)能形成的共价化合物至少有PCl3和PCl5两种,B正确;
C.W(P)的同素异形体有白磷和红磷,X(S)的同素异形体有S2、S4、S6和S8等(或者斜方硫、单斜硫和弹性硫等),C正确;
D.16S与34Se原子序数相差18,D错误;
综上所述答案为D。
7.C
【详解】
A.AlCl3分子中Al原子最外层只有6个电子,不满足原子最外层8个电子的稳定结构,A不符合题意;
B.H2O分子中H原子只达到最外层2个电子的稳定结构,B不符合题意;
C.SiCl4分子中每个原子最外层都达到8个电子的稳定结构,C符合题意;
D.P原子最外层有5个电子,与5个Cl原子形成5对共用电子对,使P原子最外层电子数为10个,不满足原子最外层8个电子的稳定结构,D不符合题意;
故合理选项是C。
8.C
【详解】
A.HClO属于共价化合物,氧原子能够形成2个共价单键,结构式为:H-O-Cl,故A错误;
B.元素的非金属性越强,对应气态氢化物的还原性越弱,非金属性:Cl>S,所以还原性:>HCl,故B错误;
C.硫化铜、硫化汞均为难溶性物质,加入,可以沉淀铜离子和汞离子,达到除去废水中和的目的,故C正确;
D.二价铁具有较强的还原性,硝酸具有强氧化性,二者混合后发生反应,硝酸会把二价铁氧化为三价铁,自身被还原为NO等,故D错误;
故选C。
9.C
【详解】
A.比稳定,是由于H-F键的键能大于H-Cl,与氢键无关,故A错误;
B.化学反应的本质是既有旧键的断裂又有新键的形成,故化学键被破坏不一定发生化学反应,故B错误;
C.晶体和中都只有离子键,故化学键相同,故C正确;
D.熔化时只能破坏离子键,不能破坏共价键,故D错误;
故选C。
10.D
【详解】
A. 乙烯、丙烯和 2-丁烯结构相似,组成上相差若干个CH2原子团,都属于烯烃,互为同系物,A正确;
B. 乙烯、丙烯和 2-丁烯都属于烯烃,随着碳原子个数增加,沸点依次升高,故B正确;
C. 2-丁烯具有顺式()和反式()异构,故C正确;
D.由示意图可知,Ⅳ→Ⅰ的过程中,发生了碳、钨(W)原子间的化学键断裂(),故D错误;
故选D。
11.B
【详解】
A.F-的结构示意图为,故A错误;
B.HClO的结构式为H-O-Cl,故B正确;
C.碳原子半径大于氧原子半径,则不能表示CO2的分子模型,故C错误;
D.CCl4的电子式:,故D错误。
综上所述,答案为B。
12.C
【详解】
A项、氯化钠为强酸强碱盐,水溶液呈中性,故A错误;
B项、同周期元素从左到右,非金属性依次增强,则非金属性的强弱顺序为Cl>S>P,故B错误;
C项、P元素的最高价氧化物对应水化物为磷酸,磷酸是三元中强酸,故C正确;
D项、新化合物中P元素化合价为—3价,满足8电子稳定结构,故D错误。
故选C。
13.BD
【详解】
A.H、O两元素组成的H2O2有强氧化性,具有漂白性,故A正确;
B. C的单质F2是一种浅黄绿色的气体,故B错误;
C.B为O,D为Na,O和Na组成的Na2O2中含有离子键和非极性共价键,故C正确;
D.丁为Fe3O4,是黑色固体,由3Fe+4H2O(g)Fe3O4+4H2可知,1molFe与足量H2O反应转移电子NA,故D错误;
故答案为BD。
14.CD
【详解】
A.从结构简式看,M是由四种非金属元素组成的共价化合物,A正确;
B.氨分子与水分子之间能形成氢键、通常氨气极易溶于水,甲烷不溶于水,B正确;
C. Y为Cl、Cl的最高价氧化物对应的水化物是,为强酸,C错误;
D.W为H、X为N、Y为Cl,W、X、Y既能形成共价化合物、又能形成离子化合物,例如是离子化合物,D错误;
答案选CD。
15.CD
【详解】
A. Na3N含有活泼金属Na,属于离子化合物,A正确;
B. Na3N与盐酸反应生成氯化钠和氯化铵,B正确;
C. Na3N与水的反应生成氢氧化钠和氨气,化合价没有改变,不是氧化还原反应,C错误;
D. Na+和N3-核外电子数相同,但Na+质子数比N3-更多,因此r(Na+)答案选CD。
16.BC
【详解】
A.根据上述分析可知M形成的阳离子是M2+,R形成的是阴离子R-,故二者形成的化合物的化学式为MR2,A正确;
B.根据上述分析可知M可能是第IIA元素,也可能是副族元素;R可能是第VIIA的元素,也可能是H原子。M、R可能是同一周期元素,也可能是不同周期的元素,故M元素的原子半径不一定比R元素的半径大,B错误;
C.M与R形成的离子化合物可能溶于水,如CaCl2,也可能不溶于水,入CaF2,因此M与R形成的离子化合物不一定溶于水,C错误;
D.M与R形成的离子化合物的晶体为离子晶体,在熔融时电离产生自由移动的离子,因而能导电,D正确;
故合理选项是BC。
17. 不是 Na2CO3 +5I-+6H+=3I2+3H2O ClO2 产生氯气,有毒 Na[B(OH)4]或NaB(OH)4 Cu2++S2-=CuS↓ 4
【详解】
(1)Na2O2为离子化合物,由Na+和构成,电子式为,与酸反应生成盐和水的同时,还有O2生成,所以不是碱性氧化物。答案为:;不是;
(2)工业上,粗盐需精制,为除去Ca2+需要加入的试剂为Na2CO3。食盐中含有的KIO3,可加入稀硫酸酸化的淀粉碘化钾溶液,反应生成I2、K2SO4等,相应反应的离子方程式为 +5I-+6H+=3I2+3H2O。Cl2、H2O2、ClO2在反应中得到电子的数目越多,杀菌能力越强,等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)得电子的物质的量分别为2mol、2mol、5mol,所以消毒效率最高的是ClO2。因为NaClO+2HCl==NaCl+Cl2↑+H2O,所以“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓HCl)不能混用,原因是产生氯气,有毒。答案为:Na2CO3;+5I-+6H+=3I2+3H2O;ClO2;产生氯气,有毒;
(3)已知硼酸是一元弱酸,存在电离方程式H3BO3+H2O+H +,与过量NaOH反应时,其实质是H+与OH-发生反应生成H2O,得到的盐的化学式为 Na[B(OH)4]或NaB(OH)4。答案为:Na[B(OH)4]或NaB(OH)4;
(4)含重金属离子Cu2+的废水中,加入Na2S溶液,可生成CuS沉淀,Cu2+发生反应的离子方程式为Cu2++S2-=CuS↓。某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.87%,则,x=4。答案为:Cu2++S2-=CuS↓;4。
18. 树状分类法 I组 168 3CO+Fe2O33CO2+2Fe 2:1 SOCl2+H2O =SO2+2HCl
【详解】
物质按照组成物质的元素种类分类,Na、Fe、F2为一组,只由一种元素组成,能够和H2化合的为F2,则A组中有F2,B组中Na和Fe;乙组中均为化合物,能够与水反应的有CO、NO,则C组中有CO和NO。能够与水反应的中,生成碱的有NH3和Na2O2;则Ⅰ组中有NH3和Na2O2。Ⅱ组中有NO2、SO2、SOCl2。
(1)图示方法将多种单质和化合物按照层次,一层一层来分,符合树状分类的特点,属于树状分类;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于I组;Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为;
(3)B组中Fe可以在高温下与水蒸气发生反应;化学方程式为3Fe+4H2O(g)Fe3O4+4H2;若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g·mol-1=168g;
(4)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3的反应方程式为3CO+Fe2O3 3CO2+2Fe;
(5)Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,二氧化氮与水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO;3molNO2中化合价升高的N有2mol,化合价降低的N有1mol;则被氧化的NO2有2mol,被还原的NO2有1mol,比例为2:1;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,其化合价不变,S的化合价为+4,则生成SO2,Cl的化合价为-1,生成HCl。化学方程式为SOCl2+H2O =SO2+2HCl。
19. 氢 HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
【详解】
(1)电子层数越少,原子半径越小,原子半径最小的元素是氢;⑥是11号元素钠,钠离子核外有10个电子,离子结构示意图是;
(2)③是N元素,N2分子中含有氮氮三键,N2的电子式为;
(3)非金属性越强,最高价氧化物的水化物酸性越强,氟元素没有正价,所以最高价氧化物对应水化物酸性最强的是HClO4;
(4)F与Mg形成离子化合物MgF2,化学键类型为离子键;
(5)C与O形成的原子个数比为1:2的化合物是CO2,结构式为O=C=O。
(6)Na的电子层数最多半径最大,N、O电子层数相同,N质子数大于O,所以原子半径由大到小的顺序为Na>N>O;
(7)根据强酸制弱酸的原理,盐酸和石灰石反应生成二氧化碳,用碳酸氢钠溶液除去氯化氢,通入硅酸钠溶液生成硅酸沉淀,可证明非金属性C大于Si,所以溶液B是碳酸氢钠,作用是除去CO2气体中的HCl;二氧化碳和硅酸钠溶液反应生成硅酸沉淀,能说明非金属性C大于Si,化学方程式是Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓。
20. 放出 92 该反应是可逆反应,充分反应的最终结果是达到最大限度(即化学平衡状态),因此放出的热量总是小于理论计算值 CaF2 S=C=S H(2b-m)XOb
【详解】
(1)反应热=吸收的总能量-放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436kJ-2×3×391kJ=-92kJ,所以是放出热量,该反应是可逆反应,反应物不能完全转化为生成物,即充分反应的最终结果是达到最大限度,所以放出的热量总是小于理论计算值;
(2)XY2是离子化合物,X必然是2价的元素(不可能是4价的C和Si),由于X离子比Y离子多一个电子层,即X原子与Y原子相差3层电子,因此X只能是Ca,Y可以是F、O、C,但是只有CaF2恰好是38电子,满足题意,因此XY2是CaF2,如果XY2是共价化合物,则X必然是4价元素或者Be,通过电子计算,不难发现只有CS2满足要求.二硫化碳的结构式为:S=C=S;
(3)X、Y两元素的原子序数之差为4,它们组成的XY型化合物,则可以看成A是+2价,第ⅡA族的镁;B是-2价,为第ⅥA族的硫,所组成的化合物是硫化镁,属于离子化合物,电子式为:;
(4)氢元素化合价是+1价,氧元素的化合价是-2价,非金属X的最高正价为+m,设氢原子的数目是x,根据化合价守则,则x+m+(-2)×b=0,所以氢原子个数为2b-m,即酸的化学式是H(2b-m)XOb;
(5)根据题意,Y元素最高正价与最低负价的绝对值之差是6,则Y最高正价为+7,Y为Cl元素,再由Y元素与M元素形成离子化合物且在水中电离出电子层结构相同的离子,推出M为第四周期的金属元素,可能Ca元素,该化合物为CaCl2,属于离子化合物,CaCl2的形成过程可以表示为。
21.(1)①③
(2)2Na+2H2O=2NaOH+H2↑
(3)>
(1)
电解质是指在水溶液或熔融状态下能够导电的化合物,所有的酸、碱、盐和大多数金属氧化物均为电解质,故下列给定的物质中:① ②铝条 ③熔融氯化钠 ④乙醇,属于电解质的是①③,故答案为:①③;
(2)
金属钠投入水中反应生成NaOH和H2,故该反应的化学方程式2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)
由于H2O分子间存在氢键导致其沸点反常的高,故沸点:>,故答案为:>。
22.
【详解】
(1)溴化钾为离子化合物,含有K+和Br-,其电子式为;
(2)硫化钠为离子化合物,含有Na+和S2-,其电子式为;
(3)二氧化碳是共价化合物,C与O之间存在二个共用电子对,其电子式为;
(4)铵根离子的化学式为NH4+,其电子式为;
(5)氮气是双原子分子,两原子之间存在三对共用电子对,其电子式为;
(6)甲烷是正四面体结构,其结构式为。
23. ad ab
【详解】
(1)氮元素位于元素周期表第二周期,题给选项中,氢元素位于第一周期,碳、氧元素位于第二周期,硅元素位于第三周期,故选ad,故答案为:ad;
(2)氨分子的电子式是,故答案为:;
(3)为了较快得到氨,应该加快反应速率,故应采用加入催化剂并加压的措施,选ab,故答案为:ab;
(4)氨催化氧化生成的化学方程式是;和发生反应转化为无污染的空气成分,由原子守恒,生成物显然是和,则反应的化学方程式是,故答案为:;。
24.(1)b
(2)2:3
(3)4 mol L 1
(4)O=O
(1)
用铂丝蘸取下列物质灼烧,焰色反应时,钠为黄色,钾为紫色,铜为砖红色,因此焰色为紫色的是碳酸钾,故答案为:b。
(2)
同温同压下,同体积的和气体即物质的量相同,1个氮气含有2个原子,1个硫化氢含有3个原子,因此同温同压下,同体积的和气体中原子的个数比为2:3;故答案为:2:3。
(3)
将溶于水配制成1L溶液,则氯化镁物质的量浓度,因此溶液中的物质的量浓度为4 mol L 1;故答案为:4 mol L 1。
(4)
是氧氧双键,因此氧气的结构式为O=O;故答案为:O=O。
答案第1页,共2页
18
一、选择题(共16题)
1.下列表示物质结构的化学用语正确的是
A.H、D、T表示同一种核素
B.的形成过程:
C.的结构示意图:
D.的电子式
2.2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2CO+NaClO。下列有关化学用语表示错误的是( )
A.中子数为12的钠原子:Na B.Cl-的结构示意图:
C.CO2的结构式:O=C=O D.NaClO的电子式:
3.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物--定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
4.下列叙述中,不正确的是
A.HCl溶于水时要破坏离子键
B.CCl4和NH3都是只含有极性键的共价化合物
C.Na2O2是含有非极性键的离子化合物
D.CaO和NaCl晶体熔化时要破坏离子键
5.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是
A.原子半径大小:Y>Z>Q
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应,也能与甲醇反应
6.W、X、Y、Z四种元素在周期表中的位置如图所示,W为短周期元素,其核电荷数是周期序数的5倍。下列说法错误的是
W X Y
Z
A.简单离子半径: W>X> Y
B.W与Y至少能形成两种共价化合物
C.W与X的单质均存在同素异形体
D.X与Z原子序数相差8
7.下列分子中所有原子都满足最外层为8电子稳定结构的是
A.AlCl3 B.H2O C.SiCl4 D.PCl5
8.下列说法正确的是
A.HClO的结构式为H-Cl-O
B.还原性: >HCl,则非金属性:S>Cl
C.可用于除去废水中的和
D.氢氧化亚铁溶于过量稀硝酸时发生反应
9.下列说法正确的是
A.比稳定,是由于分子间存在氢键 B.物质中化学键被破坏,一定发生化学变化
C.晶体和中的化学键类型相同 D.熔化时破坏离子键和共价键
10.科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
11.下列各项表达正确的是
A.F-的结构示意图: B.HClO的结构式:H-O-Cl
C.CO2的分子模型示意图: D.CCl4的电子式:
12.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
13.已知A、B、C、D为原子序数依次增大的短周期元素,E为地壳中含量最高的过渡金属元素,A与D同主族,B与C同周期且相邻,C与D的原子序数之和为20.甲、乙分别为E、A的单质且A的单质为气体,丙、丁为A、E分别与B形成的二元化合物,甲、乙、丙、丁的转化关系如图所示。下列说法错误的是
A.A、B形成的一种化合物具有漂白性
B.常见的C的单质是一种无色无味的气体
C.B、D形成的离子化合物中可能含有非极性键
D.丁为黑色固体,且1mol甲与足量丙反应转移的电子数为
14.短周期主族元素W、E、X、Y的原子序数依次增大,它们位于三个不同的周期,E和X同周期。由E、X、Y组成的一种化合物——百菌清(M),是一种广谱保护性杀菌剂,结构式如图所示。下列说法错误的是
A.M属于共价化合物
B.常温下,最简单氢化物在水中的溶解性:
C.Y的最高价氧化物对应的水化物是弱酸
D.W、X、Y只能形成共价化合物
15.氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。下列说法错误的是
A.Na3N是由离子键形成的离子化合物
B.Na3N与盐酸反应生成两种盐
C.Na3N与水的反应属于氧化还原反应
D.Na3N中两种粒子的半径:r(Na+)>r(N3-)
16.M元素的一个原子失去两个电子转移到R元素的两个原子中去,形成离子化合物,下列说法不正确的是
A.M与R形成化合物的化学式为MR2
B.M元素的原子半径一定比R元素的半径大
C.M与R形成的离子化合物一定溶于水
D.M与R形成的离子化合物的晶体熔融时能导电
二、综合题
17.金属材料在生活生产中应用极其广泛,回答下列问题。
(1)请写出Na2O2的电子式 _________ , _________ (填“是”或“不是”)碱性氧化物。
(2)工业上,粗盐需精制,为除去Ca2+需要加入的试剂为 _________ 。食盐中含有KIO3,可加入稀硫酸酸化的淀粉碘化钾溶液检测,若变蓝,则说明含有KIO3,写出相应反应的离子方程式 _________ 。等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)消毒效率最高的是 ________ 。“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓HCl)不能混用,原因是 _________ 。
(3)已知硼酸是一元弱酸,存在电离方程式H3BO3+H2O+H +,其与过量NaOH反应得到的盐的化学式为 _________ 。
(4)含重金属离子Cu2+的废水中,可加入Na2S溶液除去,写出Cu2+发生反应的离子方程式 ________ 。某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.87%,则x= ______ 。
18.现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2、SOCl2等物质,根据它们的组成及性质进行如下分类:
请回答下列问题:
(1)图中所示的分类方法叫___________。
(2)淡黄色固体最终位于__________组,它的电子式为___________。
(3)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023个电子转移,则有__g该物质参与反应。
(4)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式___________。
(5)II组某种物质能与水发生氧化还原反应,该反应中被氧化元素与被还原的元素的质量比为___________。
(6)II组另有一种物质滴入水中后与水剧烈反应,元素化合价不发生变化,该物质与水反应的化学方程式___________。
19.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 IA 0
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨
(1)原子半径最小的元素是___(填元素名称),写出⑥的离子结构示意图___。
(2)③的单质的电子式为__。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___(填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____。
(6)③、④、⑥的原子半径由大到小的顺序为___(用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
a.溶液B的作用是___。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___。
20.按要求填空:
(1)拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则理论上1 mol N2生成NH3___________热量(填:“吸收”或“放出”) _______kJ;事实上,反应的热量总小于理论值,理由是__________________________。
(2)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其结构式是____________。
(3)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其电子式为____________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,用电子式表示该化合物的形成过程______________
21.请按要求完成下列填空。
(1)下列给定的物质中:① ②铝条 ③熔融氯化钠 ④乙醇。属于电解质的是_______(填编号)。
(2)写出金属钠投入水中反应的化学方程式_______。
(3)比较沸点:_______(填“>”“<”“=”)。
22.按要求写出:
(1)溴化钾电子式_____________________。
(2)硫化钠电子式_____________________。
(3)二氧化碳的电子式______________。
(4)铵根离子的电子式_____________。
(5)氮气的电子式______________。
(6)甲烷的结构式____________。
23.氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。回答下列问题:
(1)与氮元素不在同一周期的元素是___________(填标号)
a.氢 b.碳 c.氧 d.硅
(2)氨的电子式是___________。
(3)合成氨的化学方程式为(该反应为放热反应)。为了较快得到氨,工业上采用的措施是___________(填标号)。
a.使用催化剂 b.高压 c.低压 d.常温
(4)氨催化氧化生成是工业制硝酸的反应之一,写出该反应的化学方程式___________;、都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过反应转化为无污染的空气成分,则反应的化学方程式是___________。
24.根据所学知识,回答下列问题:
(1)用铂丝蘸取下列物质灼烧,焰色为紫色的是___________(填序号)
a.NaCl b. c.
(2)同温同压下,同体积的和气体中原子的个数比为___________。
(3)将溶于水配制成1L溶液。溶液中的物质的量浓度为___________;
(4)的结构式为___________。
试卷第1页,共3页
8
参考答案:
1.B
【详解】
A.H、D、T是同一种元素的三种核素,A错误;
B.的形成过程:,B正确;
C.氯离子是由氯原子得一个电子形成的,核电荷数仍为17,故氯离子的结构示意图为,C错误;
D.氯化铵为离子化合物,氯离子的最外层电子数必须标出,正确的电子式为,D错误。
故选:B。
2.D
【详解】
A. 钠是11号元素,中子数为12的钠原子,质量数为23:Na ,故A正确;
B. 氯的核电荷为17,最外层得到1个电子形成稳定结构,Cl-的结构示意图:,故B正确;
C. 二氧化碳的碳与氧形成四个共用电子对,CO2的结构式:O=C=O,故C正确;
D. NaClO是离子化合物,NaClO的电子式:,故D错误;
故选D。
3.C
【详解】
A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na2O,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
4.A
【详解】
A.HCl为分子晶体,溶于水破坏共价键,故A错误;
B.CCl4中含有C-Cl极性键,NH3中含有N-H极性键,则CCl4和NH3都是只含有极性键的共价化合物,故B正确;
C.Na2O2含有离子键和O-O非极性键,是含有非极性键的离子化合物,故C正确;
D.CaO和NaCl是离子晶体,存在离子键,晶体熔化时要破坏离子键,故D正确。
故选:A。
5.D
【详解】
A.Y为N,Z为O,Q为Na,则原子半径:Q>Y>Z,A错误;
B.该化合物中Y原子得到3个电子形成8电子稳定结构,B错误;
C.该化合物中存在离子键和共价键,C错误;
D.Q为Na,能与水、甲醇反应生成氢气,D正确。
故选D。
6.D
【详解】
A.简单离子核外电子排布相同,核电荷数越大,离子半径越小:W(P3-)>X(S2-)>Y(Cl-),A正确;
B.W(P)与Y(Cl)能形成的共价化合物至少有PCl3和PCl5两种,B正确;
C.W(P)的同素异形体有白磷和红磷,X(S)的同素异形体有S2、S4、S6和S8等(或者斜方硫、单斜硫和弹性硫等),C正确;
D.16S与34Se原子序数相差18,D错误;
综上所述答案为D。
7.C
【详解】
A.AlCl3分子中Al原子最外层只有6个电子,不满足原子最外层8个电子的稳定结构,A不符合题意;
B.H2O分子中H原子只达到最外层2个电子的稳定结构,B不符合题意;
C.SiCl4分子中每个原子最外层都达到8个电子的稳定结构,C符合题意;
D.P原子最外层有5个电子,与5个Cl原子形成5对共用电子对,使P原子最外层电子数为10个,不满足原子最外层8个电子的稳定结构,D不符合题意;
故合理选项是C。
8.C
【详解】
A.HClO属于共价化合物,氧原子能够形成2个共价单键,结构式为:H-O-Cl,故A错误;
B.元素的非金属性越强,对应气态氢化物的还原性越弱,非金属性:Cl>S,所以还原性:>HCl,故B错误;
C.硫化铜、硫化汞均为难溶性物质,加入,可以沉淀铜离子和汞离子,达到除去废水中和的目的,故C正确;
D.二价铁具有较强的还原性,硝酸具有强氧化性,二者混合后发生反应,硝酸会把二价铁氧化为三价铁,自身被还原为NO等,故D错误;
故选C。
9.C
【详解】
A.比稳定,是由于H-F键的键能大于H-Cl,与氢键无关,故A错误;
B.化学反应的本质是既有旧键的断裂又有新键的形成,故化学键被破坏不一定发生化学反应,故B错误;
C.晶体和中都只有离子键,故化学键相同,故C正确;
D.熔化时只能破坏离子键,不能破坏共价键,故D错误;
故选C。
10.D
【详解】
A. 乙烯、丙烯和 2-丁烯结构相似,组成上相差若干个CH2原子团,都属于烯烃,互为同系物,A正确;
B. 乙烯、丙烯和 2-丁烯都属于烯烃,随着碳原子个数增加,沸点依次升高,故B正确;
C. 2-丁烯具有顺式()和反式()异构,故C正确;
D.由示意图可知,Ⅳ→Ⅰ的过程中,发生了碳、钨(W)原子间的化学键断裂(),故D错误;
故选D。
11.B
【详解】
A.F-的结构示意图为,故A错误;
B.HClO的结构式为H-O-Cl,故B正确;
C.碳原子半径大于氧原子半径,则不能表示CO2的分子模型,故C错误;
D.CCl4的电子式:,故D错误。
综上所述,答案为B。
12.C
【详解】
A项、氯化钠为强酸强碱盐,水溶液呈中性,故A错误;
B项、同周期元素从左到右,非金属性依次增强,则非金属性的强弱顺序为Cl>S>P,故B错误;
C项、P元素的最高价氧化物对应水化物为磷酸,磷酸是三元中强酸,故C正确;
D项、新化合物中P元素化合价为—3价,满足8电子稳定结构,故D错误。
故选C。
13.BD
【详解】
A.H、O两元素组成的H2O2有强氧化性,具有漂白性,故A正确;
B. C的单质F2是一种浅黄绿色的气体,故B错误;
C.B为O,D为Na,O和Na组成的Na2O2中含有离子键和非极性共价键,故C正确;
D.丁为Fe3O4,是黑色固体,由3Fe+4H2O(g)Fe3O4+4H2可知,1molFe与足量H2O反应转移电子NA,故D错误;
故答案为BD。
14.CD
【详解】
A.从结构简式看,M是由四种非金属元素组成的共价化合物,A正确;
B.氨分子与水分子之间能形成氢键、通常氨气极易溶于水,甲烷不溶于水,B正确;
C. Y为Cl、Cl的最高价氧化物对应的水化物是,为强酸,C错误;
D.W为H、X为N、Y为Cl,W、X、Y既能形成共价化合物、又能形成离子化合物,例如是离子化合物,D错误;
答案选CD。
15.CD
【详解】
A. Na3N含有活泼金属Na,属于离子化合物,A正确;
B. Na3N与盐酸反应生成氯化钠和氯化铵,B正确;
C. Na3N与水的反应生成氢氧化钠和氨气,化合价没有改变,不是氧化还原反应,C错误;
D. Na+和N3-核外电子数相同,但Na+质子数比N3-更多,因此r(Na+)
16.BC
【详解】
A.根据上述分析可知M形成的阳离子是M2+,R形成的是阴离子R-,故二者形成的化合物的化学式为MR2,A正确;
B.根据上述分析可知M可能是第IIA元素,也可能是副族元素;R可能是第VIIA的元素,也可能是H原子。M、R可能是同一周期元素,也可能是不同周期的元素,故M元素的原子半径不一定比R元素的半径大,B错误;
C.M与R形成的离子化合物可能溶于水,如CaCl2,也可能不溶于水,入CaF2,因此M与R形成的离子化合物不一定溶于水,C错误;
D.M与R形成的离子化合物的晶体为离子晶体,在熔融时电离产生自由移动的离子,因而能导电,D正确;
故合理选项是BC。
17. 不是 Na2CO3 +5I-+6H+=3I2+3H2O ClO2 产生氯气,有毒 Na[B(OH)4]或NaB(OH)4 Cu2++S2-=CuS↓ 4
【详解】
(1)Na2O2为离子化合物,由Na+和构成,电子式为,与酸反应生成盐和水的同时,还有O2生成,所以不是碱性氧化物。答案为:;不是;
(2)工业上,粗盐需精制,为除去Ca2+需要加入的试剂为Na2CO3。食盐中含有的KIO3,可加入稀硫酸酸化的淀粉碘化钾溶液,反应生成I2、K2SO4等,相应反应的离子方程式为 +5I-+6H+=3I2+3H2O。Cl2、H2O2、ClO2在反应中得到电子的数目越多,杀菌能力越强,等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)得电子的物质的量分别为2mol、2mol、5mol,所以消毒效率最高的是ClO2。因为NaClO+2HCl==NaCl+Cl2↑+H2O,所以“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓HCl)不能混用,原因是产生氯气,有毒。答案为:Na2CO3;+5I-+6H+=3I2+3H2O;ClO2;产生氯气,有毒;
(3)已知硼酸是一元弱酸,存在电离方程式H3BO3+H2O+H +,与过量NaOH反应时,其实质是H+与OH-发生反应生成H2O,得到的盐的化学式为 Na[B(OH)4]或NaB(OH)4。答案为:Na[B(OH)4]或NaB(OH)4;
(4)含重金属离子Cu2+的废水中,加入Na2S溶液,可生成CuS沉淀,Cu2+发生反应的离子方程式为Cu2++S2-=CuS↓。某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.87%,则,x=4。答案为:Cu2++S2-=CuS↓;4。
18. 树状分类法 I组 168 3CO+Fe2O33CO2+2Fe 2:1 SOCl2+H2O =SO2+2HCl
【详解】
物质按照组成物质的元素种类分类,Na、Fe、F2为一组,只由一种元素组成,能够和H2化合的为F2,则A组中有F2,B组中Na和Fe;乙组中均为化合物,能够与水反应的有CO、NO,则C组中有CO和NO。能够与水反应的中,生成碱的有NH3和Na2O2;则Ⅰ组中有NH3和Na2O2。Ⅱ组中有NO2、SO2、SOCl2。
(1)图示方法将多种单质和化合物按照层次,一层一层来分,符合树状分类的特点,属于树状分类;
(2)淡黄色固体为Na2O2,可与水反应生成NaOH和氧气,最终位于I组;Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为;
(3)B组中Fe可以在高温下与水蒸气发生反应;化学方程式为3Fe+4H2O(g)Fe3O4+4H2;若该反应过程中有8×6.02×1023个电子转移,即转移8mol电子,则消耗3molFe,即3mol×56g·mol-1=168g;
(4)C组有一种气体常用作工业上冶炼铁的还原剂是CO,CO与Fe2O3的反应方程式为3CO+Fe2O3 3CO2+2Fe;
(5)Ⅱ组的某种物质能与水发生氧化还原反应,该物质为NO2,二氧化氮与水反应生成硝酸和一氧化氮,化学方程式为3NO2+H2O=2HNO3+NO;3molNO2中化合价升高的N有2mol,化合价降低的N有1mol;则被氧化的NO2有2mol,被还原的NO2有1mol,比例为2:1;
(6)Ⅱ组另有一种物质滴入水中后与水激烈反应,该物质为SOCl2,其化合价不变,S的化合价为+4,则生成SO2,Cl的化合价为-1,生成HCl。化学方程式为SOCl2+H2O =SO2+2HCl。
19. 氢 HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
【详解】
(1)电子层数越少,原子半径越小,原子半径最小的元素是氢;⑥是11号元素钠,钠离子核外有10个电子,离子结构示意图是;
(2)③是N元素,N2分子中含有氮氮三键,N2的电子式为;
(3)非金属性越强,最高价氧化物的水化物酸性越强,氟元素没有正价,所以最高价氧化物对应水化物酸性最强的是HClO4;
(4)F与Mg形成离子化合物MgF2,化学键类型为离子键;
(5)C与O形成的原子个数比为1:2的化合物是CO2,结构式为O=C=O。
(6)Na的电子层数最多半径最大,N、O电子层数相同,N质子数大于O,所以原子半径由大到小的顺序为Na>N>O;
(7)根据强酸制弱酸的原理,盐酸和石灰石反应生成二氧化碳,用碳酸氢钠溶液除去氯化氢,通入硅酸钠溶液生成硅酸沉淀,可证明非金属性C大于Si,所以溶液B是碳酸氢钠,作用是除去CO2气体中的HCl;二氧化碳和硅酸钠溶液反应生成硅酸沉淀,能说明非金属性C大于Si,化学方程式是Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓。
20. 放出 92 该反应是可逆反应,充分反应的最终结果是达到最大限度(即化学平衡状态),因此放出的热量总是小于理论计算值 CaF2 S=C=S H(2b-m)XOb
【详解】
(1)反应热=吸收的总能量-放出的总能量,所以1mol N2生成NH3的反应热=946kJ+3×436kJ-2×3×391kJ=-92kJ,所以是放出热量,该反应是可逆反应,反应物不能完全转化为生成物,即充分反应的最终结果是达到最大限度,所以放出的热量总是小于理论计算值;
(2)XY2是离子化合物,X必然是2价的元素(不可能是4价的C和Si),由于X离子比Y离子多一个电子层,即X原子与Y原子相差3层电子,因此X只能是Ca,Y可以是F、O、C,但是只有CaF2恰好是38电子,满足题意,因此XY2是CaF2,如果XY2是共价化合物,则X必然是4价元素或者Be,通过电子计算,不难发现只有CS2满足要求.二硫化碳的结构式为:S=C=S;
(3)X、Y两元素的原子序数之差为4,它们组成的XY型化合物,则可以看成A是+2价,第ⅡA族的镁;B是-2价,为第ⅥA族的硫,所组成的化合物是硫化镁,属于离子化合物,电子式为:;
(4)氢元素化合价是+1价,氧元素的化合价是-2价,非金属X的最高正价为+m,设氢原子的数目是x,根据化合价守则,则x+m+(-2)×b=0,所以氢原子个数为2b-m,即酸的化学式是H(2b-m)XOb;
(5)根据题意,Y元素最高正价与最低负价的绝对值之差是6,则Y最高正价为+7,Y为Cl元素,再由Y元素与M元素形成离子化合物且在水中电离出电子层结构相同的离子,推出M为第四周期的金属元素,可能Ca元素,该化合物为CaCl2,属于离子化合物,CaCl2的形成过程可以表示为。
21.(1)①③
(2)2Na+2H2O=2NaOH+H2↑
(3)>
(1)
电解质是指在水溶液或熔融状态下能够导电的化合物,所有的酸、碱、盐和大多数金属氧化物均为电解质,故下列给定的物质中:① ②铝条 ③熔融氯化钠 ④乙醇,属于电解质的是①③,故答案为:①③;
(2)
金属钠投入水中反应生成NaOH和H2,故该反应的化学方程式2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(3)
由于H2O分子间存在氢键导致其沸点反常的高,故沸点:>,故答案为:>。
22.
【详解】
(1)溴化钾为离子化合物,含有K+和Br-,其电子式为;
(2)硫化钠为离子化合物,含有Na+和S2-,其电子式为;
(3)二氧化碳是共价化合物,C与O之间存在二个共用电子对,其电子式为;
(4)铵根离子的化学式为NH4+,其电子式为;
(5)氮气是双原子分子,两原子之间存在三对共用电子对,其电子式为;
(6)甲烷是正四面体结构,其结构式为。
23. ad ab
【详解】
(1)氮元素位于元素周期表第二周期,题给选项中,氢元素位于第一周期,碳、氧元素位于第二周期,硅元素位于第三周期,故选ad,故答案为:ad;
(2)氨分子的电子式是,故答案为:;
(3)为了较快得到氨,应该加快反应速率,故应采用加入催化剂并加压的措施,选ab,故答案为:ab;
(4)氨催化氧化生成的化学方程式是;和发生反应转化为无污染的空气成分,由原子守恒,生成物显然是和,则反应的化学方程式是,故答案为:;。
24.(1)b
(2)2:3
(3)4 mol L 1
(4)O=O
(1)
用铂丝蘸取下列物质灼烧,焰色反应时,钠为黄色,钾为紫色,铜为砖红色,因此焰色为紫色的是碳酸钾,故答案为:b。
(2)
同温同压下,同体积的和气体即物质的量相同,1个氮气含有2个原子,1个硫化氢含有3个原子,因此同温同压下,同体积的和气体中原子的个数比为2:3;故答案为:2:3。
(3)
将溶于水配制成1L溶液,则氯化镁物质的量浓度,因此溶液中的物质的量浓度为4 mol L 1;故答案为:4 mol L 1。
(4)
是氧氧双键,因此氧气的结构式为O=O;故答案为:O=O。
答案第1页,共2页
18
