1.1原子结构与元素性质——提升训练2021~2022学年高一化学下学期鲁教版(2019)必修第二册(含答案解析)
文档属性
| 名称 | 1.1原子结构与元素性质——提升训练2021~2022学年高一化学下学期鲁教版(2019)必修第二册(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 404.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 10:22:49 | ||
图片预览



文档简介
1.1原子结构与元素性质
一、选择题(共16题)
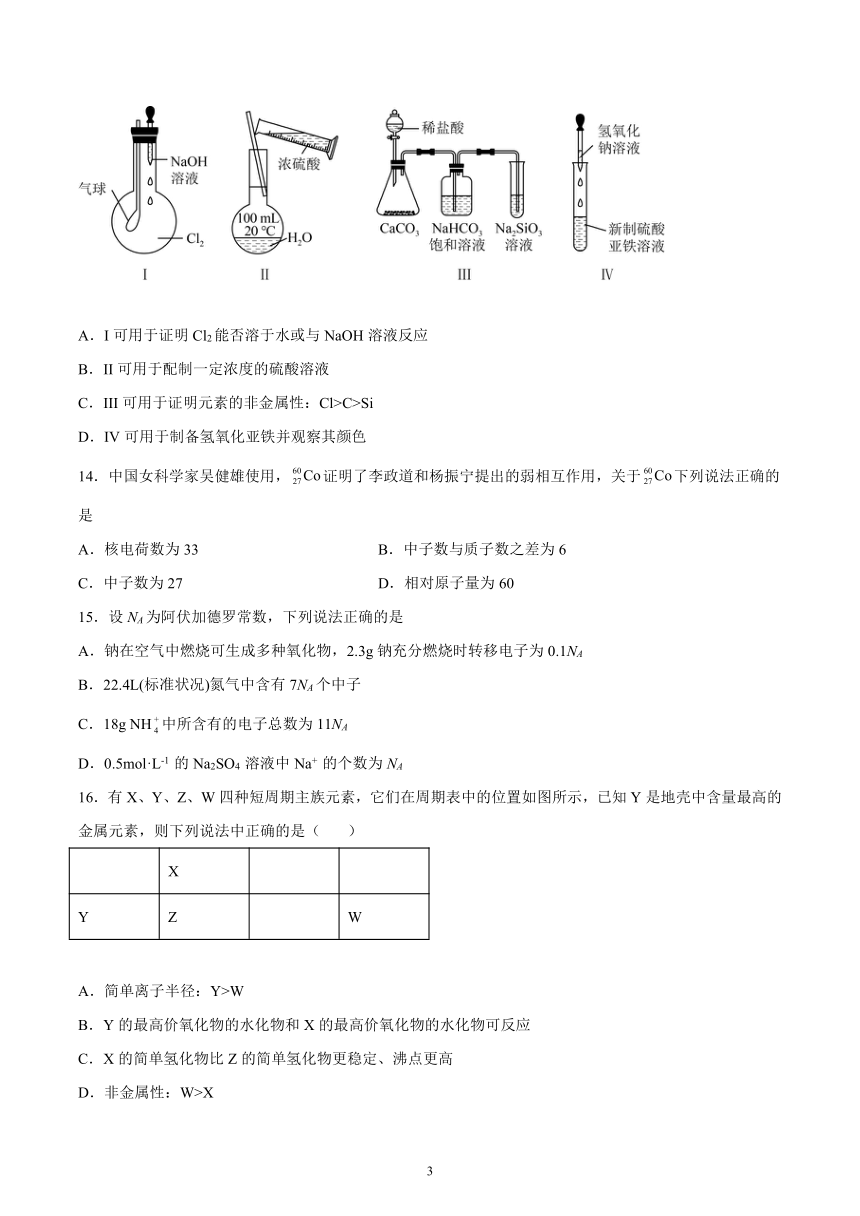
1.2011年3月日本发生强震和海啸而发生核泄漏,泄漏出人工放射性碘131I,碘的质子数是53,则该人工放射性碘的核内中子数为( )
A.53 B.78 C.131 D.184
2.下列叙述正确的是:( )
A.1H2与2H2互为同素异形体 B.14C与14N质量数相同,互称同位素
C.6Li与7Li的性质相同 D.23Na与24Mg的中子数相同
3.硒(Se)是人体必需的微量元素,它的一种核素是Se,其质子数是
A.114 B.80 C.46 D.34
4.在物质结构研究的历史上,首先提出原子内有电子学说的科学家是
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
5.工业上可以利用氪的一种同位素进行测井探矿、无损探伤、检查管道泄漏等。这里的85是指
A.质子数 B.电子数 C.中子数 D.质量数
6.放射性核素H。下列说法不正确的是
A.H原子核外电子数是1 B.H原子核内中子数是3
C.可用质谱分辨H和H D.3H2O也具有放射性
7.可用于同位素示踪原子探究某些反应的反应机理,关于表示的含义错误的是
A.表示氧元素的一种同位素
B.表示氧元素的一种核素
C.质量数是18,原子序数是8,核内有10个质子
D.质量数是18,原子序数是8,核内有10个中子
8.下列物质组合中,不属于同素异形体的是
A.氧气和臭氧 B.双氧水和水
C.红磷和白磷 D.碳60(C60)和石墨
9.石墨烯制成的多功能聚合物复合材料、高强度多孔陶瓷材料,增强了复合材料的许多特殊性能。石墨烯原子结构如图所示。下列有关石墨烯的说法中正确的是
A.是一种新型的化合物
B.是碳元素的一种核素
C.与金刚石互为同素异形体
D.属于无机金属材料
10.水和重水(H2O)分别跟金属钾反应,若电子转移的数目相同时,下列化学量相等的是
①消耗水和重水质量②同温同压下生成气体的体积③生成气体的质量④参加反应的钾的物质的量
A.①③ B.②④ C.①④ D.②③
11.下列实验能达到预期目的的是
实验内容 实验目的
A 用蘸有新制氯水的玻璃棒,滴到干燥的pH试纸表面 检验氯水的pH值
B 稀盐酸和硅酸钠溶液反应,生成白色胶状沉淀 证明氯元素的非金属性强于硅元素
C 金属铝和氢氧化钠溶液反应生成氢气,但不与熔融氢氧化钠生成氢气 证明金属铝不与氢氧化钠反应
D 在电炉中,高温下焦炭将二氧化硅还原成粗品的硅单质 证明碳元素的非金属性强于硅元素
A.A B.B C.C D.D
12.关于,下列的叙述中,错误的是
A.质子数为11 B.电子数为11 C.中子数为12 D.质量数为12
13.下列实验能达到实验目的且符合操作要求的是
A.I可用于证明Cl2能否溶于水或与NaOH溶液反应
B.II可用于配制一定浓度的硫酸溶液
C.III可用于证明元素的非金属性:Cl>C>Si
D.IV可用于制备氢氧化亚铁并观察其颜色
14.中国女科学家吴健雄使用,证明了李政道和杨振宁提出的弱相互作用,关于下列说法正确的是
A.核电荷数为33 B.中子数与质子数之差为6
C.中子数为27 D.相对原子量为60
15.设NA为阿伏加德罗常数,下列说法正确的是
A.钠在空气中燃烧可生成多种氧化物,2.3g钠充分燃烧时转移电子为0.1NA
B.22.4L(标准状况)氮气中含有7NA个中子
C.18g NH中所含有的电子总数为11NA
D.0.5mol·L-1 的Na2SO4 溶液中Na+ 的个数为NA
16.有X、Y、Z、W四种短周期主族元素,它们在周期表中的位置如图所示,已知Y是地壳中含量最高的金属元素,则下列说法中正确的是( )
X
Y Z W
A.简单离子半径:Y>W
B.Y的最高价氧化物的水化物和X的最高价氧化物的水化物可反应
C.X的简单氢化物比Z的简单氢化物更稳定、沸点更高
D.非金属性:W>X
二、综合题(共6题)
17.钠、钾与水反应的实验如下图所示:
(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
18.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1) 根据用途推测SiO2在水中的溶解性:_______(填“易溶”或“难溶”)。SiO2用途很广,请再写出另外的任一种用途:_______
(2)Si在元素周期表中的位置是_______。
(3)制备SiO2的方法如下:
①写出反应I的离子方程式_______。
②比较酸性强弱:H2SO4_______H2SiO3(填“>”或“<”)。
③下列事实能说明S的非金属性比Si强的有_______
A.常温下SO2是气体,SiO2是固体
B.H2SO3的酸性比H2SiO3强
C.H2S的热稳定性比SiH4强
D.S的最高价是+6,Si的最高价是+4
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。
下列说法不正确的是 _______(填序号)。
a.Sn元素的最高正化合价为+4 b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料 d.Sn位于周期表的第五周期、第IVA族
19.钋(Po)是一种低熔点金属,极其稀有,毒性和放射性极强。回答下列问题:
(1)Po具有放射性,经衰变成稳定的铅,在衰变过程中释放一个He2+,Pb的原子核中质子数为____,中子数为____,Po元素能形成较稳定的+4价离子,wgPo4+含有的电子的物质的量为____;
(2)半衰期是指由大量原子组成的放射性样品中,放射性元素原子核有50%发生衰变所需的时间,已知Po的半衰期为138天,质量为64克的Po,经276天后,得到铅的质量为____。
20.已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________。
(2)下列有关性质的比较,能用元素周期律解释的是_________。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。
(4)实验室用如下方法制备H2S并进行性质验证。
①设计B装置的目的是证明_________,B中实验现象为_______________。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。
21.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是____________(填标号)。
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为___________、_______,制得等量H2所需能量较少的是_______。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=______%,反应平衡常数K=_____。(可用分数表示)
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的△H___0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____________ (填标号)
A.H2S B.CO2 C.COS D.N2
22.碳是一种极其重要的元素,工业上,生活中到处可见。
(1)碳原子核外有________种能量不同的电子,这些电子占据了______个纺锤形轨道。
(2)下列方法可以比较碳与硫的非金属性强弱的是__________
a.比较原子最外层电子数多少 b.比较其最高价氧化物对应水化物的酸性
c.比较气态氢化物的稳定性 d.比较单质的熔沸点高低
(3)煤的气化是煤高效洁净利用的方向之一。在一定温度下的某容积可变的密闭容器中 建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
a.体系的压强不再发生变化 b.v正(CO)=v逆(H2O)
c.生成n molCO的同时生成n mol H2 d.1mol H-H键断裂同时断裂2mol H-O键
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),则容器内气体的平均相对分子质量将______(填写不变、变小、变大、无法确定)。若工业上以此方法生产水煤气,提高产率的措施为____。(写出两条措施)
(5)空气中的CO2浓度增大,会导致温室效应,有人提出将CO2通过管道输送到海底,这可减缓空气中CO2浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。请你结合CO2的性质,从平衡角度分析酸性增强原因 _____________________。
试卷第1页,共3页
2
参考答案:
1.B
【详解】
在原子符号中,X为元素符号,A代表质量数,Z代表质子数,质量数=中子数+质子数。131I中的131表示的是碘原子的质量数,碘的质子数为53,则该碘原子的中子数为131-53=78,故选B。
2.D
【详解】
A.都是氢气单质,为同一种物质,不属于同素异形体,A错误;
B.质子数相同而中子数不同的两种核素互称同位素,选项中14C的质子数为6,14N的质子数为7,两种核素的质子数不同,故不能互称为同位素,B错误;
C.6Li和7Li的中子数不同,核电荷数相同,二者化学性质几乎相同,但物理性质稍有差异,C错误;
D.23Na有23-11=12个中子,24Mg有24-12=12个中子,二者中子数相同,D正确;
故选D。
3.D
【详解】
元素符号左上角表示质量数,左下角表示质子数,Se表示其质子数为34,质量数为80的核素,故选D。
4.C
【详解】
A.道尔顿提出近百代原子学说,他认为原子是微小的不可分割的实心球体,选项A错误;
B.卢度瑟福(汤姆生的学生)提出了带核的原子结构模型,选项B错误;
C.汤姆生发现了电子,提出“道葡萄干面包式”的原子结构模型,选项C正确;
D.波尔(卢瑟福的学生)引入量子论观点,提出电子在内一定轨道上运动的原子结构模型,选项D错误;
答案选C。
5.D
【详解】
的质量数为85,质子数为36,故选D。
6.B
【详解】
A.放射性核素 ,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.质谱分析是根据质量分辨,和质量数不一样,可以分辨,故C正确;
D.是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
7.C
【详解】
A.表示氧元素的一种同位素,A正确;
B.表示氧元素的一种核素,B正确;
C.质量数是18,原子序数是8,核内有8个质子,C错误;
D.质量数是18,原子序数是8,核内有10个中子,D正确;
综上所述,正确答案为C。
8.B
【详解】
A.氧气和臭氧是O元素的两种不同性质的单质,二者互为同素异形体,A不符合题意;
B.双氧水和水是H、O两种元素形成的不同的化合物,二者不属于同素异形体,B符合题意;
C.红磷和白磷是P元素的两种不同性质的单质,二者互为同素异形体,C不符合题意;
D.碳60(C60)和石墨是C元素的两种不同性质的单质,二者互为同素异形体,D不符合题意;
故合理选项是B。
9.C
【详解】
A.石墨烯是碳元素形成的一种单质,不是新型的化合物,A错误;
B.石墨烯是碳元素形成的一种单质,不是碳元素的一种核素,B错误;
C.石墨烯是碳元素形成的一种单质,与金刚石互为同素异形体,C正确;
D.石墨烯是碳元素形成的一种单质,属于非金属单质,不属于无机金属材料,D错误;
答案选C。
10.B
【详解】
重水中含有D比H多了一个中子数,转移的电子总数相等,两反应中电子转移的电子的总物质的量相等,所以消耗的水和重水的物质的量相等,质量不相等,生成的气体的质量也不相等,但是生成的气体在相同条件下体积相等,参加反应的钾的物质的量也相等,所以答案为B。
11.C
【详解】
A. 新制氯水含有具有强氧化性的次氯酸,能将pH试纸漂白,不能用pH试纸测定新制氯水的pH,故A错误;
B. 盐酸不是Cl的最高价含氧酸,故不能证明氯元素的非金属性强于硅元素,故B错误;
C. 金属铝与氢氧化钠溶液可以发生反应,与干燥的氢氧化钠不反应,金属铝和NaOH溶液反应的实质是:铝先和NaOH溶液中的水反应生成氢氧化铝,然后氢氧化铝再跟氢氧化钠反应,生成偏铝酸钠和氢气,故C正确;
D. 高温下焦炭将二氧化硅还原成粗品的硅单质的反应中C充当的是还原剂,其还原性大于还原产物Si的还原性,不能证明碳元素的非金属性强于硅元素,故D错误。
综上所述,答案为C。
12.D
【详解】
的质子数为11,质量数为23,中子数=质量数-质子数=23-11=12,核外电子数=核内质子数=11,不正确的是D,故选D。
13.A
【详解】
A.若Cl2能溶于水或与NaOH溶液反应,则装置 I中气球膨胀,故选A;
B.不能在容量瓶中进行浓溶液的稀释,故不选B;
C.证明非金属性强弱需通过最高价含氧酸的酸性强弱,因此不能选用盐酸,应选用高氯酸,故不选C;
D.氢氧化亚铁易被氧化,制备氢氧化亚铁并观察其颜色,应把胶头滴管伸入硫酸亚铁溶液中,再挤压胶头滴入氢氧化钠溶液,故不选D;
故选:A。
14.B
【详解】
A.核电荷数=质子数=27,故A错误;
B.中子数=质量数-质子数=60-27=33,中子数与质子数之差为33-27=6,故B正确;
C.中子数=质量数-质子数=60-27=33,故C错误;
D.质量数是60,只能说Co的其中一个核素的相对原子质量近似为60,不能将60表示为Co元素的相对原子量,故D错误;
故选:B。
15.A
【详解】
A.钠在空气中燃烧可生成多种氧化物,反应中钠均失去1个电子,2.3g钠的物质的量是0.1mol,充分燃烧时转移电子为0.1NA,A正确;
B.22.4L(标准状况)氮气的物质的量是1mol,但该氮气中氮原子含有的中子数不确定,无法计算中子数,B错误;
C.18g NH的物质的量是1mol,铵根中含有10个电子,因此所含有的电子总数为10NA,C错误;
D.0.5mol·L-1的Na2SO4溶液的体积不确定,不能计算其中所含Na+的个数,D错误;答案选A。
16.D
【详解】
Y是地壳中含量最高的金属元素,应为Al元素,结合元素周期表的结构可知:X为C元素,Z为Si元素,W为S元素;
A.S2-核外比Al3+多一个电子层,则简单离子半径:S2->Al3+,故A错误;
B.Al元素的最高价氧化物的水化物为Al(OH)3, C元素的最高价氧化物的水化物为H2CO3,是弱酸,不能溶解Al(OH)3,故B错误;
C.C的非金属性比Si强,则C的简单CH4比Si的简单氢化物SiH4更稳定,但SiH4沸点比CH4高,故C错误;
D.硫酸的酸性比碳酸强,则S的非金属性比C强,即非金属性:W>X,故D正确;
故答案为D。
17. 浮在 熔化 变红 钾 钾 剧烈 2K+2H2O===2KOH+H2↑
【详解】
分析:钠、钾两种金属的密度都比水小,所以都浮在水面上;都能与水剧烈反应,放出大量的热,熔化成闪亮的小球,在水面上四处游动,产生嘶嘶的声音,且钾反应的剧烈程度大于钠;两种金属与水反应的生成物为强碱,均能使酚酞变红;据以上分析解答。
详解:(1)①钠、钾均属于活泼金属,都能与水剧烈反应,二者密度都比水小,所以都浮在水面上;正确答案:浮在。
②钠、钾均属于活泼金属,都能与水剧烈反应,放出大量的热,两种金属熔点低,都熔化成闪亮的小球;正确答案:熔化。
⑤钠、钾均属于活泼金属,都能与水剧烈反应,生成强碱氢氧化钠和氢氧化钾,反应后的溶液使酚酞变红;正确答案:变红。
(2)金属钾活泼性大于钠,因此钾与水反应剧烈反应,浮在水面上,融化成闪亮的小球,有轻微的爆鸣声,并很快燃烧起来;正确答案:钾。
(3)通过实验可知,金属钾的活性大于钠,所以钾更易与水反应,且反应更钾剧烈;正确答案:钾;剧烈。
(4)钾与水反应生成氢氧化钾和氢气,化学方程式是:2K+2H2O===2KOH+H2↑;正确答案:2K+2H2O===2KOH+H2↑。
18. 难容 制造玻璃 第三周期第ⅣA族 > 2H++SiO= H2SiO3↓ C c
【详解】
(1) SiO2是一种常见的摩擦剂,在牙膏中乙固体形式存在,根据用途推测SiO2在水中难溶。SiO2用途很广低纯度的二氧化硅可做玻璃,二氧化硅是制造玻璃、石英玻璃、水玻璃、光导纤维电子工业的重要部件,光学仪器工艺品和耐火材料的原件是科学研究的重要的材料。
(2)Si是第14号元素,原子核外有三层电子,,最外层电子数为4,Si在元素周期表中的位置是第三周期第ⅣA族。
(3)①硅酸钠与硫酸反应生成硅酸沉淀,离子方程式:2H++SiO= H2SiO3↓。
②根据①可知强酸制取弱酸,②中H2SO4酸性强于H2SiO3。
③A.常温下SO2是气体,SiO2是固体,为物理性质不能比较非金属性,故A错误;
B.非金属性越强最高价氧化物对应的水化合物酸性越强,H2SO3的酸性比H2SiO3强,所以不能作比较,故B错误;
C.H2S的热稳定性比SiH4强,气态氢化物热稳定性越强,非金属性越强,故C正确;
D.S的最高价是+6,Si的最高价是+4,不为同周期,也不为同主族,故不能比较,故D错误;
故选C。
(4)a.Sn为主族元素,主族元素的最高正化合价等于其族序数,S'n为第IVA族元素,因此Sn的最高正化合价为+4价,故a正确;
b.同一主族元素原子从上到下原子半径逐渐增大,因此Sn的原子半径大于Si,故b正确;
c.Sn为金属元素,可以导电,Sn不是半导体,Si为非金属元素,也可以导电,Si是半导体,故c错误;
d.Sn位于周期表的第五周期、第IVA族,故d正确;
故选c。
19. 82 124 mol 47.09g
【详解】
(1)Po的质子数是84,它释放出的2+的质子数是2,所以Pb的质子数=84-2=82;Po的中子数是210-84=126,它释放出的2+的中子数=4-2=2,所以Pb的中子数=126-2=124;的质量数为210,所以Po的摩尔质量数值为210,质量为Wg的Po的物质的量为mol,一个Po原子含的电子数为84,一个Po4+离子含的电子数为84-4=80,所以Wg所含的电子的物质的量为mol×80=mol;
(2)经过第一个半衰期生成的Pb的物质的量为×50%mol,剩余的Po的物质的量为×50%mol;再经过第二个半衰期生成的Pb的物质的量为×50%×50%mol,所以经过276天所得Pb的质量为(×50%+×50%×50%)×206g/mol=47.09g。
20. 第七(或7)周期VIA族 abd Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4 H2S具有还原性 出现淡黄色(或乳白色)沉淀(或浑浊) Cu2++H2S==CuS↓+2H+ 该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质
【详解】
(1) O、S、Se、Te、Po、Lv是同主族元素,都是氧族元素,位于第VIA族,O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大,因此Lv位于第七(或7)周期,在周期表中的位置为,故答案为:第七(或7)周期VIA族;
(2)a.同一主族元素,从上到下,离子半径逐渐增大,因此离子半径:Te2->Se2-,能用元素周期律解释,故a选;b.同一主族元素,从上到下,非金属性逐渐减弱,氢化物的稳定性减弱,因此热稳定性:H2O>H2S,能用元素周期律解释,故b选;c.物质的熔沸点是物理性质,不能用元素周期律解释,故c不选;d.同一主族元素,从上到下,非金属性逐渐减弱,最高价含氧酸的酸性减弱,因此酸性:H2SO4>H2SeO4,能用元素周期律解释,故d选;故答案为:abd;
(3)Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4,故答案为:Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4;
(4)①双氧水具有较强的氧化性,H2S具有还原性,能够被双氧水氧化生成硫单质沉淀,故答案为:H2S具有还原性;出现淡黄色沉淀;
②硫化氢能够与硫酸铜反应生成黑色不溶于硫酸的CuS沉淀,反应的离子方程式为Cu2++H2S==CuS↓+2H+,故答案为:Cu2++H2S==CuS↓+2H+;
③根据“强酸制弱酸”的原理,装置A中硫化亚铁与硫酸反应生成硫化氢,因为硫化亚铁能够被硫酸溶解,C中发生Cu2++H2S==CuS↓+2H+,是因为生成的硫化铜不能溶于硫酸,因此该反应能够发生,故答案为:该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质。
21. B H2O(l)=H2(g)+1/2O2(g) △H=+286 kJ/mol H2S(l)=H2(g)+S(s) △H=+20 kJ/mol 系统Ⅱ 2.5 或2.8×10-3 > > B
【详解】
(1)A. 将Cl2通入Na2S溶液中,有黄色浑浊出现,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,A项正确;
B. 次氯酸不是最高价氧化物对应的水化物,不能作为非金属性判断的依据,B项错误;
C. 氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,C项正确;
D. 还原性:H2S>HCl,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,D项正确;
答案选B;
(2)①H2SO4(aq)=SO2(g)+H2O(l)+O2(g) △H1=+327 kJ/mol
②SO2(g)+I2(s)+ 2H2O(l)=2HI(aq)+ H2SO4(aq) △H2=-151 kJ/mol
③2HI(aq)= H2 (g)+ I2(s) △H3=+110 kJ/mol
④H2S(g)+ H2SO4(aq)=S(s)+SO2(g)+ 2H2O(l) △H4=+61 kJ/mol
①+②+③,整理可得系统(I)的热化学方程式H2O(l)=H2(g)+O2(g) △H=+286 kJ/mol;
②+③+④,整理可得系统(II)的热化学方程式H2S (g)=H2(g)+S(s) △H=+20 kJ/mol。
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II。
(3)依据题意列出“三段式”如下:
水的物质的量分数为 =0.02
解得x=0.01
①α1=×100%=2.5%,K= =2.8×10-3,故答案为2.5;或2.8×10-3;
②升温,水的物质的量分数升高,说明升温时平衡正移,则α2>α1,ΔH>0,故答案为>;>;
③A.通入H2S,平衡虽正向移动,但H2S的转化率减小,A项错误;
B.通入CO2,平衡正向移动,H2S转化率增大,B项正确;
C.通入COS,增大生成物浓度,平衡逆向移动,H2S转化率减小,C项错误;
D.通入N2,平衡不移动,H2S转化率不变,D项错误;
答案选B。
22. 3 2 b bd 变大 适当提高反应温度、及时移走产物 海底压强大,CO2的溶解度将大大增加,且可以液体的形式存在,根据反应:CO2+H2OH2CO3 ,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-,H2CO3电离平衡向右移动,所以酸性增强
【详解】
(1)碳的电子排布式为1s22s22p2,所以有3种能量不同的电子,纺锤形轨道p上有2个电子,所以有2个纺锤形轨道,故答案为:3;2;
(2)根据硫酸可以和可溶性的碳酸盐反应可以知道硫酸酸性强于碳酸,而元素的最高价氧化物对应的水化物的酸性越强说明该元素的非金属性越强,答案选b;
(3)a.体系的压强一直不发生变化,选项a错误;
b.v正(CO)=v正(H2O)=v逆(H2O),选项b正确;
c.生成n molCO的同时生成n mol H2,未体现正与逆的关系,选项c错误;
d.1mol H-H键断裂等效于,形成2mol H-O键,同时断裂2mol H-O键,选项d正确;
答案选bd;
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),所以我们可以看从开始反应向右反应过程中平均相对分子质量是一个水分解为一个CO和H2是减少的,则加压是从右向左反应,显然是增大,故答案为:变大;
正反应是吸热反应,可采取适当提高反应温度,或及时移走产物,故答案为:可采取适当提高反应温度、及时移走产物;
(5)海底压强大,CO2的溶解度将大大增加,且可以液体的形式存在,根据反应:CO2+H2OH2CO3,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-,H2CO3电离平衡向右移动,所以酸性增强,故答案为:根据反应:CO2+H2OH2CO3,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-电离平衡向右移动,所以酸性增强。
答案第1页,共2页
15
一、选择题(共16题)
1.2011年3月日本发生强震和海啸而发生核泄漏,泄漏出人工放射性碘131I,碘的质子数是53,则该人工放射性碘的核内中子数为( )
A.53 B.78 C.131 D.184
2.下列叙述正确的是:( )
A.1H2与2H2互为同素异形体 B.14C与14N质量数相同,互称同位素
C.6Li与7Li的性质相同 D.23Na与24Mg的中子数相同
3.硒(Se)是人体必需的微量元素,它的一种核素是Se,其质子数是
A.114 B.80 C.46 D.34
4.在物质结构研究的历史上,首先提出原子内有电子学说的科学家是
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
5.工业上可以利用氪的一种同位素进行测井探矿、无损探伤、检查管道泄漏等。这里的85是指
A.质子数 B.电子数 C.中子数 D.质量数
6.放射性核素H。下列说法不正确的是
A.H原子核外电子数是1 B.H原子核内中子数是3
C.可用质谱分辨H和H D.3H2O也具有放射性
7.可用于同位素示踪原子探究某些反应的反应机理,关于表示的含义错误的是
A.表示氧元素的一种同位素
B.表示氧元素的一种核素
C.质量数是18,原子序数是8,核内有10个质子
D.质量数是18,原子序数是8,核内有10个中子
8.下列物质组合中,不属于同素异形体的是
A.氧气和臭氧 B.双氧水和水
C.红磷和白磷 D.碳60(C60)和石墨
9.石墨烯制成的多功能聚合物复合材料、高强度多孔陶瓷材料,增强了复合材料的许多特殊性能。石墨烯原子结构如图所示。下列有关石墨烯的说法中正确的是
A.是一种新型的化合物
B.是碳元素的一种核素
C.与金刚石互为同素异形体
D.属于无机金属材料
10.水和重水(H2O)分别跟金属钾反应,若电子转移的数目相同时,下列化学量相等的是
①消耗水和重水质量②同温同压下生成气体的体积③生成气体的质量④参加反应的钾的物质的量
A.①③ B.②④ C.①④ D.②③
11.下列实验能达到预期目的的是
实验内容 实验目的
A 用蘸有新制氯水的玻璃棒,滴到干燥的pH试纸表面 检验氯水的pH值
B 稀盐酸和硅酸钠溶液反应,生成白色胶状沉淀 证明氯元素的非金属性强于硅元素
C 金属铝和氢氧化钠溶液反应生成氢气,但不与熔融氢氧化钠生成氢气 证明金属铝不与氢氧化钠反应
D 在电炉中,高温下焦炭将二氧化硅还原成粗品的硅单质 证明碳元素的非金属性强于硅元素
A.A B.B C.C D.D
12.关于,下列的叙述中,错误的是
A.质子数为11 B.电子数为11 C.中子数为12 D.质量数为12
13.下列实验能达到实验目的且符合操作要求的是
A.I可用于证明Cl2能否溶于水或与NaOH溶液反应
B.II可用于配制一定浓度的硫酸溶液
C.III可用于证明元素的非金属性:Cl>C>Si
D.IV可用于制备氢氧化亚铁并观察其颜色
14.中国女科学家吴健雄使用,证明了李政道和杨振宁提出的弱相互作用,关于下列说法正确的是
A.核电荷数为33 B.中子数与质子数之差为6
C.中子数为27 D.相对原子量为60
15.设NA为阿伏加德罗常数,下列说法正确的是
A.钠在空气中燃烧可生成多种氧化物,2.3g钠充分燃烧时转移电子为0.1NA
B.22.4L(标准状况)氮气中含有7NA个中子
C.18g NH中所含有的电子总数为11NA
D.0.5mol·L-1 的Na2SO4 溶液中Na+ 的个数为NA
16.有X、Y、Z、W四种短周期主族元素,它们在周期表中的位置如图所示,已知Y是地壳中含量最高的金属元素,则下列说法中正确的是( )
X
Y Z W
A.简单离子半径:Y>W
B.Y的最高价氧化物的水化物和X的最高价氧化物的水化物可反应
C.X的简单氢化物比Z的简单氢化物更稳定、沸点更高
D.非金属性:W>X
二、综合题(共6题)
17.钠、钾与水反应的实验如下图所示:
(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
18.摩擦剂是牙膏的主体成分,SiO2是一种常见的摩擦剂。
(1) 根据用途推测SiO2在水中的溶解性:_______(填“易溶”或“难溶”)。SiO2用途很广,请再写出另外的任一种用途:_______
(2)Si在元素周期表中的位置是_______。
(3)制备SiO2的方法如下:
①写出反应I的离子方程式_______。
②比较酸性强弱:H2SO4_______H2SiO3(填“>”或“<”)。
③下列事实能说明S的非金属性比Si强的有_______
A.常温下SO2是气体,SiO2是固体
B.H2SO3的酸性比H2SiO3强
C.H2S的热稳定性比SiH4强
D.S的最高价是+6,Si的最高价是+4
(4)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。锡的原子结构示意图如图。
下列说法不正确的是 _______(填序号)。
a.Sn元素的最高正化合价为+4 b.Sn的原子半径比Si大
c.Sn和Si均可以作半导体材料 d.Sn位于周期表的第五周期、第IVA族
19.钋(Po)是一种低熔点金属,极其稀有,毒性和放射性极强。回答下列问题:
(1)Po具有放射性,经衰变成稳定的铅,在衰变过程中释放一个He2+,Pb的原子核中质子数为____,中子数为____,Po元素能形成较稳定的+4价离子,wgPo4+含有的电子的物质的量为____;
(2)半衰期是指由大量原子组成的放射性样品中,放射性元素原子核有50%发生衰变所需的时间,已知Po的半衰期为138天,质量为64克的Po,经276天后,得到铅的质量为____。
20.已知O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大。回答下列问题:
(1)Lv在周期表中的位置是_________。
(2)下列有关性质的比较,能用元素周期律解释的是_________。
a.离子半径:Te2->Se2- b.热稳定性:H2O>H2S
c.熔、沸点:H2O>H2S d.酸性:H2SO4>H2SeO4
(3)从原子结构角度解释Se与S的最高价氧化物对应的水化物酸性不同的原因_________。
(4)实验室用如下方法制备H2S并进行性质验证。
①设计B装置的目的是证明_________,B中实验现象为_______________。
②实验中经检测发现C中溶液pH降低且出现黑色沉淀。C中反应的离子方程式是_______________。
③有同学根据“强酸制弱酸”原理认为装置A、C中两个反应相矛盾,认为C中不可能出现上述现象。该观点不正确的理由是_______________。
21.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是____________(填标号)。
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为___________、_______,制得等量H2所需能量较少的是_______。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=______%,反应平衡常数K=_____。(可用分数表示)
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的△H___0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____________ (填标号)
A.H2S B.CO2 C.COS D.N2
22.碳是一种极其重要的元素,工业上,生活中到处可见。
(1)碳原子核外有________种能量不同的电子,这些电子占据了______个纺锤形轨道。
(2)下列方法可以比较碳与硫的非金属性强弱的是__________
a.比较原子最外层电子数多少 b.比较其最高价氧化物对应水化物的酸性
c.比较气态氢化物的稳定性 d.比较单质的熔沸点高低
(3)煤的气化是煤高效洁净利用的方向之一。在一定温度下的某容积可变的密闭容器中 建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
a.体系的压强不再发生变化 b.v正(CO)=v逆(H2O)
c.生成n molCO的同时生成n mol H2 d.1mol H-H键断裂同时断裂2mol H-O键
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),则容器内气体的平均相对分子质量将______(填写不变、变小、变大、无法确定)。若工业上以此方法生产水煤气,提高产率的措施为____。(写出两条措施)
(5)空气中的CO2浓度增大,会导致温室效应,有人提出将CO2通过管道输送到海底,这可减缓空气中CO2浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。请你结合CO2的性质,从平衡角度分析酸性增强原因 _____________________。
试卷第1页,共3页
2
参考答案:
1.B
【详解】
在原子符号中,X为元素符号,A代表质量数,Z代表质子数,质量数=中子数+质子数。131I中的131表示的是碘原子的质量数,碘的质子数为53,则该碘原子的中子数为131-53=78,故选B。
2.D
【详解】
A.都是氢气单质,为同一种物质,不属于同素异形体,A错误;
B.质子数相同而中子数不同的两种核素互称同位素,选项中14C的质子数为6,14N的质子数为7,两种核素的质子数不同,故不能互称为同位素,B错误;
C.6Li和7Li的中子数不同,核电荷数相同,二者化学性质几乎相同,但物理性质稍有差异,C错误;
D.23Na有23-11=12个中子,24Mg有24-12=12个中子,二者中子数相同,D正确;
故选D。
3.D
【详解】
元素符号左上角表示质量数,左下角表示质子数,Se表示其质子数为34,质量数为80的核素,故选D。
4.C
【详解】
A.道尔顿提出近百代原子学说,他认为原子是微小的不可分割的实心球体,选项A错误;
B.卢度瑟福(汤姆生的学生)提出了带核的原子结构模型,选项B错误;
C.汤姆生发现了电子,提出“道葡萄干面包式”的原子结构模型,选项C正确;
D.波尔(卢瑟福的学生)引入量子论观点,提出电子在内一定轨道上运动的原子结构模型,选项D错误;
答案选C。
5.D
【详解】
的质量数为85,质子数为36,故选D。
6.B
【详解】
A.放射性核素 ,质量数是3,质子数是1,质子数等于核外电子数,所以核外电子数等于1,故A正确;
B.放射性核素,质量数是3,质子数是1,所以中子数等于3-1=2,故B错误;
C.质谱分析是根据质量分辨,和质量数不一样,可以分辨,故C正确;
D.是放射性核素,所以3H2O也具有放射性,故D正确;
故选B。
7.C
【详解】
A.表示氧元素的一种同位素,A正确;
B.表示氧元素的一种核素,B正确;
C.质量数是18,原子序数是8,核内有8个质子,C错误;
D.质量数是18,原子序数是8,核内有10个中子,D正确;
综上所述,正确答案为C。
8.B
【详解】
A.氧气和臭氧是O元素的两种不同性质的单质,二者互为同素异形体,A不符合题意;
B.双氧水和水是H、O两种元素形成的不同的化合物,二者不属于同素异形体,B符合题意;
C.红磷和白磷是P元素的两种不同性质的单质,二者互为同素异形体,C不符合题意;
D.碳60(C60)和石墨是C元素的两种不同性质的单质,二者互为同素异形体,D不符合题意;
故合理选项是B。
9.C
【详解】
A.石墨烯是碳元素形成的一种单质,不是新型的化合物,A错误;
B.石墨烯是碳元素形成的一种单质,不是碳元素的一种核素,B错误;
C.石墨烯是碳元素形成的一种单质,与金刚石互为同素异形体,C正确;
D.石墨烯是碳元素形成的一种单质,属于非金属单质,不属于无机金属材料,D错误;
答案选C。
10.B
【详解】
重水中含有D比H多了一个中子数,转移的电子总数相等,两反应中电子转移的电子的总物质的量相等,所以消耗的水和重水的物质的量相等,质量不相等,生成的气体的质量也不相等,但是生成的气体在相同条件下体积相等,参加反应的钾的物质的量也相等,所以答案为B。
11.C
【详解】
A. 新制氯水含有具有强氧化性的次氯酸,能将pH试纸漂白,不能用pH试纸测定新制氯水的pH,故A错误;
B. 盐酸不是Cl的最高价含氧酸,故不能证明氯元素的非金属性强于硅元素,故B错误;
C. 金属铝与氢氧化钠溶液可以发生反应,与干燥的氢氧化钠不反应,金属铝和NaOH溶液反应的实质是:铝先和NaOH溶液中的水反应生成氢氧化铝,然后氢氧化铝再跟氢氧化钠反应,生成偏铝酸钠和氢气,故C正确;
D. 高温下焦炭将二氧化硅还原成粗品的硅单质的反应中C充当的是还原剂,其还原性大于还原产物Si的还原性,不能证明碳元素的非金属性强于硅元素,故D错误。
综上所述,答案为C。
12.D
【详解】
的质子数为11,质量数为23,中子数=质量数-质子数=23-11=12,核外电子数=核内质子数=11,不正确的是D,故选D。
13.A
【详解】
A.若Cl2能溶于水或与NaOH溶液反应,则装置 I中气球膨胀,故选A;
B.不能在容量瓶中进行浓溶液的稀释,故不选B;
C.证明非金属性强弱需通过最高价含氧酸的酸性强弱,因此不能选用盐酸,应选用高氯酸,故不选C;
D.氢氧化亚铁易被氧化,制备氢氧化亚铁并观察其颜色,应把胶头滴管伸入硫酸亚铁溶液中,再挤压胶头滴入氢氧化钠溶液,故不选D;
故选:A。
14.B
【详解】
A.核电荷数=质子数=27,故A错误;
B.中子数=质量数-质子数=60-27=33,中子数与质子数之差为33-27=6,故B正确;
C.中子数=质量数-质子数=60-27=33,故C错误;
D.质量数是60,只能说Co的其中一个核素的相对原子质量近似为60,不能将60表示为Co元素的相对原子量,故D错误;
故选:B。
15.A
【详解】
A.钠在空气中燃烧可生成多种氧化物,反应中钠均失去1个电子,2.3g钠的物质的量是0.1mol,充分燃烧时转移电子为0.1NA,A正确;
B.22.4L(标准状况)氮气的物质的量是1mol,但该氮气中氮原子含有的中子数不确定,无法计算中子数,B错误;
C.18g NH的物质的量是1mol,铵根中含有10个电子,因此所含有的电子总数为10NA,C错误;
D.0.5mol·L-1的Na2SO4溶液的体积不确定,不能计算其中所含Na+的个数,D错误;答案选A。
16.D
【详解】
Y是地壳中含量最高的金属元素,应为Al元素,结合元素周期表的结构可知:X为C元素,Z为Si元素,W为S元素;
A.S2-核外比Al3+多一个电子层,则简单离子半径:S2->Al3+,故A错误;
B.Al元素的最高价氧化物的水化物为Al(OH)3, C元素的最高价氧化物的水化物为H2CO3,是弱酸,不能溶解Al(OH)3,故B错误;
C.C的非金属性比Si强,则C的简单CH4比Si的简单氢化物SiH4更稳定,但SiH4沸点比CH4高,故C错误;
D.硫酸的酸性比碳酸强,则S的非金属性比C强,即非金属性:W>X,故D正确;
故答案为D。
17. 浮在 熔化 变红 钾 钾 剧烈 2K+2H2O===2KOH+H2↑
【详解】
分析:钠、钾两种金属的密度都比水小,所以都浮在水面上;都能与水剧烈反应,放出大量的热,熔化成闪亮的小球,在水面上四处游动,产生嘶嘶的声音,且钾反应的剧烈程度大于钠;两种金属与水反应的生成物为强碱,均能使酚酞变红;据以上分析解答。
详解:(1)①钠、钾均属于活泼金属,都能与水剧烈反应,二者密度都比水小,所以都浮在水面上;正确答案:浮在。
②钠、钾均属于活泼金属,都能与水剧烈反应,放出大量的热,两种金属熔点低,都熔化成闪亮的小球;正确答案:熔化。
⑤钠、钾均属于活泼金属,都能与水剧烈反应,生成强碱氢氧化钠和氢氧化钾,反应后的溶液使酚酞变红;正确答案:变红。
(2)金属钾活泼性大于钠,因此钾与水反应剧烈反应,浮在水面上,融化成闪亮的小球,有轻微的爆鸣声,并很快燃烧起来;正确答案:钾。
(3)通过实验可知,金属钾的活性大于钠,所以钾更易与水反应,且反应更钾剧烈;正确答案:钾;剧烈。
(4)钾与水反应生成氢氧化钾和氢气,化学方程式是:2K+2H2O===2KOH+H2↑;正确答案:2K+2H2O===2KOH+H2↑。
18. 难容 制造玻璃 第三周期第ⅣA族 > 2H++SiO= H2SiO3↓ C c
【详解】
(1) SiO2是一种常见的摩擦剂,在牙膏中乙固体形式存在,根据用途推测SiO2在水中难溶。SiO2用途很广低纯度的二氧化硅可做玻璃,二氧化硅是制造玻璃、石英玻璃、水玻璃、光导纤维电子工业的重要部件,光学仪器工艺品和耐火材料的原件是科学研究的重要的材料。
(2)Si是第14号元素,原子核外有三层电子,,最外层电子数为4,Si在元素周期表中的位置是第三周期第ⅣA族。
(3)①硅酸钠与硫酸反应生成硅酸沉淀,离子方程式:2H++SiO= H2SiO3↓。
②根据①可知强酸制取弱酸,②中H2SO4酸性强于H2SiO3。
③A.常温下SO2是气体,SiO2是固体,为物理性质不能比较非金属性,故A错误;
B.非金属性越强最高价氧化物对应的水化合物酸性越强,H2SO3的酸性比H2SiO3强,所以不能作比较,故B错误;
C.H2S的热稳定性比SiH4强,气态氢化物热稳定性越强,非金属性越强,故C正确;
D.S的最高价是+6,Si的最高价是+4,不为同周期,也不为同主族,故不能比较,故D错误;
故选C。
(4)a.Sn为主族元素,主族元素的最高正化合价等于其族序数,S'n为第IVA族元素,因此Sn的最高正化合价为+4价,故a正确;
b.同一主族元素原子从上到下原子半径逐渐增大,因此Sn的原子半径大于Si,故b正确;
c.Sn为金属元素,可以导电,Sn不是半导体,Si为非金属元素,也可以导电,Si是半导体,故c错误;
d.Sn位于周期表的第五周期、第IVA族,故d正确;
故选c。
19. 82 124 mol 47.09g
【详解】
(1)Po的质子数是84,它释放出的2+的质子数是2,所以Pb的质子数=84-2=82;Po的中子数是210-84=126,它释放出的2+的中子数=4-2=2,所以Pb的中子数=126-2=124;的质量数为210,所以Po的摩尔质量数值为210,质量为Wg的Po的物质的量为mol,一个Po原子含的电子数为84,一个Po4+离子含的电子数为84-4=80,所以Wg所含的电子的物质的量为mol×80=mol;
(2)经过第一个半衰期生成的Pb的物质的量为×50%mol,剩余的Po的物质的量为×50%mol;再经过第二个半衰期生成的Pb的物质的量为×50%×50%mol,所以经过276天所得Pb的质量为(×50%+×50%×50%)×206g/mol=47.09g。
20. 第七(或7)周期VIA族 abd Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4 H2S具有还原性 出现淡黄色(或乳白色)沉淀(或浑浊) Cu2++H2S==CuS↓+2H+ 该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质
【详解】
(1) O、S、Se、Te、Po、Lv是同主族元素,都是氧族元素,位于第VIA族,O、S、Se、Te、Po、Lv是同主族元素,其原子序数依次增大,因此Lv位于第七(或7)周期,在周期表中的位置为,故答案为:第七(或7)周期VIA族;
(2)a.同一主族元素,从上到下,离子半径逐渐增大,因此离子半径:Te2->Se2-,能用元素周期律解释,故a选;b.同一主族元素,从上到下,非金属性逐渐减弱,氢化物的稳定性减弱,因此热稳定性:H2O>H2S,能用元素周期律解释,故b选;c.物质的熔沸点是物理性质,不能用元素周期律解释,故c不选;d.同一主族元素,从上到下,非金属性逐渐减弱,最高价含氧酸的酸性减弱,因此酸性:H2SO4>H2SeO4,能用元素周期律解释,故d选;故答案为:abd;
(3)Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4,故答案为:Se与S是同主族元素,Se比S电子层数多、半径大,吸引电子能力弱,非金属性弱,故H2SeO4酸性弱于H2SO4;
(4)①双氧水具有较强的氧化性,H2S具有还原性,能够被双氧水氧化生成硫单质沉淀,故答案为:H2S具有还原性;出现淡黄色沉淀;
②硫化氢能够与硫酸铜反应生成黑色不溶于硫酸的CuS沉淀,反应的离子方程式为Cu2++H2S==CuS↓+2H+,故答案为:Cu2++H2S==CuS↓+2H+;
③根据“强酸制弱酸”的原理,装置A中硫化亚铁与硫酸反应生成硫化氢,因为硫化亚铁能够被硫酸溶解,C中发生Cu2++H2S==CuS↓+2H+,是因为生成的硫化铜不能溶于硫酸,因此该反应能够发生,故答案为:该反应发生的原因是生成了难溶的CuS沉淀,不是因为生成弱电解质。
21. B H2O(l)=H2(g)+1/2O2(g) △H=+286 kJ/mol H2S(l)=H2(g)+S(s) △H=+20 kJ/mol 系统Ⅱ 2.5 或2.8×10-3 > > B
【详解】
(1)A. 将Cl2通入Na2S溶液中,有黄色浑浊出现,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,A项正确;
B. 次氯酸不是最高价氧化物对应的水化物,不能作为非金属性判断的依据,B项错误;
C. 氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,C项正确;
D. 还原性:H2S>HCl,说明氯气的氧化性大于硫,即非金属性比较:Cl2>S,D项正确;
答案选B;
(2)①H2SO4(aq)=SO2(g)+H2O(l)+O2(g) △H1=+327 kJ/mol
②SO2(g)+I2(s)+ 2H2O(l)=2HI(aq)+ H2SO4(aq) △H2=-151 kJ/mol
③2HI(aq)= H2 (g)+ I2(s) △H3=+110 kJ/mol
④H2S(g)+ H2SO4(aq)=S(s)+SO2(g)+ 2H2O(l) △H4=+61 kJ/mol
①+②+③,整理可得系统(I)的热化学方程式H2O(l)=H2(g)+O2(g) △H=+286 kJ/mol;
②+③+④,整理可得系统(II)的热化学方程式H2S (g)=H2(g)+S(s) △H=+20 kJ/mol。
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II。
(3)依据题意列出“三段式”如下:
水的物质的量分数为 =0.02
解得x=0.01
①α1=×100%=2.5%,K= =2.8×10-3,故答案为2.5;或2.8×10-3;
②升温,水的物质的量分数升高,说明升温时平衡正移,则α2>α1,ΔH>0,故答案为>;>;
③A.通入H2S,平衡虽正向移动,但H2S的转化率减小,A项错误;
B.通入CO2,平衡正向移动,H2S转化率增大,B项正确;
C.通入COS,增大生成物浓度,平衡逆向移动,H2S转化率减小,C项错误;
D.通入N2,平衡不移动,H2S转化率不变,D项错误;
答案选B。
22. 3 2 b bd 变大 适当提高反应温度、及时移走产物 海底压强大,CO2的溶解度将大大增加,且可以液体的形式存在,根据反应:CO2+H2OH2CO3 ,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-,H2CO3电离平衡向右移动,所以酸性增强
【详解】
(1)碳的电子排布式为1s22s22p2,所以有3种能量不同的电子,纺锤形轨道p上有2个电子,所以有2个纺锤形轨道,故答案为:3;2;
(2)根据硫酸可以和可溶性的碳酸盐反应可以知道硫酸酸性强于碳酸,而元素的最高价氧化物对应的水化物的酸性越强说明该元素的非金属性越强,答案选b;
(3)a.体系的压强一直不发生变化,选项a错误;
b.v正(CO)=v正(H2O)=v逆(H2O),选项b正确;
c.生成n molCO的同时生成n mol H2,未体现正与逆的关系,选项c错误;
d.1mol H-H键断裂等效于,形成2mol H-O键,同时断裂2mol H-O键,选项d正确;
答案选bd;
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),所以我们可以看从开始反应向右反应过程中平均相对分子质量是一个水分解为一个CO和H2是减少的,则加压是从右向左反应,显然是增大,故答案为:变大;
正反应是吸热反应,可采取适当提高反应温度,或及时移走产物,故答案为:可采取适当提高反应温度、及时移走产物;
(5)海底压强大,CO2的溶解度将大大增加,且可以液体的形式存在,根据反应:CO2+H2OH2CO3,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-,H2CO3电离平衡向右移动,所以酸性增强,故答案为:根据反应:CO2+H2OH2CO3,与水反应程度增大,平衡往右移动,生成碳酸增多,根据H2CO3H++HCO3-电离平衡向右移动,所以酸性增强。
答案第1页,共2页
15
