人教版九年级化学下册 第十单元 课题1(第二课时)、课题2同步训练(WORD版,含答案)
文档属性
| 名称 | 人教版九年级化学下册 第十单元 课题1(第二课时)、课题2同步训练(WORD版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 193.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 11:47:03 | ||
图片预览

文档简介
第十单元课题1(第二课时)、课题2同步训练
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Ca-40
基础不倒翁(基础题)
一、选择题(共15分)
1.冬春季节,园林工人会给许多树的树干刷一段石灰浆,下列有关说法正确的是( )
A.石灰浆属于溶液
B.石灰浆的主要成分是CaO
C.石灰浆可以防止树木上的害虫生卵
D.一段时间后树干上的白色物质是Ca(OH)2
2.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用 B.都能解离出氢氧根离子
C.都能解离出金属阳离子 D.都含有氢元素和氧元素
3.中和反应在生活中有广泛应用。下列应用不属于中和反应的是( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
4.某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程见下图。下图所加试剂①②③分别是( )
A.稀NaOH溶液、石蕊溶液、稀盐酸 B.稀盐酸、石蕊溶液、稀NaOH溶液
C.稀NaOH溶液、酚酞溶液、稀盐酸 D.稀盐酸、酚酞溶液、稀NaOH溶液
5.某化学课外活动小组开展下列实验活动,取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17:05 17:10 17:15 17:20 17:25 17:30 17:35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
二、填空题(共44分)
6.(10分)二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳_________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为(用化学方程式表示)_________。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有_________,利用其与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强_________(“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为_________。
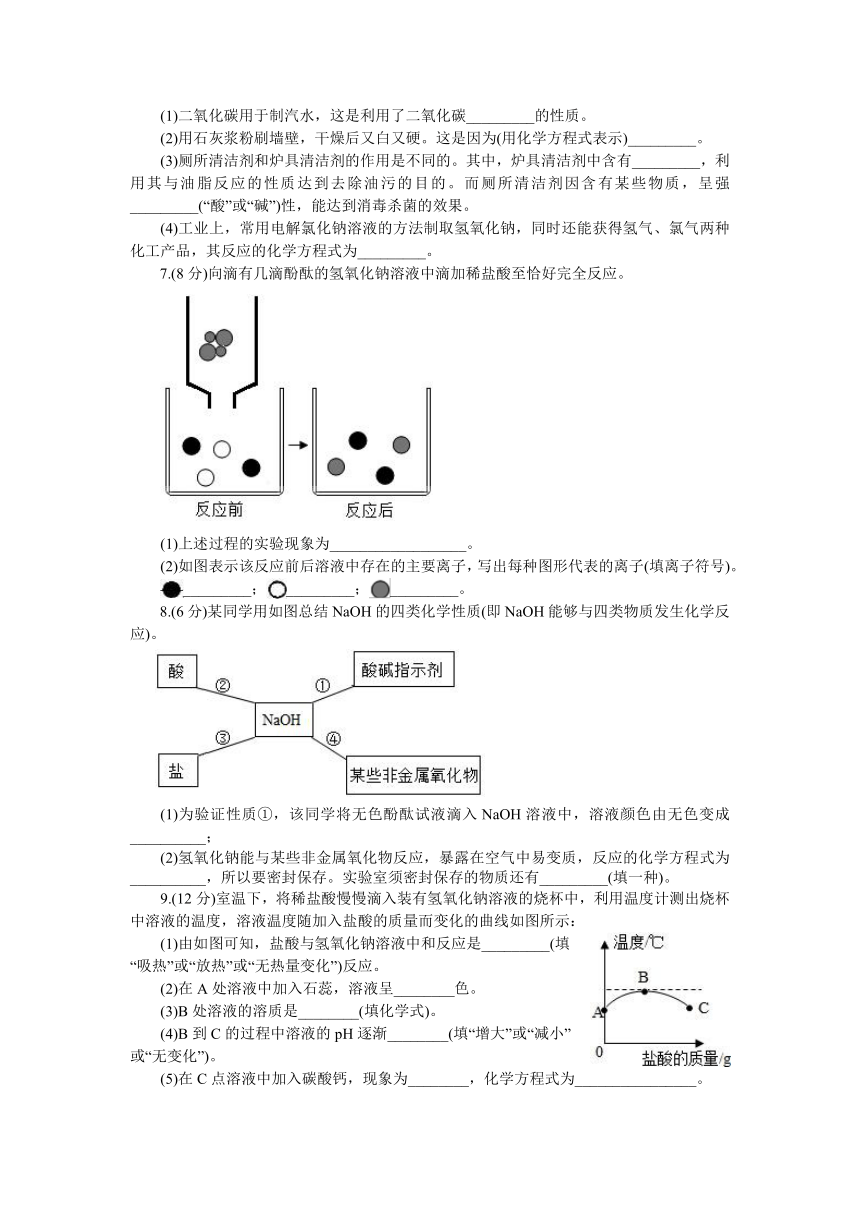
7.(8分)向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为__________________。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子(填离子符号)。
_________;_________;_________。
8.(6分)某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成__________;
(2)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为__________,所以要密封保存。实验室须密封保存的物质还有_________(填一种)。
9.(12分)室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是_________(填“吸热”或“放热”或“无热量变化”)反应。
(2)在A处溶液中加入石蕊,溶液呈________色。
(3)B处溶液的溶质是________(填化学式)。
(4)B到C的过程中溶液的pH逐渐________(填“增大”或“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为________,化学方程式为________________。
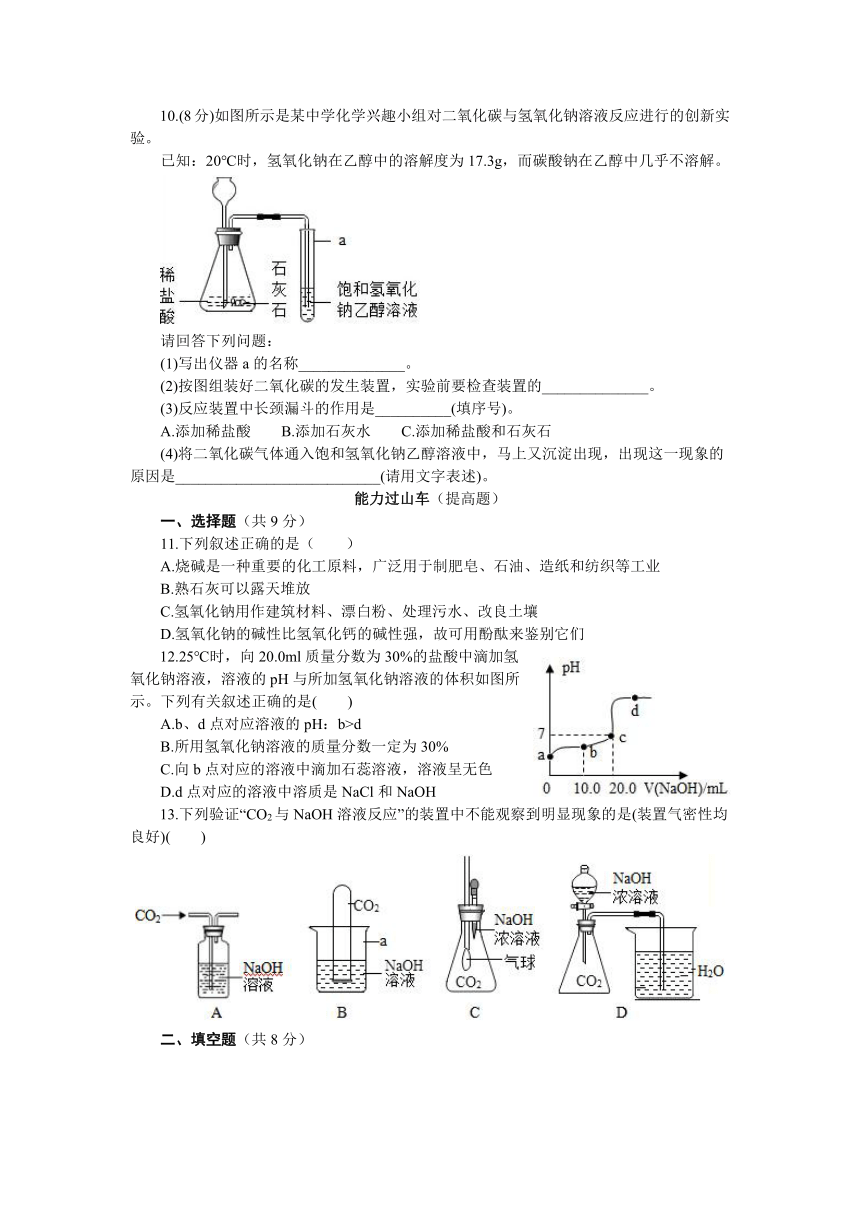
10.(8分)如图所示是某中学化学兴趣小组对二氧化碳与氢氧化钠溶液反应进行的创新实验。
已知:20℃时,氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解。
请回答下列问题:
(1)写出仪器a的名称______________。
(2)按图组装好二氧化碳的发生装置,实验前要检查装置的______________。
(3)反应装置中长颈漏斗的作用是__________(填序号)。
A.添加稀盐酸 B.添加石灰水 C.添加稀盐酸和石灰石
(4)将二氧化碳气体通入饱和氢氧化钠乙醇溶液中,马上又沉淀出现,出现这一现象的原因是___________________________(请用文字表述)。
能力过山车(提高题)
一、选择题(共9分)
11.下列叙述正确的是( )
A.烧碱是一种重要的化工原料,广泛用于制肥皂、石油、造纸和纺织等工业
B.熟石灰可以露天堆放
C.氢氧化钠用作建筑材料、漂白粉、处理污水、改良土壤
D.氢氧化钠的碱性比氢氧化钙的碱性强,故可用酚酞来鉴别它们
12.25℃时,向20.0ml质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是( )
A.b、d点对应溶液的pH:b>d
B.所用氢氧化钠溶液的质量分数一定为30%
C.向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D.d点对应的溶液中溶质是NaCl和NaOH
13.下列验证“CO2与NaOH溶液反应”的装置中不能观察到明显现象的是(装置气密性均良好)( )
二、填空题(共8分)
14.中和反应是一类重要的化学反应。某同学利用如图1装置研究稀盐酸与氢氧化钠液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为_____________________________________;
(2)仪器A中溶液的溶质是_________________(填化学式);
(3)图3中V的数值最接近_______(填“6”、“12”或“16”);
(4)下列说法错误的是____________。
A.图2中b点所示溶液中的溶质是NaCl和NaOH;
B.取图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加;
D.图3中e→f变化趋势可说明该反应是放热反应
三、实验探究题(共14分)
15.在学习“常见的碱”内容时,某化学兴趣小组在实验室发现一瓶标有澄清石灰水的试剂瓶底有一些白色固体物质。课后同学们对这瓶石灰水是否变质进行了探究。
【提出猜想】甲同学认为:石灰水完全变质
乙同学认为:石灰水部分变质;
丙同学认为:________________。
【实验方案】
实验 现象 结论
甲的探究 从试剂瓶中取适量清液于试管中,向其中通入CO2气体 ______________ 甲的猜想正确
乙的探究 实验一:从试剂瓶中取适量清液于试管中,向其中滴加酚酞试液 ______________ 乙的猜想正确
实验二:____________________________ ______________
【分析与讨论】大家通过分析和讨论认为:如果丙同学的猜想也正确,则瓶底的白色固体物质是______________(填化学式),其产生的原因是____________________________。
四、计算题(共10分)
16.近日,某地一辆满载浓硫酸的槽罐车翻倒,导致溶质质量分数为98%的浓硫酸30t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请计算:
(1)溶质质量分数为98%的浓硫酸20t中含H2SO4的质量是_____________;
(2)中和泄漏的98%浓硫酸30t,理论上需要氢氧化钙的质量。
参考答案
1.C 解析 石灰浆是氢氧化钙的悬浊液,A错误;石灰浆的主要成分是氢氧化钙,其化学式为Ca(OH)2,B错误;石灰浆可以防止树木上的害虫生卵,C正确;氢氧化钙能吸收空气中的二氧化碳生成碳酸钙白色沉淀,所以一段时间后树干上的白色物质是CaCO3,D错误。
2.B 解析 碱是电离时产生的阴离子全部是氢氧根离子的化合物,因此碱的水溶液中都含有氢氧根离子,这也是碱具有通性的原因。
3.A 解析 用盐酸除铁锈,该反应的反应物是金属氧化物和酸,不是酸与碱生成盐和水的反应,不属于中和反应,A正确;服用含氢氧化镁的药物治疗胃酸过多,氢氧化镁与盐酸反应生成氯化镁和水,该反应是酸与碱反应生成盐和水的反应,属于中和反应,B错误;用熟石灰改良酸性土壤,熟石灰与酸反应生成盐和水,属于中和反应,C错误;用硫酸处理印染厂含碱废水,硫酸与碱反应生成盐和水,是酸和碱的反应,属于中和反应,D错误。
4.C 解析 通过分析实验过程图可看出,试剂①遇到试剂②溶液变红色,再滴入试剂③后,溶液又变为无色,对照所给选项,C选项符合题意,因为酚酞遇到碱性的氢氧化钠溶液会变红色,再滴入盐酸后,氢氧化钠溶液与盐酸反应,生成中性的氯化钠溶液,溶液又变为无色。
5.D 解析 在测定期间,pH逐渐减小,雨水的酸性逐渐增强,A错误;酸雨对农作物的生长有害,B错误;由表中数据可知,17:30以后,pH不再变化,若在17:40测定,pH不一定小于4.85,C错误;上述雨水呈酸性的主要原因是溶解了酸性气体二氧化硫,pH=4.95与某些工厂排放的酸性气体有关,D正确。
6.(1)能溶于水 (2)CO2+Ca(OH)2=CaCO3↓+H2O (3)氢氧化钠 酸 (4)2NaCl+2H2O通电2NaOH+H2↑+Cl2↑
7.(1)溶液由红色变为无色 (2)Na+ OH- Cl-
8.(1)红色 (2)2NaOH+CO2=Na2CO3+H2O 浓硫酸(或浓盐酸;氢氧化钙;生石灰等)(合理即可)
9.(1)放热 (2)蓝 (3)NaCl (4)减小 (5)有气泡产生 CaCO3+2HCl=CaCl2+H2O +CO2↑
10.(1)试管 (2)气密性 (3)A (4)20℃时氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解
11.A 解析 烧碱是一种重要的化工原料,广泛用于制肥皂、石油、造纸和纺织等工业,A正确;熟石灰能与空气中的二氧化碳反应生成碳酸钙和水,不能露天堆放,故选项说法B错误;氢氧化钠具有强烈的腐蚀性,不能用作建筑材料、改良土壤,C错误;氢氧化钠的碱性比氢氧化钙的碱性强,但均显碱性,均显碱性,均能使酚酞溶液变红色,不能鉴别,D错误。
12.D 解析 由图可知,b点所示溶液的pH<7,d点溶液所示的pH>7,所以b、d点对应溶液的pH:b<d, A错误;由化学方程式可知:
HCl + NaOH = NaCl +H2O
36.5 40
由于题干中没有提及两种溶液的密度,所以无法确定所需氢氧化钠溶液的溶质质量分数,B错误;b点所示溶液的pH<7,溶液显酸性,滴加紫色的石蕊溶液变红色,C错误;d点所示溶液的pH>7,所示溶液的溶质既有酸碱中和生成的氯化钠,还有过量的氢氧化钠,D正确。
13.A 解析 A中通入二氧化碳时,虽然氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,但是无明显现象;B实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致试管中气压减小,从而导致液体在试管中上升;C实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致气球膨胀;D实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致烧杯中的水流入锥形瓶中。
14.(1)NaOH+HCl=NaCl+H2O (2)HCl (3)12 (4)C
15.【提出猜想】石灰水没有变质
【实验方案】石灰水没有变浑浊 酚酞试液变红色 取少量白色固体,滴加稀盐酸 有气泡产生
【分析与讨论】Ca(OH)2 Ca(OH)2的溶解度随温度的升高而减小,有一部分氢氧化钙析出
16.(6分)(1)20t质量分数为98%的浓硫酸中硫酸的质量=30t×98%=29.4t;
(2)解:设理论上需要氢氧化钙的质量为x。
H2SO4+Ca(OH)2=CaSO4+2H2O
98 74
29.4t x
98﹕74=29.4t﹕x
解得,x=22.2t
答:(1)98%的浓硫酸20t中含H2SO4的质量为29.4t;(2)中和泄漏的硫酸理论上需要氢氧化钙的质量为22.2t。
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Ca-40
基础不倒翁(基础题)
一、选择题(共15分)
1.冬春季节,园林工人会给许多树的树干刷一段石灰浆,下列有关说法正确的是( )
A.石灰浆属于溶液
B.石灰浆的主要成分是CaO
C.石灰浆可以防止树木上的害虫生卵
D.一段时间后树干上的白色物质是Ca(OH)2
2.氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能与指示剂作用 B.都能解离出氢氧根离子
C.都能解离出金属阳离子 D.都含有氢元素和氧元素
3.中和反应在生活中有广泛应用。下列应用不属于中和反应的是( )
A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多
C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
4.某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程见下图。下图所加试剂①②③分别是( )
A.稀NaOH溶液、石蕊溶液、稀盐酸 B.稀盐酸、石蕊溶液、稀NaOH溶液
C.稀NaOH溶液、酚酞溶液、稀盐酸 D.稀盐酸、酚酞溶液、稀NaOH溶液
5.某化学课外活动小组开展下列实验活动,取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17:05 17:10 17:15 17:20 17:25 17:30 17:35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
二、填空题(共44分)
6.(10分)二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳_________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为(用化学方程式表示)_________。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有_________,利用其与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强_________(“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为_________。
7.(8分)向滴有几滴酚酞的氢氧化钠溶液中滴加稀盐酸至恰好完全反应。
(1)上述过程的实验现象为__________________。
(2)如图表示该反应前后溶液中存在的主要离子,写出每种图形代表的离子(填离子符号)。
_________;_________;_________。
8.(6分)某同学用如图总结NaOH的四类化学性质(即NaOH能够与四类物质发生化学反应)。
(1)为验证性质①,该同学将无色酚酞试液滴入NaOH溶液中,溶液颜色由无色变成__________;
(2)氢氧化钠能与某些非金属氧化物反应,暴露在空气中易变质,反应的化学方程式为__________,所以要密封保存。实验室须密封保存的物质还有_________(填一种)。
9.(12分)室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图所示:
(1)由如图可知,盐酸与氢氧化钠溶液中和反应是_________(填“吸热”或“放热”或“无热量变化”)反应。
(2)在A处溶液中加入石蕊,溶液呈________色。
(3)B处溶液的溶质是________(填化学式)。
(4)B到C的过程中溶液的pH逐渐________(填“增大”或“减小”或“无变化”)。
(5)在C点溶液中加入碳酸钙,现象为________,化学方程式为________________。
10.(8分)如图所示是某中学化学兴趣小组对二氧化碳与氢氧化钠溶液反应进行的创新实验。
已知:20℃时,氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解。
请回答下列问题:
(1)写出仪器a的名称______________。
(2)按图组装好二氧化碳的发生装置,实验前要检查装置的______________。
(3)反应装置中长颈漏斗的作用是__________(填序号)。
A.添加稀盐酸 B.添加石灰水 C.添加稀盐酸和石灰石
(4)将二氧化碳气体通入饱和氢氧化钠乙醇溶液中,马上又沉淀出现,出现这一现象的原因是___________________________(请用文字表述)。
能力过山车(提高题)
一、选择题(共9分)
11.下列叙述正确的是( )
A.烧碱是一种重要的化工原料,广泛用于制肥皂、石油、造纸和纺织等工业
B.熟石灰可以露天堆放
C.氢氧化钠用作建筑材料、漂白粉、处理污水、改良土壤
D.氢氧化钠的碱性比氢氧化钙的碱性强,故可用酚酞来鉴别它们
12.25℃时,向20.0ml质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是( )
A.b、d点对应溶液的pH:b>d
B.所用氢氧化钠溶液的质量分数一定为30%
C.向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D.d点对应的溶液中溶质是NaCl和NaOH
13.下列验证“CO2与NaOH溶液反应”的装置中不能观察到明显现象的是(装置气密性均良好)( )
二、填空题(共8分)
14.中和反应是一类重要的化学反应。某同学利用如图1装置研究稀盐酸与氢氧化钠液反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为_____________________________________;
(2)仪器A中溶液的溶质是_________________(填化学式);
(3)图3中V的数值最接近_______(填“6”、“12”或“16”);
(4)下列说法错误的是____________。
A.图2中b点所示溶液中的溶质是NaCl和NaOH;
B.取图2中d点所示溶液加热蒸干所得固体为纯净物
C.图2中c→d所示溶液中NaCl的质量不断增加;
D.图3中e→f变化趋势可说明该反应是放热反应
三、实验探究题(共14分)
15.在学习“常见的碱”内容时,某化学兴趣小组在实验室发现一瓶标有澄清石灰水的试剂瓶底有一些白色固体物质。课后同学们对这瓶石灰水是否变质进行了探究。
【提出猜想】甲同学认为:石灰水完全变质
乙同学认为:石灰水部分变质;
丙同学认为:________________。
【实验方案】
实验 现象 结论
甲的探究 从试剂瓶中取适量清液于试管中,向其中通入CO2气体 ______________ 甲的猜想正确
乙的探究 实验一:从试剂瓶中取适量清液于试管中,向其中滴加酚酞试液 ______________ 乙的猜想正确
实验二:____________________________ ______________
【分析与讨论】大家通过分析和讨论认为:如果丙同学的猜想也正确,则瓶底的白色固体物质是______________(填化学式),其产生的原因是____________________________。
四、计算题(共10分)
16.近日,某地一辆满载浓硫酸的槽罐车翻倒,导致溶质质量分数为98%的浓硫酸30t泄漏,并向路基两边蔓延。接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请计算:
(1)溶质质量分数为98%的浓硫酸20t中含H2SO4的质量是_____________;
(2)中和泄漏的98%浓硫酸30t,理论上需要氢氧化钙的质量。
参考答案
1.C 解析 石灰浆是氢氧化钙的悬浊液,A错误;石灰浆的主要成分是氢氧化钙,其化学式为Ca(OH)2,B错误;石灰浆可以防止树木上的害虫生卵,C正确;氢氧化钙能吸收空气中的二氧化碳生成碳酸钙白色沉淀,所以一段时间后树干上的白色物质是CaCO3,D错误。
2.B 解析 碱是电离时产生的阴离子全部是氢氧根离子的化合物,因此碱的水溶液中都含有氢氧根离子,这也是碱具有通性的原因。
3.A 解析 用盐酸除铁锈,该反应的反应物是金属氧化物和酸,不是酸与碱生成盐和水的反应,不属于中和反应,A正确;服用含氢氧化镁的药物治疗胃酸过多,氢氧化镁与盐酸反应生成氯化镁和水,该反应是酸与碱反应生成盐和水的反应,属于中和反应,B错误;用熟石灰改良酸性土壤,熟石灰与酸反应生成盐和水,属于中和反应,C错误;用硫酸处理印染厂含碱废水,硫酸与碱反应生成盐和水,是酸和碱的反应,属于中和反应,D错误。
4.C 解析 通过分析实验过程图可看出,试剂①遇到试剂②溶液变红色,再滴入试剂③后,溶液又变为无色,对照所给选项,C选项符合题意,因为酚酞遇到碱性的氢氧化钠溶液会变红色,再滴入盐酸后,氢氧化钠溶液与盐酸反应,生成中性的氯化钠溶液,溶液又变为无色。
5.D 解析 在测定期间,pH逐渐减小,雨水的酸性逐渐增强,A错误;酸雨对农作物的生长有害,B错误;由表中数据可知,17:30以后,pH不再变化,若在17:40测定,pH不一定小于4.85,C错误;上述雨水呈酸性的主要原因是溶解了酸性气体二氧化硫,pH=4.95与某些工厂排放的酸性气体有关,D正确。
6.(1)能溶于水 (2)CO2+Ca(OH)2=CaCO3↓+H2O (3)氢氧化钠 酸 (4)2NaCl+2H2O通电2NaOH+H2↑+Cl2↑
7.(1)溶液由红色变为无色 (2)Na+ OH- Cl-
8.(1)红色 (2)2NaOH+CO2=Na2CO3+H2O 浓硫酸(或浓盐酸;氢氧化钙;生石灰等)(合理即可)
9.(1)放热 (2)蓝 (3)NaCl (4)减小 (5)有气泡产生 CaCO3+2HCl=CaCl2+H2O +CO2↑
10.(1)试管 (2)气密性 (3)A (4)20℃时氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解
11.A 解析 烧碱是一种重要的化工原料,广泛用于制肥皂、石油、造纸和纺织等工业,A正确;熟石灰能与空气中的二氧化碳反应生成碳酸钙和水,不能露天堆放,故选项说法B错误;氢氧化钠具有强烈的腐蚀性,不能用作建筑材料、改良土壤,C错误;氢氧化钠的碱性比氢氧化钙的碱性强,但均显碱性,均显碱性,均能使酚酞溶液变红色,不能鉴别,D错误。
12.D 解析 由图可知,b点所示溶液的pH<7,d点溶液所示的pH>7,所以b、d点对应溶液的pH:b<d, A错误;由化学方程式可知:
HCl + NaOH = NaCl +H2O
36.5 40
由于题干中没有提及两种溶液的密度,所以无法确定所需氢氧化钠溶液的溶质质量分数,B错误;b点所示溶液的pH<7,溶液显酸性,滴加紫色的石蕊溶液变红色,C错误;d点所示溶液的pH>7,所示溶液的溶质既有酸碱中和生成的氯化钠,还有过量的氢氧化钠,D正确。
13.A 解析 A中通入二氧化碳时,虽然氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,但是无明显现象;B实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致试管中气压减小,从而导致液体在试管中上升;C实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致气球膨胀;D实验过程中,由于二氧化碳和氢氧化钠溶液反应生成了碳酸钠和水,导致烧杯中的水流入锥形瓶中。
14.(1)NaOH+HCl=NaCl+H2O (2)HCl (3)12 (4)C
15.【提出猜想】石灰水没有变质
【实验方案】石灰水没有变浑浊 酚酞试液变红色 取少量白色固体,滴加稀盐酸 有气泡产生
【分析与讨论】Ca(OH)2 Ca(OH)2的溶解度随温度的升高而减小,有一部分氢氧化钙析出
16.(6分)(1)20t质量分数为98%的浓硫酸中硫酸的质量=30t×98%=29.4t;
(2)解:设理论上需要氢氧化钙的质量为x。
H2SO4+Ca(OH)2=CaSO4+2H2O
98 74
29.4t x
98﹕74=29.4t﹕x
解得,x=22.2t
答:(1)98%的浓硫酸20t中含H2SO4的质量为29.4t;(2)中和泄漏的硫酸理论上需要氢氧化钙的质量为22.2t。
同课章节目录
