1.3元素周期表的应用——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析)
文档属性
| 名称 | 1.3元素周期表的应用——课后训练2021~2022学年高一化学下学期鲁科版(2019)必修第二册(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 408.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-07 11:01:56 | ||
图片预览




文档简介
1.3元素周期表的应用
一、选择题(共16题)
1.现有下列5个转化,其中不可能通过一步反应实现的是
①SiO2→Na2SiO3 ②Si→SiO2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→NaOH
A.①② B.③④ C.②③④ D.②③④⑤
2.、为第三周期元素,最高正价与最低负价的代数和为6,二者形成的一种化合物能以的形式存在。下列说法错误的是
A.原子半径: B.简单氢化物的还原性:
C.同周期元素形成的单质中氧化性最强 D.最高价含氧酸的酸性:
3.下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
4.下列各组物质性质的比较,正确的是
A.酸性: B.碱性:
C.还原性: D.稳定性:
5.磷是第三周期ⅤA族元素,下列有关磷元素性质推测正确的是
A.原子半径比氮的大
B.最高化合价为+5价,PH3中磷的化合价为+3价
C.单质与氢气化合的反应条件比硫的更容易
D.最高价氧化物的水化物的酸性比氯的强
6.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是
A.质子数:c>b B.还原性X>W
C.氢化物的稳定性:H2Y>HZ D.离子半径:X+>Z-
7.有关元素周期表的说法中正确的是
A.元素周期表中第16列为第ⅥA族
B.第ⅠA族元素单质均能与水反应
C.同一周期的第ⅡA族和第ⅢA族元素原子序数的差值为1
D.0族元素的原子最外层电子数均为8,元素常见化合价为0
8.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
A.原子半径:X>Y>Z B.元素的非金属性:X<Y<Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:Z>Y>X
9.下列叙述错误的是
A.硅在自然界中主要以单质形式存在 B.硅是应用最为广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
10.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.b和c的最高价氧化物对应的水化物可以反应
D.a和b只能形成一种化合物
11.已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项 条件 结论
A 若原子半径:X>Y 原子序数:X<Y
B 化合物XnYm中X显负价 元素的非金属性:X>Y
C 若价电子数:X>Y 最高正价:X>Y
D 若X、Y最外层电子数分别为1、7 X、Y之间一定能形成离子键
A.A B.B C.C D.D
12.下列关于碳和硅的比较,正确的是
A.碳和硅在自然界中的存在形式都是既有游离态也有化合态
B.碳和硅的最高化合价都是+4价
C.硅元素在地壳中的含量占第二位,碳占第一位
D.硅与碳一样均含有两种常见价态的氧化物——和
13.由下列实验操作及现象所得的结论错误的是
实验操作及现象 结论
A 向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去 H2O2具有漂白性
B 将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊 碳被氧化成CO2
C 向Na2SiO3溶液中通入足量的CO2,产生白色胶状物质 非金属性:C>Si
D 向某溶液中先加入稀盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀 溶液中含有
A.A B.B C.C D.D
14.设计实验证明酸性强弱顺序:HCl> H2CO3>H2SiO3,下列说法中正确的是
A.装置A中的分液漏斗,使用时只需打开活塞
B.装置B中的药品为浓硫酸,作用是吸收挥发出的氯化氢
C.该实验设计原理为强酸制弱酸
D.该装置可以不设计尾气处理装置
15.A、B、C、D、E均为短周期元素且原子序数依次增大,其中A元素的某一同位素常用于考古时测定一些文物年代,B元素的原子最外层电子数是次外层电子数的3倍,含C元素的物质焰色试验火焰呈黄色,B与D同族,与某稀有气体具有相同的电子层结构。下列说法正确的是
A.简单离子半径:
B.氢化物稳定性:
C.B、C形成的化合物之一可用作供氧剂
D.最高价氧化物的水化物的酸性:
16.现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含有10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是
A.原子半径由小到大的顺序是WB.Z的最高价氧化物对应的水化物一定为强酸
C.化合物的沸点由高到低的顺序是乙>甲>丙
D.Y与W、Z都只能形成两种化合物
二、综合题
17.已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。回答下列问题:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,其中一种是含Y元素的无氧酸盐,则X在周期表中的位置是___________,甲发生分解反应的化学方程式是___________。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则:
①甲为___________(填化学式)。该气体能使酸性高锰酸钾溶液褪色,反应的离子方程式为___________。
②X、Y形成的简单离子的半径从大到小的顺序为___________(用离子符号表示)。
(3)若甲能与盐酸反应,生成无色无味的气体乙,则:
①乙的电子式为___________。
②在水中持续加热甲,生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___________。
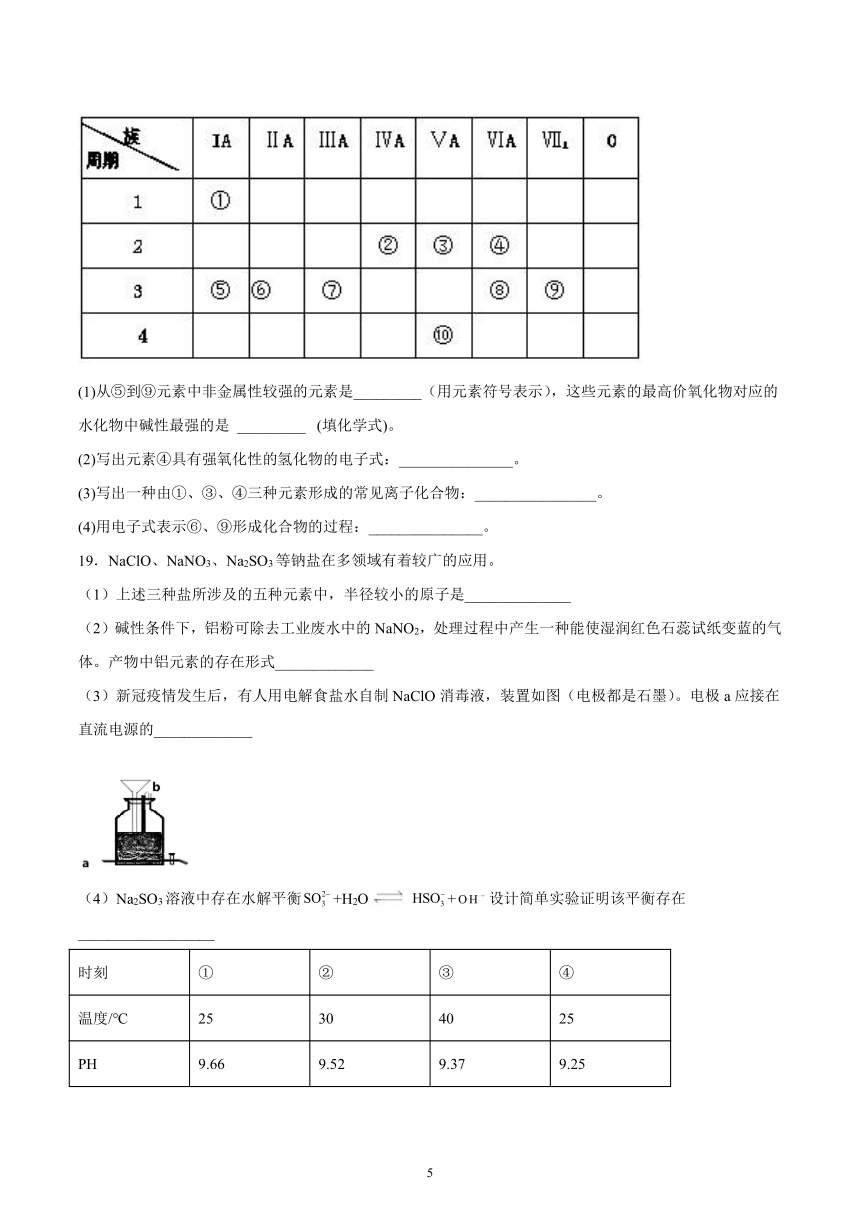
18.下表是元素周期表的一部分,回答下列有关问题:
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
19.NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________
(4)Na2SO3溶液中存在水解平衡+H2O+设计简单实验证明该平衡存在__________________
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
PH 9.66 9.52 9.37 9.25
升温过程中PH减小的原因是_____________
20.下表标出的是元素周期表的一部分元素,回答下列问题:
1
2 A B C
3 D E F G H I J K
4 M
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
21.按要求填空。
(1)有下列10种物质:①氢氧化钠固体②铜片③氯化氢气体④稀硫酸⑤干冰⑥空气⑦碳酸钠粉末⑧蔗糖晶体⑨熔融氯化钠⑩KAl(SO4)2·12H2O晶体(用编号填空)
i.属于混合物的是___________;
ii.属于电解质的是___________;
iii.上述状态下可导电的是___________。
(2)分别取0.2mol金属钠、铁、铝分别投入100mL0.1mol/L盐酸中,在标准状况下产生氢气体积大小的顺序是___________(用“>”或“=”连接Na、Fe、Al即可)。
(3)某玻璃厂生成普通玻璃,其组成为(质量分数):SiO275.3%,CaO11.7%,Na2O13%,则以氧化物的形式表示该玻璃的化学式为___________。
22.高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 SiO2 MgO Na2O K2O Fe2O3
质量分数/% 59.20 38.80 0.25 0.50 0.8
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
23.Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
24.近年来我国航天事业飞速发展,请回答下列问题:
(1)嫦娥五号返回器携带月壤着陆,月壤含有,请用氧化物表示该物质_______。
(2)铜与浓硫酸共热反应的化学方程式___________。
(3)神舟十二号全面使用国产芯片,其中制作芯片刻蚀液为硝酸与氢氟酸的混合溶液,其工艺涉及的反应为:
①配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目___________;
②该反应中表现的性质:_______,氧化剂与还原剂的物质的量之比为:_______;
③反应中转移0.3mol电子时生成标准状况下的NO_______L,将生成的NO完全转化为需要的物质的量为:_____。
试卷第1页,共3页
8
参考答案:
1.B
【详解】
①SiO2与氢氧化钠溶液反应可生成Na2SiO3;
②Si与氧气反应能生成SiO2;
③SiO2先与氢氧化钠溶液反应生成Na2SiO3和H2O,Na2SiO3再与酸反应可生成H2SiO3;
④CuO先与酸反应可得到铜盐,铜盐再与碱溶液反应可生成Cu(OH)2;
⑤Na2O2与水反应可生成NaOH;
综上所述,③④不能一步反应,答案选B。
2.A
【详解】
A.同一周期主族元素从左向右原子半径逐渐减小,则P的半径大于Cl,即X>Y,A错误;
B.X、Y对应的简单氢化物分别是PH3和HCl,元素非金属性越强,其简单氢化物越稳定,还原性越弱,非金属性:Cl>P,则简单氢化物的还原性:PH3>HCl,B正确;
C.同一周期主族元素从左向右,金属性减弱,非金属性增强,各元素对应的金属单质还原性减弱,非金属单质的氧化性增强,所以同周期中Cl2的氧化性最强,C正确;
D.元素非金属性越强,其最高价含氧酸的酸性越强,非金属性:Cl>P,则最高价含氧酸的酸性:HClO4>H3PO4,D正确;
答案选A。
3.D
【详解】
①离子核外电子层数越多,离子半径越大;当离子的电子层结构相同时,离子的核电荷数越大,离子半径就越小,所以粒子半径:S2->Cl->K+>Al3+,①错误;
②元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:F>Cl>S>P>Si,所以氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,②正确;
③元素的非金属性越强,其简单离子的还原性就越弱。元素的非金属性:Cl>Br>I>S,所以离子的还原性:S2->I->Br->Cl-,③错误;
④元素的非金属性越强,其单质的氧化性就越强。元素的非金属性:氧化性:Cl>S>Se>Te,所以单质的氧化性:Cl2>S>Se>Te,④正确;
⑤元素的非金属性越强,其最高价含氧酸的酸性就越强。元素的非金属性:Cl>S>P>C,所以酸性:HClO4>H2SO4>H3PO4>H2CO3,⑤错误;
⑥同一周期元素的原子序数越大,元素的非金属性越强;同一主族元素的原子序数越大,元素的非金属性就越弱,则元素的非金属性:O>N>P>Si,⑥正确;
⑦同一周期元素,原子序数越大,元素的金属性越弱;同一主族元素的原子序数越大,元素的金属性就越强,所以元素的金属性:Be<Mg<Ca<K,⑦正确;
综上所述可知:说法错误的是①③⑤,故合理选项是D。
4.A
【详解】
A.因为S的非金属性强于P,因此酸性:,A正确;
B.因为Ca的金属性强于Mg,因此碱性:,B错误;
C.非金属性:BrI,因此氧化性:Br2I2,还原性:,C错误;
D.非金属性:N弱于O,因此稳定性,D错误;
答案选A。
5.A
【详解】
A.同主族元素从上到下,原子半径增大,磷原子半径比氮的大,故A正确;
B.磷最高化合价为+5价,PH3中磷的化合价为-3价,故B错误;
C.非金属性:PD.同周期元素从左到右,最高价氧化物的水化物的酸性依次增强,酸性H3PO4选A。
6.B
【详解】
A.原子序数:Yc,A错误;
B.X和W位于同一周期,原子序数:XW,还原性:X>W,B正确;
C.Y和Z位于同一周期,原子序数:YD.X+和Z-电子层结构相同,X的原子序数大,则半径X+答案选B。
7.A
【详解】
A.元素周期表中共有18纵列,第18列为0族元素,依次向前推可知,第17列为VIIA族,第16列为ⅥA族,故A正确;
B.第ⅠA族元素形成的单质有氢气和金属单质(锂、钠、钾、铷、铯、钫等),金属单质与水均能发生反应,而氢气与水不反应,故B错误;
C.第三周期,第ⅡA族元素为Mg,原子序数为12,第ⅢA族元素为Al,原子序数为13,二者原子序数的差值为1,若为第四周期,第ⅡA族元素为Ca,原子序数为20,第ⅢA族元素为Ga,原子序数为31,二者原子序数的差值为11,若为第六周期,第ⅡA族元素为Ba,原子序数为56,第ⅢA族元素为Tl,原子序数为81,二者原子序数的差值为25,故C错误;
D.0族元素的原子最外层电子数不都是8,氦原子最外层有2个电子,故D错误;
故选A。
8.D
【详解】
同主族元素从上到下元素的非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱,酸性相对强弱顺序为:HXO4>HYO4>HZO4,可知非金属性X>Y>Z,原子序数XA.同主族元素,从上到下电子层数增多,原子半径逐渐增大,即X<Y<Z,故A错误;
B.最高价氧化物对应水化物的酸性是:HXO4>HYO4>HZO4,则非金属性X>Y>Z,故B错误;
C. 非金属性越强,气态氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:X>Y>Z,故C错误;
D. 由上述分析可知,原子序数:Z>Y>X,故D正确。
故选D。
9.A
【详解】
A.硅在自然界中主要以二氧化硅、硅酸盐形式存在,自然界没有游离态的硅,A错误;
B. 硅的导电性介于导体和绝缘体之间,良好的半导体材料,是应用最为广泛的半导体材料,B正确;
C.硅是良好的半导体材料,高纯度的硅可用于制造计算机芯片,C正确;
D. 二氧化硅、纯碱和石灰石可用于生产玻璃,D正确;
答案选A。
10.C
【详解】
A.31d和33d质子数相同,中子数不同,是不同的核素,故A错误;
B.非金属性a(O)>e(S)>d(P),故氢化物稳定性:a>e>d,故B错误;
C.b和c的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,故C正确;
D.a和b可形成Na2O和Na2O2,故D错误;
故选C。
11.B
【详解】
A.若XY处于同一主族,X原子半径X>Y,则原子序数:X>Y,故A错误;
B.化合物XnYm中X显负价,说明X吸引电子的能力大于Y,则元素的非金属性:X>Y,故B正确;
C.若价电子数X>Y,比如O>N,O一般没有正价,则最高正价:N>O,故C错误;
D.H原子最外层电子数是1,氯元素最外层电子数分别为7,二者形成共价化合物,不存在离子键,故D错误;
故选B。
12.B
【详解】
A.硅是一种亲氧元素,在自然界中主要以氧化物和硅酸盐的形式存在,只有化合态,没有游离态,碳元素在自然界中既有游离态又有化合态,A错误;
B.碳、硅元素的原子最外层都有4个电子,其最高化合价都是+4价,B正确;
C.氧元素在地壳中的含量占第一位,硅元素在地壳中的含量占第二位,C错误;
D.碳有两种常见氧化物——和,硅只有一种常见氧化物——,D错误;
故选B。
13.AB
【详解】
A.有机色质褪色为漂白,酸性KMnO4溶液和H2O2溶液发生氧化还原反应而使紫红色褪去,表明H2O2具有还原性, A错误;
B.红热的木炭与浓硫酸反应生成二.氧化碳、二氧化硫,均使石灰水变浑浊,由现象不能说明生成了二氧化碳,B错误;
C.向Na2SiO3溶液中通入足量的CO2,产生的白色胶状物质为硅酸,证明碳酸的酸性大于硅酸,则非金属性:C> Si,故C正确;
D.向某溶液中加入稀盐酸酸化,无明显现象,溶液中无Ag+,加入BaCl2溶液,产生白色沉淀,说明该沉淀是硫酸钡,原溶液中一定有,D正确;
故选AB。
14.CD
【详解】
A.装置A中的分液漏斗,使用时要想让液体流出,除去打开活塞外,还应打开瓶塞,A不正确;
B.为防止氯化氢对后续实验的干扰,装置B中的药品为饱和碳酸氢钠溶液,作用是吸收挥发出的氯化氢,B不正确;
C.该实验中,不管是用盐酸制取碳酸,还是用碳酸制取硅酸,设计原理都为强酸制弱酸,C正确;
D.该装置中,产生的尾气为CO2,对环境不造成污染,所以可以不设计尾气处理装置,D正确;
故选CD。
15.CD
【详解】
A.电子层结构相同的离子,质子数越多,半径越小,所以离子半径E(Cl-)<D(S2-),故A错误;
B.元素的非金属性越强,氢化物越稳定。同周期元素从左到右元素的非金属性逐渐增强,氢化物的稳定性逐渐增强。则氢化物的稳定性A(CH4)<B(H2O),故B错误;
C.B、C形成的化合物Na2O2能跟CO2以及水反应生成氧气,可用作供氧剂,故C正确;
D.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强。同周期元素从左到右元素的非金属性逐渐增强,最高价氧化物对应的水化物的酸性逐渐增强,所以酸性:HClO4>H2SO4,故D正确;
故选CD。
16.AC
【详解】
A.同周期主族元素从左到右,原子半径逐渐减小,则原子半径由小到大的顺序是WB.Z为C或N,其最高价氧化物对应的水化物为H2CO3或HNO3,HNO3属于强酸,而H2CO3是弱酸,B项错误;
C.化合物甲是HF,乙是H2O,丙是NH3或CH4,不论丙是NH3,还是CH4,化合物的沸点由高到低的顺序都是乙>甲>丙,C项正确;
D.O与H可形成H2O、H2O2,与C可形成CO、CO2,与N可形成NO、NO2、N2O5等多种氧化物,D项错误;
答案选AC。
17. 第四周期IA族 4KClO33KClO4+KCl CaSO3 5SO2+2+2H2O=4H++2Mn2++5 r(S2-)>r(Ca2+) MgCO3+H2OMg(OH)2+CO2↑
【详解】
(1) 常温下X的单质能与水反应,则X可能为Na或K或Ca。若X为Na,根据XYO3可知Y为N元素,则甲为NaNO3,NaNO3高温分解不可能产生两种盐;若X为K,根据化学式可知Y为Cl,甲为KClO3,其化合价为+5价,因为Cl的最高化合价为+7,最低为-1价,加热分解可生成两种盐,符合题意;若X为Ca则Y只能为S,甲为CaSO3,而CaSO3加热被氧化而不会生成两种盐,综上可知X为K元素,Y为Cl元素。K位于第四周期IA族;KClO3中Cl化合价为+5价,加热分解可生成两种盐,其一为无氧酸盐,则为KCl,根据氧化还原反应化合价有升有降,另一种产物必然为KClO4 ,高温分解的化学方程式为:4KClO33KClO4+KCl;
(2) ①甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,气体为SO2,可知甲中含,X元素一定为Ca,Y元素为S,即甲为CaSO3。SO2具有还原性,与KMnO4发生氧化还原反应,离子方程式为:5SO2+2+2H2O=4H++2Mn2++5;
②Ca2+和S2-电子层结构相同,当电子层结构相同时,原子序数大的粒子半径反而小,所以两种离子的半径大小为:r(S2-)>r(Ca2+);
(3) 若甲能与盐酸反应,生成无色无味的气体乙,则甲中含,乙为CO2,则Y为C元素,X为Mg。
①由上分析知乙为CO2,其电子式为。
②MgCO3微溶于水,电离出的Mg2+和CO32-能够发生水解,加热促使水解平衡正向移动,最终生成Mg(OH)2和CO2,化学方程式为:MgCO3+H2OMg(OH)2+CO2↑。
18. Cl NaOH NH4NO3或NH4NO2
【详解】
(1).同一周期中,由左向右非金属性逐渐增强,故⑨元素Cl非金属性最强;元素的金属性越强,它所对应的最高价氧化物的水化物的碱性就越强,所以①元素的氢氧化物NaOH碱性最强;
(2). 元素④为O元素,其具有强氧化性的氢化物H2O2,过氧化氢是共价化合物,各元素间共用电子对,电子式为:;
(3). ①、③、④分别为:H、N、O元素,常见的离子化合物为NH4NO3;
(4). ⑥、⑨分别为Mg和Cl元素,其形成的化合物为MgCl2,Mg失去两个电子,每个Cl原子得到一个电子,可表示为:。
点睛:高中化学中,离子化合物一般包括金属和氨与非金属形成的化合物,所涉及的酸都是共价化合物,硝酸为共价化合物。
19. O N 34.5 正 2NaCl+2H2O2NaOH+H2+Cl2,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
【详解】
(1)上述三种盐所涉及的五种元素中,Na、Cl、S有3个电子层,半径较大,O、 N有2个电子层,且O的质子数大于N,所以半径较小的原子是O;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,所以p亚层上电子自旋状态只有一种的元素是N;
(2)铝在碱性条件下,生成偏铝酸盐,产物中铝元素的存在形式是;铝粉除去工业废水中的NaNO2,反应方程式是,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
(3)a极氯离子失电子生成氯气,所以a极是阳极,应接在直流电源的正极;用石墨电极电解饱和食盐水生成氢氧化钠、氢气、氯气,氯气与氢氧化钠反应生成次氯酸钠,该装置中发生的化学方程式为2NaCl+2H2O2NaOH+H2+Cl2,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)该水解平衡的存在,Na2SO3使溶液显碱性,向溶液中滴加酚酞,发现变红,则证明该平衡的存在;水电离吸热,升高温度,水的电离平衡正向移动,Kw 变大,c(H+)增大,pH 变小; ①与④相比,温度相同,①的pH大于④,说明④中浓度减小,c ()①>④。
20. Ar Na Cl M HClO4 饱和NaHCO3 除去CO2中的HCl杂质 Na2SiO3 +CO2 +H2O = H2SiO3 ↓+ Na2CO3(生成NaHCO3也可)
【详解】
根据元素在周期表中的位置可知A是C,B是O,C是F,D是Na,E是Mg,F是Al,G是Si,H是P,I是S,J是Cl,K是Ar,M是Mn。则
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是稀有气体元素Ar,金属性最强的是Na;同周期自左向右原子半径逐渐减小,则除稀有气体外第三周期中原子半径最小的是Cl,属于过渡元素的是M;
(2)J的氢化物是共价化合物HCl,电子式为,氯元素的最高价是+7价,则最高价氧化物对应的水化物的化学式为HClO4;
(3)要比较元素C和Si的非金属性强弱,可以根据较强酸制备较弱酸判断,由于盐酸和大理石反应生成的二氧化碳中含有氯化氢会干扰实验,需要利用饱和碳酸氢钠溶液除去,即溶液B应该选用饱和NaHCO3溶液,作用是除去CO2中的HCl杂质,能说明C和Si非金属性强弱的化学方程式是Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。
21.(1) ④⑥ ①③⑦⑨⑩ ②④⑨
(2)Na>Fe=Al
(3)Na2O·CaO·6SiO2
【分析】
①氢氧化钠固体是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质;
②铜片是金属单质,属于能导电的纯净物,单质既不是电解质也不是非电解质;
③氯化氢气体是不能导电的纯净物,在水溶液中能电离出自由移动的离子,属于电解质;
④稀硫酸溶液中存在自由移动的离子,属于能导电的混合物,混合物既不是电解质也不是非电解质;
⑤干冰是不能电离出自由移动离子的非电解质,是不能导电的纯净物;
⑥空气是不能导电的混合物,混合物既不是电解质也不是非电解质;
⑦碳酸钠粉末是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质;
⑧蔗糖晶体是不能电离出自由移动离子的非电解质,是不能导电的纯净物;
⑨熔融氯化钠是含有能自由移动离子的化合物,属于能导电的纯净物,属于电解质;
⑩KAl(SO4)2·12H2O晶体是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质。
(1)
i.由分析可知,属于混合物的是④⑥,故答案为:④⑥;
ii.由分析可知,属于电解质的是①③⑦⑨⑩,故答案为:①③⑦⑨⑩;
iii.由分析可知,上述状态下可导电的是②④⑨,故答案为:②④⑨;
(2)
由金属与酸反应的方程式可知,金属R的金属化合价与生成氢气的关系式为:2R—nH2,则0.2mol金属钠、铁、铝分别投入100mL0.1mol/L盐酸时,盐酸不足量,但钠能与溶液中的水反应,而铁、铝不能与水反应,则金属钠反应生成氢气的物质的量为0.2mol×=0.1mol,铁、铝反应生成氢气的物质的量都为0.1mol/L×0.1L×=0.05mol,所以在标准状况下产生氢气体积大小的顺序是Na>Fe=Al,故答案为:Na>Fe=Al;
(3)
设普通玻璃的质量为100g,由氧化钠、氧化钙和二氧化硅的质量分数可得:n(Na2O):n(CaO):n(SiO 2)= ::≈1:1:6,则以氧化物的形式表示该玻璃的化学式为Na2O·CaO·6SiO2,故答案为:Na2O·CaO·6SiO2。
22. Na2O、K2O SiO2+2OH-=SiO32-+H2O MgO和Fe2O3 向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复操作2至3次 H2SiO3SiO2+H2O 坩埚钳、三脚架
【详解】
(1)根据分析,蛇纹石中含有的可溶性金属氧化物有Na2O和K2O,它们能与水反应生成氢氧化钠和氢氧化钾;
(2)二氧化硅属于酸性氧化物,可与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(3)氧化钠与氧化钾属于可溶性氧化物,氧化铝属于两性氧化物,二氧化硅属于酸性氧化物,上述四种物质都能溶解在氢氧化钠溶液中,氧化镁和氧化铁属于碱性氧化物且难溶于水,因此,滤渣A的成分有MgO和Fe2O3;
(4)步骤②生成沉淀的成分是硅酸,洗涤过滤出的沉淀的方法是:向过滤器中注入蒸馏水至浸没沉淀,待水自然流出后,重复上述操作两到三次;
(5)步骤③用灼烧的方法使硅酸分解生成二氧化硅,化学方程式为:H2SiO3SiO2+H2O,实验室灼烧固体时需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、坩埚钳和三脚架。
23. D C Li+核电荷数较大
【详解】
(1) 基态多电子原子的核外电子排布应该遵循能量最低原理,即一般按照能级顺序填充(1s<2s<2p)。因此能量最低的状态就是先排满1s,再排2s,即,能量最低的(基态)原子为D;2个电子排在2px上,1个电子排布在2s上,是四个选项中能量最高的状态,能量最高的原子是C。故填D;C;
(2) Li+与H-具有相同的电子构型,Li+核电荷数为3,H-核电荷数为1,电子结构相同时,核电荷数越大,原子核对核外电子的吸引能力越大,离子半径就越小。故答案为:Li+核电荷数较大。
24.(1)MgO·FeO·SiO2
(2)2H2SO4(浓)+CuCuSO4+2H2O+SO2↑
(3) 氧化性 4:3 2.24 0.075mol
【解析】
(1)
在MgFeSiO4中,镁显+2价,铁显+2价,硅显+4价,氧显-2价,则MgFeSiO4用氧化物表示的组成为MgO FeO SiO2;
(2)
在加热条件下,铜和浓硫酸反应生成二氧化硫,反应方程式为2H2SO4(浓)+CuCuSO4+2H2O+SO2↑;
(3)
①Si元素从0价升至+4价,N元素从+5降至+2价,由升降相等,含N的物质前配4,含Si物质前配3,结合原子守恒可配平化学方程式:3Si+4HNO3+18HF=3H2SiF6+4NO+8H2O,用双线桥表示为:;
②N元素的化合价由+5价降低为+3价,所以该反应中,HNO3仅作氧化剂,表选氧化性,Si元素化合价升高,Si做还原剂,则氧化剂与还原剂的物质的量之比为:4:3;
③转移12mol电子生成4molNO,转移0.3mol电子时生成0.1molNO,标准状况下的体积为V=nVm=0.1mol×22.4L/mol=2.24L,NO完全转化为的方程式为:4NO+3+2H2O=4HNO3,需要的物质的量为0.075mol。
答案第1页,共2页
一、选择题(共16题)
1.现有下列5个转化,其中不可能通过一步反应实现的是
①SiO2→Na2SiO3 ②Si→SiO2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→NaOH
A.①② B.③④ C.②③④ D.②③④⑤
2.、为第三周期元素,最高正价与最低负价的代数和为6,二者形成的一种化合物能以的形式存在。下列说法错误的是
A.原子半径: B.简单氢化物的还原性:
C.同周期元素形成的单质中氧化性最强 D.最高价含氧酸的酸性:
3.下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
4.下列各组物质性质的比较,正确的是
A.酸性: B.碱性:
C.还原性: D.稳定性:
5.磷是第三周期ⅤA族元素,下列有关磷元素性质推测正确的是
A.原子半径比氮的大
B.最高化合价为+5价,PH3中磷的化合价为+3价
C.单质与氢气化合的反应条件比硫的更容易
D.最高价氧化物的水化物的酸性比氯的强
6.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是
A.质子数:c>b B.还原性X>W
C.氢化物的稳定性:H2Y>HZ D.离子半径:X+>Z-
7.有关元素周期表的说法中正确的是
A.元素周期表中第16列为第ⅥA族
B.第ⅠA族元素单质均能与水反应
C.同一周期的第ⅡA族和第ⅢA族元素原子序数的差值为1
D.0族元素的原子最外层电子数均为8,元素常见化合价为0
8.X、Y、Z是同主族的三种元素,已知其最高价氧化物对应的水化物的酸性由强到弱的顺序是HXO4>HYO4>HZO4。则下列说法正确的是
A.原子半径:X>Y>Z B.元素的非金属性:X<Y<Z
C.气态氢化物稳定性:X<Y<Z D.原子序数:Z>Y>X
9.下列叙述错误的是
A.硅在自然界中主要以单质形式存在 B.硅是应用最为广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
10.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.b和c的最高价氧化物对应的水化物可以反应
D.a和b只能形成一种化合物
11.已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项 条件 结论
A 若原子半径:X>Y 原子序数:X<Y
B 化合物XnYm中X显负价 元素的非金属性:X>Y
C 若价电子数:X>Y 最高正价:X>Y
D 若X、Y最外层电子数分别为1、7 X、Y之间一定能形成离子键
A.A B.B C.C D.D
12.下列关于碳和硅的比较,正确的是
A.碳和硅在自然界中的存在形式都是既有游离态也有化合态
B.碳和硅的最高化合价都是+4价
C.硅元素在地壳中的含量占第二位,碳占第一位
D.硅与碳一样均含有两种常见价态的氧化物——和
13.由下列实验操作及现象所得的结论错误的是
实验操作及现象 结论
A 向酸性KMnO4溶液中滴加H2O2溶液,紫红色褪去 H2O2具有漂白性
B 将红热的炭放入浓硫酸中,产生的气体通入澄清石灰水,石灰水变浑浊 碳被氧化成CO2
C 向Na2SiO3溶液中通入足量的CO2,产生白色胶状物质 非金属性:C>Si
D 向某溶液中先加入稀盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀 溶液中含有
A.A B.B C.C D.D
14.设计实验证明酸性强弱顺序:HCl> H2CO3>H2SiO3,下列说法中正确的是
A.装置A中的分液漏斗,使用时只需打开活塞
B.装置B中的药品为浓硫酸,作用是吸收挥发出的氯化氢
C.该实验设计原理为强酸制弱酸
D.该装置可以不设计尾气处理装置
15.A、B、C、D、E均为短周期元素且原子序数依次增大,其中A元素的某一同位素常用于考古时测定一些文物年代,B元素的原子最外层电子数是次外层电子数的3倍,含C元素的物质焰色试验火焰呈黄色,B与D同族,与某稀有气体具有相同的电子层结构。下列说法正确的是
A.简单离子半径:
B.氢化物稳定性:
C.B、C形成的化合物之一可用作供氧剂
D.最高价氧化物的水化物的酸性:
16.现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含有10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是
A.原子半径由小到大的顺序是W
C.化合物的沸点由高到低的顺序是乙>甲>丙
D.Y与W、Z都只能形成两种化合物
二、综合题
17.已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。回答下列问题:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,其中一种是含Y元素的无氧酸盐,则X在周期表中的位置是___________,甲发生分解反应的化学方程式是___________。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则:
①甲为___________(填化学式)。该气体能使酸性高锰酸钾溶液褪色,反应的离子方程式为___________。
②X、Y形成的简单离子的半径从大到小的顺序为___________(用离子符号表示)。
(3)若甲能与盐酸反应,生成无色无味的气体乙,则:
①乙的电子式为___________。
②在水中持续加热甲,生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___________。
18.下表是元素周期表的一部分,回答下列有关问题:
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
19.NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________
(4)Na2SO3溶液中存在水解平衡+H2O+设计简单实验证明该平衡存在__________________
时刻 ① ② ③ ④
温度/℃ 25 30 40 25
PH 9.66 9.52 9.37 9.25
升温过程中PH减小的原因是_____________
20.下表标出的是元素周期表的一部分元素,回答下列问题:
1
2 A B C
3 D E F G H I J K
4 M
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
21.按要求填空。
(1)有下列10种物质:①氢氧化钠固体②铜片③氯化氢气体④稀硫酸⑤干冰⑥空气⑦碳酸钠粉末⑧蔗糖晶体⑨熔融氯化钠⑩KAl(SO4)2·12H2O晶体(用编号填空)
i.属于混合物的是___________;
ii.属于电解质的是___________;
iii.上述状态下可导电的是___________。
(2)分别取0.2mol金属钠、铁、铝分别投入100mL0.1mol/L盐酸中,在标准状况下产生氢气体积大小的顺序是___________(用“>”或“=”连接Na、Fe、Al即可)。
(3)某玻璃厂生成普通玻璃,其组成为(质量分数):SiO275.3%,CaO11.7%,Na2O13%,则以氧化物的形式表示该玻璃的化学式为___________。
22.高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 SiO2 MgO Na2O K2O Fe2O3
质量分数/% 59.20 38.80 0.25 0.50 0.8
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。
23.Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为__、__(填标号)。
A.
B.
C.
D.
(2)Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是___。
24.近年来我国航天事业飞速发展,请回答下列问题:
(1)嫦娥五号返回器携带月壤着陆,月壤含有,请用氧化物表示该物质_______。
(2)铜与浓硫酸共热反应的化学方程式___________。
(3)神舟十二号全面使用国产芯片,其中制作芯片刻蚀液为硝酸与氢氟酸的混合溶液,其工艺涉及的反应为:
①配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目___________;
②该反应中表现的性质:_______,氧化剂与还原剂的物质的量之比为:_______;
③反应中转移0.3mol电子时生成标准状况下的NO_______L,将生成的NO完全转化为需要的物质的量为:_____。
试卷第1页,共3页
8
参考答案:
1.B
【详解】
①SiO2与氢氧化钠溶液反应可生成Na2SiO3;
②Si与氧气反应能生成SiO2;
③SiO2先与氢氧化钠溶液反应生成Na2SiO3和H2O,Na2SiO3再与酸反应可生成H2SiO3;
④CuO先与酸反应可得到铜盐,铜盐再与碱溶液反应可生成Cu(OH)2;
⑤Na2O2与水反应可生成NaOH;
综上所述,③④不能一步反应,答案选B。
2.A
【详解】
A.同一周期主族元素从左向右原子半径逐渐减小,则P的半径大于Cl,即X>Y,A错误;
B.X、Y对应的简单氢化物分别是PH3和HCl,元素非金属性越强,其简单氢化物越稳定,还原性越弱,非金属性:Cl>P,则简单氢化物的还原性:PH3>HCl,B正确;
C.同一周期主族元素从左向右,金属性减弱,非金属性增强,各元素对应的金属单质还原性减弱,非金属单质的氧化性增强,所以同周期中Cl2的氧化性最强,C正确;
D.元素非金属性越强,其最高价含氧酸的酸性越强,非金属性:Cl>P,则最高价含氧酸的酸性:HClO4>H3PO4,D正确;
答案选A。
3.D
【详解】
①离子核外电子层数越多,离子半径越大;当离子的电子层结构相同时,离子的核电荷数越大,离子半径就越小,所以粒子半径:S2->Cl->K+>Al3+,①错误;
②元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:F>Cl>S>P>Si,所以氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,②正确;
③元素的非金属性越强,其简单离子的还原性就越弱。元素的非金属性:Cl>Br>I>S,所以离子的还原性:S2->I->Br->Cl-,③错误;
④元素的非金属性越强,其单质的氧化性就越强。元素的非金属性:氧化性:Cl>S>Se>Te,所以单质的氧化性:Cl2>S>Se>Te,④正确;
⑤元素的非金属性越强,其最高价含氧酸的酸性就越强。元素的非金属性:Cl>S>P>C,所以酸性:HClO4>H2SO4>H3PO4>H2CO3,⑤错误;
⑥同一周期元素的原子序数越大,元素的非金属性越强;同一主族元素的原子序数越大,元素的非金属性就越弱,则元素的非金属性:O>N>P>Si,⑥正确;
⑦同一周期元素,原子序数越大,元素的金属性越弱;同一主族元素的原子序数越大,元素的金属性就越强,所以元素的金属性:Be<Mg<Ca<K,⑦正确;
综上所述可知:说法错误的是①③⑤,故合理选项是D。
4.A
【详解】
A.因为S的非金属性强于P,因此酸性:,A正确;
B.因为Ca的金属性强于Mg,因此碱性:,B错误;
C.非金属性:BrI,因此氧化性:Br2I2,还原性:,C错误;
D.非金属性:N弱于O,因此稳定性,D错误;
答案选A。
5.A
【详解】
A.同主族元素从上到下,原子半径增大,磷原子半径比氮的大,故A正确;
B.磷最高化合价为+5价,PH3中磷的化合价为-3价,故B错误;
C.非金属性:P
6.B
【详解】
A.原子序数:Y
B.X和W位于同一周期,原子序数:X
C.Y和Z位于同一周期,原子序数:Y
7.A
【详解】
A.元素周期表中共有18纵列,第18列为0族元素,依次向前推可知,第17列为VIIA族,第16列为ⅥA族,故A正确;
B.第ⅠA族元素形成的单质有氢气和金属单质(锂、钠、钾、铷、铯、钫等),金属单质与水均能发生反应,而氢气与水不反应,故B错误;
C.第三周期,第ⅡA族元素为Mg,原子序数为12,第ⅢA族元素为Al,原子序数为13,二者原子序数的差值为1,若为第四周期,第ⅡA族元素为Ca,原子序数为20,第ⅢA族元素为Ga,原子序数为31,二者原子序数的差值为11,若为第六周期,第ⅡA族元素为Ba,原子序数为56,第ⅢA族元素为Tl,原子序数为81,二者原子序数的差值为25,故C错误;
D.0族元素的原子最外层电子数不都是8,氦原子最外层有2个电子,故D错误;
故选A。
8.D
【详解】
同主族元素从上到下元素的非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱,酸性相对强弱顺序为:HXO4>HYO4>HZO4,可知非金属性X>Y>Z,原子序数X
B.最高价氧化物对应水化物的酸性是:HXO4>HYO4>HZO4,则非金属性X>Y>Z,故B错误;
C. 非金属性越强,气态氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:X>Y>Z,故C错误;
D. 由上述分析可知,原子序数:Z>Y>X,故D正确。
故选D。
9.A
【详解】
A.硅在自然界中主要以二氧化硅、硅酸盐形式存在,自然界没有游离态的硅,A错误;
B. 硅的导电性介于导体和绝缘体之间,良好的半导体材料,是应用最为广泛的半导体材料,B正确;
C.硅是良好的半导体材料,高纯度的硅可用于制造计算机芯片,C正确;
D. 二氧化硅、纯碱和石灰石可用于生产玻璃,D正确;
答案选A。
10.C
【详解】
A.31d和33d质子数相同,中子数不同,是不同的核素,故A错误;
B.非金属性a(O)>e(S)>d(P),故氢化物稳定性:a>e>d,故B错误;
C.b和c的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,故C正确;
D.a和b可形成Na2O和Na2O2,故D错误;
故选C。
11.B
【详解】
A.若XY处于同一主族,X原子半径X>Y,则原子序数:X>Y,故A错误;
B.化合物XnYm中X显负价,说明X吸引电子的能力大于Y,则元素的非金属性:X>Y,故B正确;
C.若价电子数X>Y,比如O>N,O一般没有正价,则最高正价:N>O,故C错误;
D.H原子最外层电子数是1,氯元素最外层电子数分别为7,二者形成共价化合物,不存在离子键,故D错误;
故选B。
12.B
【详解】
A.硅是一种亲氧元素,在自然界中主要以氧化物和硅酸盐的形式存在,只有化合态,没有游离态,碳元素在自然界中既有游离态又有化合态,A错误;
B.碳、硅元素的原子最外层都有4个电子,其最高化合价都是+4价,B正确;
C.氧元素在地壳中的含量占第一位,硅元素在地壳中的含量占第二位,C错误;
D.碳有两种常见氧化物——和,硅只有一种常见氧化物——,D错误;
故选B。
13.AB
【详解】
A.有机色质褪色为漂白,酸性KMnO4溶液和H2O2溶液发生氧化还原反应而使紫红色褪去,表明H2O2具有还原性, A错误;
B.红热的木炭与浓硫酸反应生成二.氧化碳、二氧化硫,均使石灰水变浑浊,由现象不能说明生成了二氧化碳,B错误;
C.向Na2SiO3溶液中通入足量的CO2,产生的白色胶状物质为硅酸,证明碳酸的酸性大于硅酸,则非金属性:C> Si,故C正确;
D.向某溶液中加入稀盐酸酸化,无明显现象,溶液中无Ag+,加入BaCl2溶液,产生白色沉淀,说明该沉淀是硫酸钡,原溶液中一定有,D正确;
故选AB。
14.CD
【详解】
A.装置A中的分液漏斗,使用时要想让液体流出,除去打开活塞外,还应打开瓶塞,A不正确;
B.为防止氯化氢对后续实验的干扰,装置B中的药品为饱和碳酸氢钠溶液,作用是吸收挥发出的氯化氢,B不正确;
C.该实验中,不管是用盐酸制取碳酸,还是用碳酸制取硅酸,设计原理都为强酸制弱酸,C正确;
D.该装置中,产生的尾气为CO2,对环境不造成污染,所以可以不设计尾气处理装置,D正确;
故选CD。
15.CD
【详解】
A.电子层结构相同的离子,质子数越多,半径越小,所以离子半径E(Cl-)<D(S2-),故A错误;
B.元素的非金属性越强,氢化物越稳定。同周期元素从左到右元素的非金属性逐渐增强,氢化物的稳定性逐渐增强。则氢化物的稳定性A(CH4)<B(H2O),故B错误;
C.B、C形成的化合物Na2O2能跟CO2以及水反应生成氧气,可用作供氧剂,故C正确;
D.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强。同周期元素从左到右元素的非金属性逐渐增强,最高价氧化物对应的水化物的酸性逐渐增强,所以酸性:HClO4>H2SO4,故D正确;
故选CD。
16.AC
【详解】
A.同周期主族元素从左到右,原子半径逐渐减小,则原子半径由小到大的顺序是W
C.化合物甲是HF,乙是H2O,丙是NH3或CH4,不论丙是NH3,还是CH4,化合物的沸点由高到低的顺序都是乙>甲>丙,C项正确;
D.O与H可形成H2O、H2O2,与C可形成CO、CO2,与N可形成NO、NO2、N2O5等多种氧化物,D项错误;
答案选AC。
17. 第四周期IA族 4KClO33KClO4+KCl CaSO3 5SO2+2+2H2O=4H++2Mn2++5 r(S2-)>r(Ca2+) MgCO3+H2OMg(OH)2+CO2↑
【详解】
(1) 常温下X的单质能与水反应,则X可能为Na或K或Ca。若X为Na,根据XYO3可知Y为N元素,则甲为NaNO3,NaNO3高温分解不可能产生两种盐;若X为K,根据化学式可知Y为Cl,甲为KClO3,其化合价为+5价,因为Cl的最高化合价为+7,最低为-1价,加热分解可生成两种盐,符合题意;若X为Ca则Y只能为S,甲为CaSO3,而CaSO3加热被氧化而不会生成两种盐,综上可知X为K元素,Y为Cl元素。K位于第四周期IA族;KClO3中Cl化合价为+5价,加热分解可生成两种盐,其一为无氧酸盐,则为KCl,根据氧化还原反应化合价有升有降,另一种产物必然为KClO4 ,高温分解的化学方程式为:4KClO33KClO4+KCl;
(2) ①甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,气体为SO2,可知甲中含,X元素一定为Ca,Y元素为S,即甲为CaSO3。SO2具有还原性,与KMnO4发生氧化还原反应,离子方程式为:5SO2+2+2H2O=4H++2Mn2++5;
②Ca2+和S2-电子层结构相同,当电子层结构相同时,原子序数大的粒子半径反而小,所以两种离子的半径大小为:r(S2-)>r(Ca2+);
(3) 若甲能与盐酸反应,生成无色无味的气体乙,则甲中含,乙为CO2,则Y为C元素,X为Mg。
①由上分析知乙为CO2,其电子式为。
②MgCO3微溶于水,电离出的Mg2+和CO32-能够发生水解,加热促使水解平衡正向移动,最终生成Mg(OH)2和CO2,化学方程式为:MgCO3+H2OMg(OH)2+CO2↑。
18. Cl NaOH NH4NO3或NH4NO2
【详解】
(1).同一周期中,由左向右非金属性逐渐增强,故⑨元素Cl非金属性最强;元素的金属性越强,它所对应的最高价氧化物的水化物的碱性就越强,所以①元素的氢氧化物NaOH碱性最强;
(2). 元素④为O元素,其具有强氧化性的氢化物H2O2,过氧化氢是共价化合物,各元素间共用电子对,电子式为:;
(3). ①、③、④分别为:H、N、O元素,常见的离子化合物为NH4NO3;
(4). ⑥、⑨分别为Mg和Cl元素,其形成的化合物为MgCl2,Mg失去两个电子,每个Cl原子得到一个电子,可表示为:。
点睛:高中化学中,离子化合物一般包括金属和氨与非金属形成的化合物,所涉及的酸都是共价化合物,硝酸为共价化合物。
19. O N 34.5 正 2NaCl+2H2O2NaOH+H2+Cl2,Cl2+2NaOH→NaCl+NaClO+H2 向溶液中滴加酚酞,发现变红 温度升高,Kw 变大,c(H+)增大,pH 变小(Na2SO3被氧化) >
【详解】
(1)上述三种盐所涉及的五种元素中,Na、Cl、S有3个电子层,半径较大,O、 N有2个电子层,且O的质子数大于N,所以半径较小的原子是O;根据洪特规则,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同,所以p亚层上电子自旋状态只有一种的元素是N;
(2)铝在碱性条件下,生成偏铝酸盐,产物中铝元素的存在形式是;铝粉除去工业废水中的NaNO2,反应方程式是,根据方程式1molAl粉处理0.5mol NaNO2,质量是0.5mol×69g/mol=34.5g;
(3)a极氯离子失电子生成氯气,所以a极是阳极,应接在直流电源的正极;用石墨电极电解饱和食盐水生成氢氧化钠、氢气、氯气,氯气与氢氧化钠反应生成次氯酸钠,该装置中发生的化学方程式为2NaCl+2H2O2NaOH+H2+Cl2,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)该水解平衡的存在,Na2SO3使溶液显碱性,向溶液中滴加酚酞,发现变红,则证明该平衡的存在;水电离吸热,升高温度,水的电离平衡正向移动,Kw 变大,c(H+)增大,pH 变小; ①与④相比,温度相同,①的pH大于④,说明④中浓度减小,c ()①>④。
20. Ar Na Cl M HClO4 饱和NaHCO3 除去CO2中的HCl杂质 Na2SiO3 +CO2 +H2O = H2SiO3 ↓+ Na2CO3(生成NaHCO3也可)
【详解】
根据元素在周期表中的位置可知A是C,B是O,C是F,D是Na,E是Mg,F是Al,G是Si,H是P,I是S,J是Cl,K是Ar,M是Mn。则
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是稀有气体元素Ar,金属性最强的是Na;同周期自左向右原子半径逐渐减小,则除稀有气体外第三周期中原子半径最小的是Cl,属于过渡元素的是M;
(2)J的氢化物是共价化合物HCl,电子式为,氯元素的最高价是+7价,则最高价氧化物对应的水化物的化学式为HClO4;
(3)要比较元素C和Si的非金属性强弱,可以根据较强酸制备较弱酸判断,由于盐酸和大理石反应生成的二氧化碳中含有氯化氢会干扰实验,需要利用饱和碳酸氢钠溶液除去,即溶液B应该选用饱和NaHCO3溶液,作用是除去CO2中的HCl杂质,能说明C和Si非金属性强弱的化学方程式是Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。
21.(1) ④⑥ ①③⑦⑨⑩ ②④⑨
(2)Na>Fe=Al
(3)Na2O·CaO·6SiO2
【分析】
①氢氧化钠固体是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质;
②铜片是金属单质,属于能导电的纯净物,单质既不是电解质也不是非电解质;
③氯化氢气体是不能导电的纯净物,在水溶液中能电离出自由移动的离子,属于电解质;
④稀硫酸溶液中存在自由移动的离子,属于能导电的混合物,混合物既不是电解质也不是非电解质;
⑤干冰是不能电离出自由移动离子的非电解质,是不能导电的纯净物;
⑥空气是不能导电的混合物,混合物既不是电解质也不是非电解质;
⑦碳酸钠粉末是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质;
⑧蔗糖晶体是不能电离出自由移动离子的非电解质,是不能导电的纯净物;
⑨熔融氯化钠是含有能自由移动离子的化合物,属于能导电的纯净物,属于电解质;
⑩KAl(SO4)2·12H2O晶体是含有不能自由移动离子的化合物,属于不能导电的纯净物,熔融状态或水溶液中能电离出自由移动的离子,属于电解质。
(1)
i.由分析可知,属于混合物的是④⑥,故答案为:④⑥;
ii.由分析可知,属于电解质的是①③⑦⑨⑩,故答案为:①③⑦⑨⑩;
iii.由分析可知,上述状态下可导电的是②④⑨,故答案为:②④⑨;
(2)
由金属与酸反应的方程式可知,金属R的金属化合价与生成氢气的关系式为:2R—nH2,则0.2mol金属钠、铁、铝分别投入100mL0.1mol/L盐酸时,盐酸不足量,但钠能与溶液中的水反应,而铁、铝不能与水反应,则金属钠反应生成氢气的物质的量为0.2mol×=0.1mol,铁、铝反应生成氢气的物质的量都为0.1mol/L×0.1L×=0.05mol,所以在标准状况下产生氢气体积大小的顺序是Na>Fe=Al,故答案为:Na>Fe=Al;
(3)
设普通玻璃的质量为100g,由氧化钠、氧化钙和二氧化硅的质量分数可得:n(Na2O):n(CaO):n(SiO 2)= ::≈1:1:6,则以氧化物的形式表示该玻璃的化学式为Na2O·CaO·6SiO2,故答案为:Na2O·CaO·6SiO2。
22. Na2O、K2O SiO2+2OH-=SiO32-+H2O MgO和Fe2O3 向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复操作2至3次 H2SiO3SiO2+H2O 坩埚钳、三脚架
【详解】
(1)根据分析,蛇纹石中含有的可溶性金属氧化物有Na2O和K2O,它们能与水反应生成氢氧化钠和氢氧化钾;
(2)二氧化硅属于酸性氧化物,可与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(3)氧化钠与氧化钾属于可溶性氧化物,氧化铝属于两性氧化物,二氧化硅属于酸性氧化物,上述四种物质都能溶解在氢氧化钠溶液中,氧化镁和氧化铁属于碱性氧化物且难溶于水,因此,滤渣A的成分有MgO和Fe2O3;
(4)步骤②生成沉淀的成分是硅酸,洗涤过滤出的沉淀的方法是:向过滤器中注入蒸馏水至浸没沉淀,待水自然流出后,重复上述操作两到三次;
(5)步骤③用灼烧的方法使硅酸分解生成二氧化硅,化学方程式为:H2SiO3SiO2+H2O,实验室灼烧固体时需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、坩埚钳和三脚架。
23. D C Li+核电荷数较大
【详解】
(1) 基态多电子原子的核外电子排布应该遵循能量最低原理,即一般按照能级顺序填充(1s<2s<2p)。因此能量最低的状态就是先排满1s,再排2s,即,能量最低的(基态)原子为D;2个电子排在2px上,1个电子排布在2s上,是四个选项中能量最高的状态,能量最高的原子是C。故填D;C;
(2) Li+与H-具有相同的电子构型,Li+核电荷数为3,H-核电荷数为1,电子结构相同时,核电荷数越大,原子核对核外电子的吸引能力越大,离子半径就越小。故答案为:Li+核电荷数较大。
24.(1)MgO·FeO·SiO2
(2)2H2SO4(浓)+CuCuSO4+2H2O+SO2↑
(3) 氧化性 4:3 2.24 0.075mol
【解析】
(1)
在MgFeSiO4中,镁显+2价,铁显+2价,硅显+4价,氧显-2价,则MgFeSiO4用氧化物表示的组成为MgO FeO SiO2;
(2)
在加热条件下,铜和浓硫酸反应生成二氧化硫,反应方程式为2H2SO4(浓)+CuCuSO4+2H2O+SO2↑;
(3)
①Si元素从0价升至+4价,N元素从+5降至+2价,由升降相等,含N的物质前配4,含Si物质前配3,结合原子守恒可配平化学方程式:3Si+4HNO3+18HF=3H2SiF6+4NO+8H2O,用双线桥表示为:;
②N元素的化合价由+5价降低为+3价,所以该反应中,HNO3仅作氧化剂,表选氧化性,Si元素化合价升高,Si做还原剂,则氧化剂与还原剂的物质的量之比为:4:3;
③转移12mol电子生成4molNO,转移0.3mol电子时生成0.1molNO,标准状况下的体积为V=nVm=0.1mol×22.4L/mol=2.24L,NO完全转化为的方程式为:4NO+3+2H2O=4HNO3,需要的物质的量为0.075mol。
答案第1页,共2页
