第三单元海水中的化学复习课件—2021-2022学年九年级化学鲁教版(五四学制)全一册(共57张PPT)
文档属性
| 名称 | 第三单元海水中的化学复习课件—2021-2022学年九年级化学鲁教版(五四学制)全一册(共57张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-08 15:01:50 | ||
图片预览

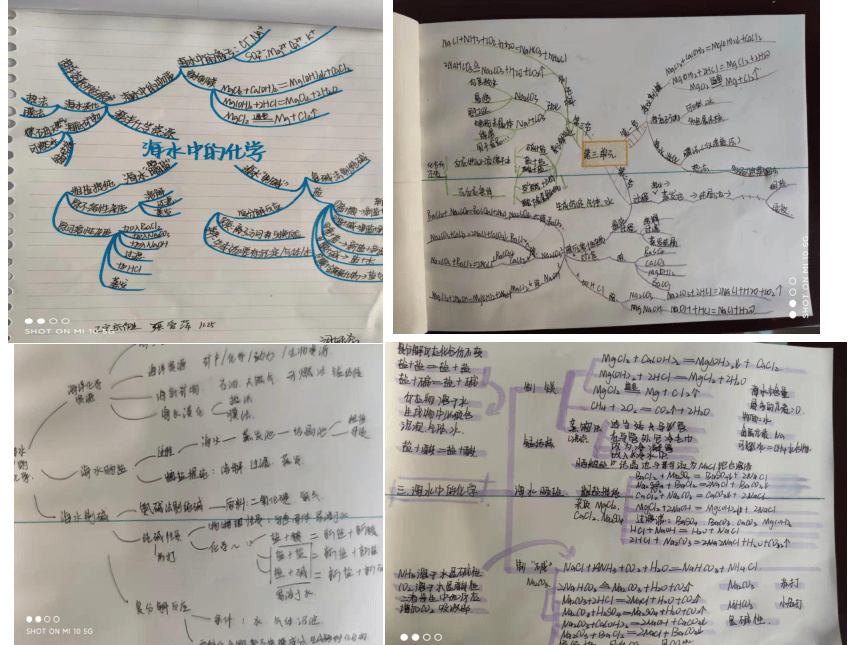
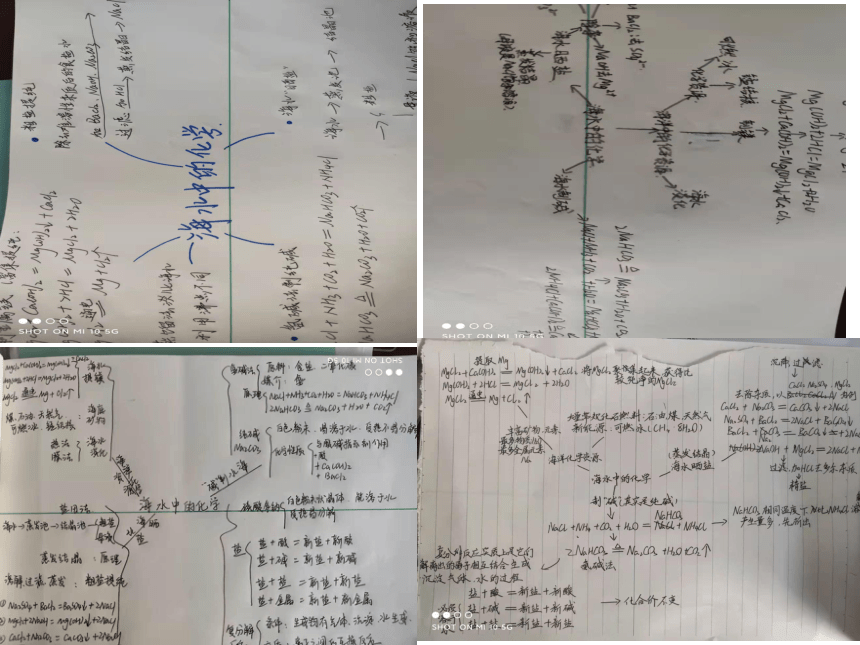



文档简介
(共57张PPT)
第三单元 海水中的化学
单元复习
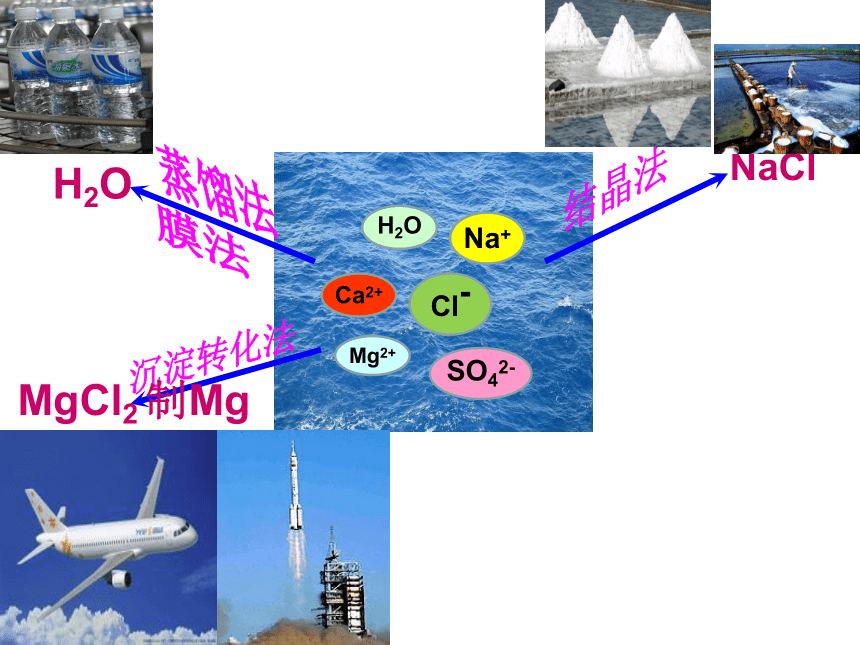
海水
本单元围绕着“海水”学习的主要内容
三、海水制碱
一、海洋化学资源
二、海水晒盐
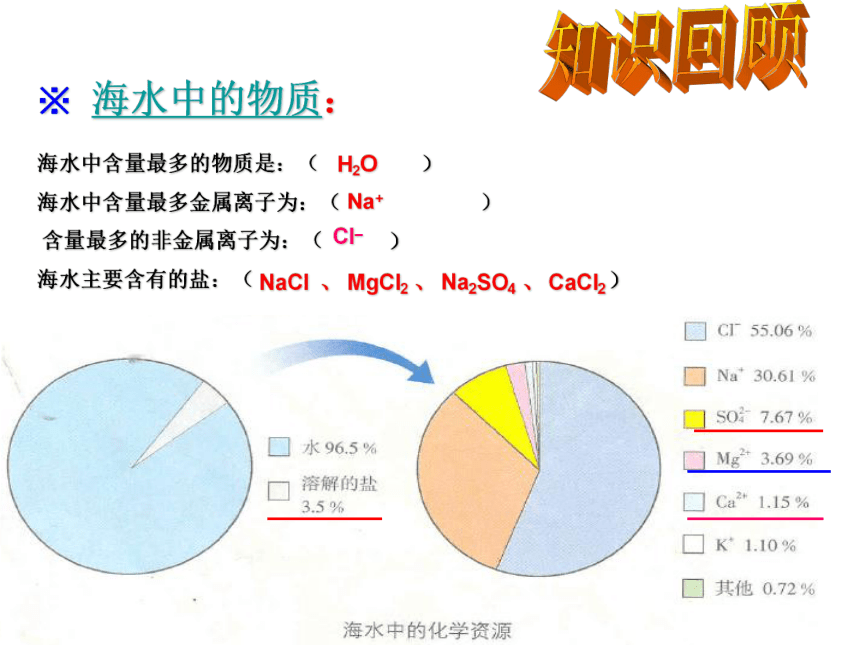
海水中含量最多的物质是:( )
海水中含量最多金属离子为:( )
含量最多的非金属离子为:( )
海水主要含有的盐:( )
※ 海水中的物质:
知识回顾
H2O
Na+
Cl–
NaCl 、 MgCl2 、 Na2SO4 、 CaCl2
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
NaCl
结晶法
沉淀转化法
MgCl2 制Mg
H2O
蒸馏法
膜法
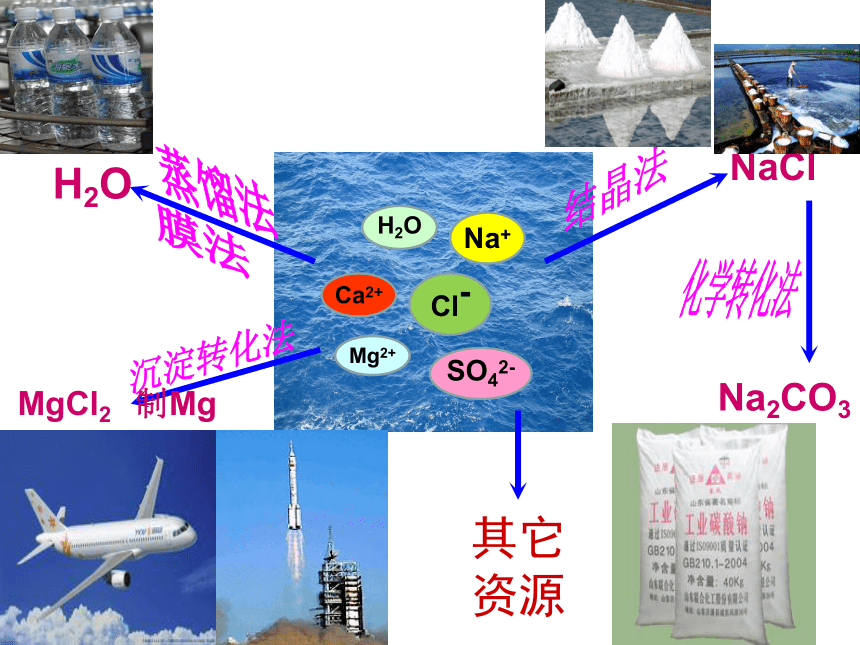
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
NaCl
结晶法
沉淀转化法
MgCl2 制Mg
化学转化法
Na2CO3
H2O
蒸馏法
膜法
其它资源
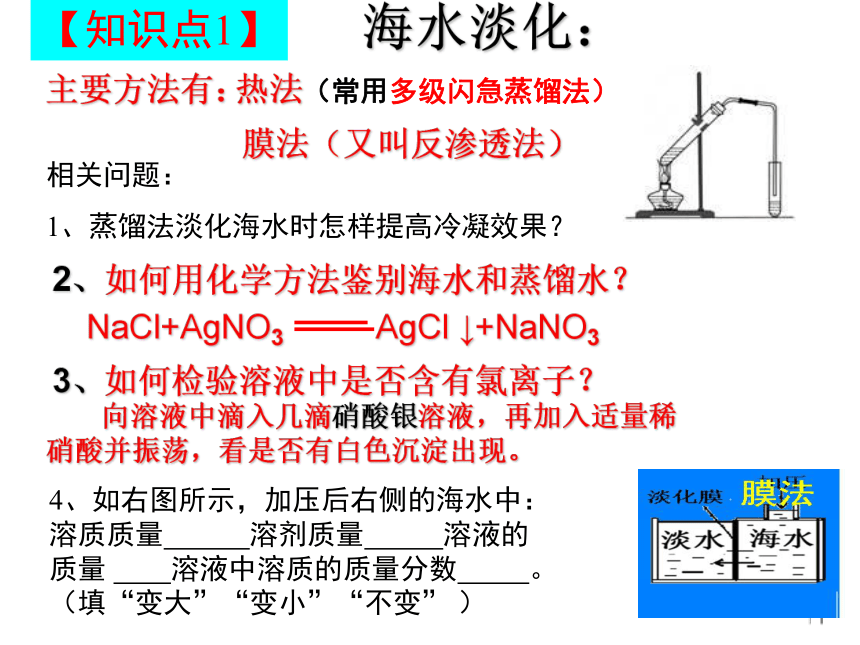
海水淡化:
主要方法有:
2、如何用化学方法鉴别海水和蒸馏水?
NaCl+AgNO3 AgCl ↓+NaNO3
热法(常用多级闪急蒸馏法)
3、如何检验溶液中是否含有氯离子?
向溶液中滴入几滴硝酸银溶液,再加入适量稀硝酸并振荡,看是否有白色沉淀出现。
膜法(又叫反渗透法)
相关问题:
1、蒸馏法淡化海水时怎样提高冷凝效果?
4、如右图所示,加压后右侧的海水中:溶质质量 溶剂质量 溶液的质量 溶液中溶质的质量分数 。(填“变大”“变小”“不变” )
【知识点1】
(枣庄 )
淡水资源:淡化海水可以用 (填字母代号);
A.吸附法 B.蒸馏法 C.过滤法 D.电解法
该过程是 (填“化学变化”或“物理变化”).
走近中考
【知识点1】
海水淡化
物理变化
B
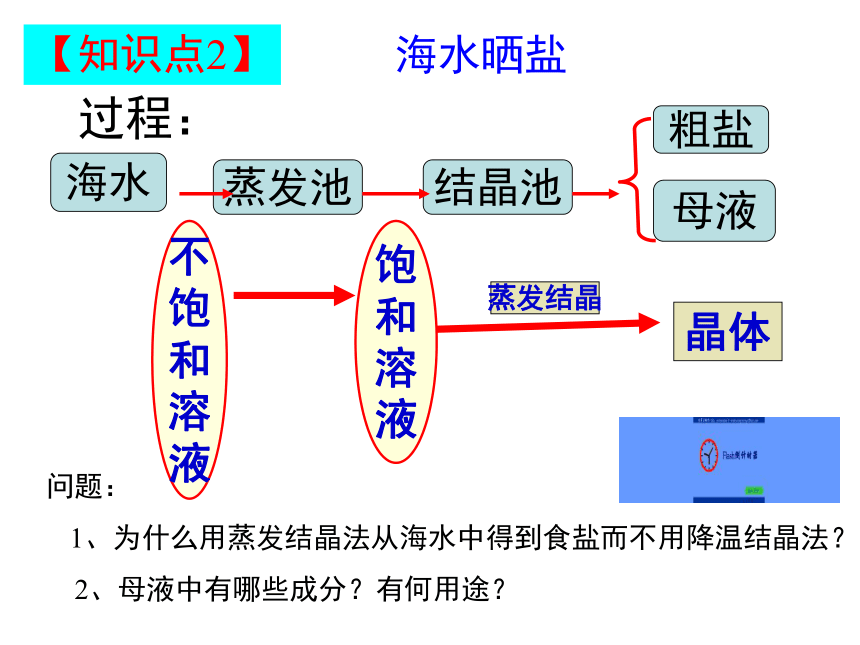
【知识点2】
海水晒盐
海水
蒸发池
结晶池
粗盐
母液
过程:
不
饱
和
溶
液
饱
和
溶
液
晶体
蒸发结晶
问题:
1、为什么用蒸发结晶法从海水中得到食盐而不用降温结晶法?
2、母液中有哪些成分?有何用途?
关于海水“晒盐”的有关叙述正确的是( )
A.利用海水降温析出晶体
B.海水晒盐后的母液因食盐减少而变成不饱和溶液
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下分解得到食盐晶体
【知识点2】
海水晒盐
走近中考
C
石灰乳
氯化镁
镁
氢氧化镁
海水或卤水
通电
盐酸
【知识点3】
海水制镁
过程:
海水中本来就有MgCl2,从海水中提取MgCl2时,经历了MgCl2→Mg (OH)2→MgCl2”,的转化过程,请分析这样做的目的是什么?
海水中MgCl2 的含量低,为了将MgCl2富集起来获得比较纯净的MgCl2
富集的方法
物理方法:蒸发浓缩等
化学方法:沉淀转化法
(利用复分解反应)
方法提升
( 烟台)海水制镁。从海水中提取金属镁的过程如下图所示:
在上述转化过程中发生中和反应的化学方程式 。
海水中本身就含有氯化镁,则①、②两步的作用是 。
【知识点3】
海水制镁
走近中考
富集提纯氯化镁
吸氨
纯碱
碳酸氢钠
饱和氨盐水
饱和食盐水
盐水
精制
过滤、热解
碳酸化
【知识点4】
海水“制碱”
过程:
你能写出有关的化学方程式吗?
( 烟台) 海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱。
①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ;
②反应中生成NaHCO3和NH4Cl的质量比为84∶53.5,NaHCO3和NH4Cl的溶解度曲线如图所示。请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因 。
【知识点4】
海水“制碱”
走近中考
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
同一温度下,氯化铵的溶解度要远远大于碳酸氢钠的溶解度,而反应生成的碳酸氢钠的质量要大于氯化铵的质量,因此在溶液中碳酸氢钠会因先达到饱和而析出。
海水淡化
海水晒盐
物理方法
海水中的化学
方法盘点
石灰乳
氯化镁
镁
氢氧化镁
海水或卤水
通电
盐酸
海水制镁
吸氨
纯碱
碳酸氢钠
饱和氨盐水
饱和食盐水
盐水
精制
过滤、热解
碳酸化
海水制碱
化学方法
海水中的化学
方法盘点
海水中的化学
方法盘点
物理方法
化学方法
纯碱的化学性质:
纯碱
1、酸碱性:
2、与酸反应:
3、与碱反应:
4、与盐反应:
能使酚酞变红,说明显碱性。
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
Na2CO3+Ca(OH)2==2NaOH+ CaCO3↓
Na2CO3+BaCl2==2NaCl+BaCO3 ↓
【知识点5】
问题:如何检验碳酸根离子?
取样,然后加入稀盐酸,如产生能使澄清石灰水变浑浊的气体,则原物质中有碳酸根离子。
(青岛) 构建知识网络是一种重要的学习方法.如图是某同学整理的关于碳酸钠化学性质的知识网络,其中A、B属于不同类别的化合物.(图中“-”表示相连的两种物质能发生反应,图中“→”表示某种物质通过一步反应可转化为另一种物质).
1)若将A物质的溶液滴加到碳酸钠溶液中,观察到有无色气泡冒出,则A物质可能是 (填写一种物质的化学式).
2)不同类别的B物质能够与碳酸钠溶液反应产生白色沉淀,请选取其中一种,写出其与碳酸钠溶液反应的化学方程式 ;除你选取的物质所属类别外,B物质还可能属于 (填写物质类别).
.
服用含有Al(OH)3或NaHCO3的药物治疗胃酸过多
熟石灰中和土壤中的酸
蒸馒头时加入Na2CO3 除去酸味
复分解反应
AB+CD=AD+CB
【知识点6】
复分解反应:
1、定义:
两种化合物相互交换成分,生成另外
两种化合物的反应。
2、发生条件:
两种化合物在溶液中相互交换成分后
有沉淀、气体或水生成。
3、反应实质:
酸碱盐所电离出的离子相互结合,
生成沉淀、气体或水的过程。
【知识点6】
复分解反应的实质探究
反应实质:H+ + OH— H2O
1.请说出NaOH+HCl===NaCl+H2O
这一反应的实质,并用符号表示。
CO32-
H+
H+
Na+
Na2CO3
HCl
HCl
Na+
Na+
Cl-
Cl-
Cl-
Cl-
Na+
H2CO3
H2O
+
CO2
2.结合图示,你能说出
Na2CO3+2HCl===2NaCl+H2O+CO2↑
的实质,并用符号表示。
3.依次类推
AgNO3+NaCl===AgCl↓+NaNO3
反应的实质是什么?用符号表示。
反应实质:H+ + OH— H2O
H+ + CO3 2 - H2O + CO2 ↑
Cl— + Ag + AgCl
复分解反应的实质:
离子相互结合生成气体、沉淀或水, 使离子种类改变,生成新粒子。
↓
复分解反应的应用
(1)判断几种离子在同一溶液中能否共存
例:
H+ + CO3 2 - H2O + CO2 ↑
H+ 、CO3 2 -不能共存
Ba2+ + SO42— BaSO4
Ba2+ 、SO42—不能共存
↓
我们可以把能反应的两种粒子用“-”连接,如“H+- OH- ”,请将下列离子中相互能够反应的用“-”连接。
CO32-、NH4+、Ca2+、 Ag+ 、Mg2+、SO42-、 Cl- Ba2+ Cu2+ Fe3+
小 结
熟练掌握12对常考的不能共存的离子对
H+
CO32-
OH-
NH4+
Mg2+
Cu2+
Fe3+
Ba2+
Ca2+
Ag+
SO42-
Cl-
1、能在水中大量共存的一组离子是( )
A.Na+、C1-、SO42- B.H+、Na+、CO32-
C.Ba2+、OH-、SO42- D.Ag+、NO3-、Cl-
练习:
2、下列各组溶液的溶质能共存的是( )
A. NaCl、Na2SO4 B. AgNO3、HCl
C. Ca(OH)2、HCl D. Na2SO4、Ba(NO3)2
☆方法小结:
解决此类题的关键是离子结合后 判断生成物中是
否有水、气体或沉淀。
(2)物质的鉴别
小明同学在整理化学实验室
时,发现了一瓶NaOH溶液,他
想探究一下该溶液是否已经变质,
请你用尽量多的方法帮助他设计
实验。
☆ 友情提示:鉴别物质,可以采用物理方法和化学方法。化学方法主要原理是加入一种物质,可以产生不同的现象,一种现象鉴别一种物质,目前常用的是形成沉淀或气体。
.检验NaOH是否变质
【原理】
检验是否存在Na2CO3。
【法一】
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
稀盐酸
氢氧化钙
氯化钙
Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 +CaCl2=CaCO3↓+2NaCl
【法二】
白色沉淀
【法三】
白色沉淀
氢氧化钡
氯化钡
稀硫酸
+酸
+碱
+盐
鉴别及方法步骤:
取样
选择试剂并加入
根据现象
得出结论
若小明同学还想除去
上述变质的氢氧化钠溶液
中的杂质,应加入适量的
_____ 溶液除去(填化学
式)。
☆友情提示:除杂时应注意“不增、不减、易分”的原则,其实质就是将杂质离子变成沉淀或气体除去。
(3)物质的除杂
NaOH( Na2CO3 )
适量氢氧化钙
Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH
?
氢氧化钡
(3)物质的除杂
除去杂质及方法:
分析成分
加入试剂
转化成沉淀、气体、
水除去或转化成产品
纯物质
溶解、过滤等
物理方法除去
2、KCl溶液中混有K2CO3
3、KCl溶液中混有KOH
说明除去下列物质中少量杂质的方法和依据的原理
BaCl2溶液 生成沉淀
CaCl2溶液 生成沉淀
稀盐酸 生成气体
稀盐酸 生成水
学以致用
1、白砂糖中混有细沙
溶解性
你还有哪些困惑,请提出来,大家一起来研讨。
活动探究四:如何回馈感恩我们的海洋?
国家层面
社会层面
个人角度
问题再探究
如何从粗盐中获得精盐?请设计操作流程
友情提示:
1、粗盐中含有哪些杂质?
2、如何除去不溶性固体杂质?
3、如何除去杂质离子?加入什么试剂,采用什么样
的顺序?
海水
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
粗盐
精盐
分析成分
物理方法
BaCl2
过量处理
盐酸
盐酸
Na2CO3
化学方法
Na2CO3
NaOH
Ca2+
SO42-
Mg2+
除杂试剂
分析成分
流程
Na2CO3
NaOH
BaCl2
盐酸
BaCl2
BaCl2
NaOH
NaOH
Na2CO3
Na2CO3
盐酸
盐酸
过滤
过滤
过滤
蒸发
蒸发
蒸发
Cl-
Na+
Ca2+
SO42-
Mg2+
物理方法
化学方法
(烟台)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。
正确的操作顺序是 (填字母)。
加Na2CO3溶液的作用是除去
。
【拓展应用】
走近中考
acdbe
CaCl2和过量的Ba(OH)2
三国演义中有这样一个故事:诸葛亮率领的汉军误饮了哑泉水,不过旬日必死,但饮过了安乐泉水后却又转危为安,哑泉和安乐泉中所含的化学物质可能是( )
A:NaCl CaCl2 B:Na2SO4 KCl C:BaCl2 NaNO3 D:CuSO4 Ca(OH)2
历史小故事
1、
三国时,诸葛亮率军南征至云南西洱河,遇四口毒泉,其中一口为哑泉。时逢天气好生炎热,人马饮用了哑泉水后,一个个说不出话来。后来幸得一智者指教,复饮安乐泉水,“随即吐出恶涎,便能言语”。 为什么饮用哑泉水后会说不出话来呢?其实,哑泉水是一种含铜盐的泉水,即硫酸铜(胆矾)的水溶液,称为胆水。这种胆水饮用后会使人恶心、呕吐、腹泻,言语不清,直至虚脱、痉挛而死。解毒的简单方法是掺进大量石灰水,使与之起化学反应生成不溶于水的氢氧化铜沉淀和硫酸钙。这里的安乐泉,即为碱性水,能使铜盐生成不溶于水的沉淀物。
2、CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有___________.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有_____________.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______.
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进___________.
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入碳酸钠溶液 _____ 丙同学的猜想正确
_____ 有蓝色沉淀生成 你的猜想正确
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
【作出猜想】甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有___ __.(填化学式) ;乙同学认为甲同学的猜想是错误的,理由是_____.
【实验设计及验证】请你将下列实验报告填写完整:
某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验。
请跟据以上信息计算:(结果保留到小数点后两位)
(1)反应生成沉淀的质量为_____g;
(2)样品中硫酸钠的质量;
(3)求滤液中氯化钠的质量分数。
⑴根据质量守恒定律,沉淀:10g+87g+54.65g-140g=11.65g
⑵解:设样品中硫酸钠的质量为x,反应中生成的氯化钠质量为y.
Na2SO4+BaCl2= BaSO4↓ + 2NaCl
142 233 117
x 11.65 g y
142 x
233 11.65g
x=7.1g
⑶ 233 11.65g
117 y
y=5.85g
滤液中氯化钠的质量=10.00g﹣7.1g+5.85g=8.75g
滤液中氯化钠的质量分数为: ×100%=6.25%.
答:
=
=
某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,设计实验方案如图.
(1)写出A物质的化学式 该物质的俗称是 .
(2)操作(2)的名称是 .
(3)写出反应(3)的化学方程式 .
(4)反应(1)中加入过量A物质的目的是 .反应(3)中如果加入盐酸也过量,则对所得到的氯化钠纯度 影响;
(5)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 .
说明除去下列物质中少量杂质的方法和依据的原理
1、白砂糖中混有细沙
2、KNO3中晶体混有NaCl
3、酒精中混有水
4、铁粉中混有铜粉
溶解性
磁性
溶解度受温度的影响
资料:
酒精的沸点78℃
水的沸点100℃
沸点
物
理
方
法
学以致用
除杂原则
不增
不 减
易分
不
增加
新杂质
不
减 少
产品
气体
水
沉淀
思路归纳 能力提升
除去杂质,一般遵循什么样的思路?
成分分析
明确
思路
物理方法
化学方法
除杂质
选择
方法
思路归纳 能力提升
提纯某种物质,一般遵循什么样的思路?
成分分析
明确
思路
物理方法
化学方法
除杂质
选择
方法
合适的试剂
合理的用量
顺序要得当
过量的处理
确定
细节
甲、乙两组同学在探究物质的性质实验时,得到的废液中共含有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子。经测试:甲组同学实验所得废液的pH =13;那么,乙组同学实验废液中含有的离子是 。
经合作讨论,甲、乙两组同学将实验产生的废液按适当比例混合后,可将废液中对环境污染较为严重的Ba2+、Cu2+、OH-离子除去。请写出废液混合后发生的任意两个反应的化学方程式:
① ;
② 。
Cu2+、 Ba2+、NO3-
【拓展延伸】
Ba(NO3)2+K2CO3 ===2KNO3+ BaCO3↓
Cu (NO3)2+2KOH=== Cu( OH)2↓+ 2K NO3
海水
一、化学资源
二、海水晒盐
海水中的物质
海水淡化
制镁
海水中最多的盐:
原理:
流程:
方法
锰结核
蒸馏法
常用
粗盐提纯
方法步骤
三、海水制碱
方法
过程
氨碱法制纯碱
过程
精盐水
纯碱性质
碳酸氢钠
纯碱
俗名
用途:
原理
1.
2.
3.
4.
纯碱性质
大多数盐也有类似性质
复分解反应条件
转化
结晶方法
蒸发结晶
第三单元 海水中的化学
单元复习
海水
本单元围绕着“海水”学习的主要内容
三、海水制碱
一、海洋化学资源
二、海水晒盐
海水中含量最多的物质是:( )
海水中含量最多金属离子为:( )
含量最多的非金属离子为:( )
海水主要含有的盐:( )
※ 海水中的物质:
知识回顾
H2O
Na+
Cl–
NaCl 、 MgCl2 、 Na2SO4 、 CaCl2
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
NaCl
结晶法
沉淀转化法
MgCl2 制Mg
H2O
蒸馏法
膜法
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
NaCl
结晶法
沉淀转化法
MgCl2 制Mg
化学转化法
Na2CO3
H2O
蒸馏法
膜法
其它资源
海水淡化:
主要方法有:
2、如何用化学方法鉴别海水和蒸馏水?
NaCl+AgNO3 AgCl ↓+NaNO3
热法(常用多级闪急蒸馏法)
3、如何检验溶液中是否含有氯离子?
向溶液中滴入几滴硝酸银溶液,再加入适量稀硝酸并振荡,看是否有白色沉淀出现。
膜法(又叫反渗透法)
相关问题:
1、蒸馏法淡化海水时怎样提高冷凝效果?
4、如右图所示,加压后右侧的海水中:溶质质量 溶剂质量 溶液的质量 溶液中溶质的质量分数 。(填“变大”“变小”“不变” )
【知识点1】
(枣庄 )
淡水资源:淡化海水可以用 (填字母代号);
A.吸附法 B.蒸馏法 C.过滤法 D.电解法
该过程是 (填“化学变化”或“物理变化”).
走近中考
【知识点1】
海水淡化
物理变化
B
【知识点2】
海水晒盐
海水
蒸发池
结晶池
粗盐
母液
过程:
不
饱
和
溶
液
饱
和
溶
液
晶体
蒸发结晶
问题:
1、为什么用蒸发结晶法从海水中得到食盐而不用降温结晶法?
2、母液中有哪些成分?有何用途?
关于海水“晒盐”的有关叙述正确的是( )
A.利用海水降温析出晶体
B.海水晒盐后的母液因食盐减少而变成不饱和溶液
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下分解得到食盐晶体
【知识点2】
海水晒盐
走近中考
C
石灰乳
氯化镁
镁
氢氧化镁
海水或卤水
通电
盐酸
【知识点3】
海水制镁
过程:
海水中本来就有MgCl2,从海水中提取MgCl2时,经历了MgCl2→Mg (OH)2→MgCl2”,的转化过程,请分析这样做的目的是什么?
海水中MgCl2 的含量低,为了将MgCl2富集起来获得比较纯净的MgCl2
富集的方法
物理方法:蒸发浓缩等
化学方法:沉淀转化法
(利用复分解反应)
方法提升
( 烟台)海水制镁。从海水中提取金属镁的过程如下图所示:
在上述转化过程中发生中和反应的化学方程式 。
海水中本身就含有氯化镁,则①、②两步的作用是 。
【知识点3】
海水制镁
走近中考
富集提纯氯化镁
吸氨
纯碱
碳酸氢钠
饱和氨盐水
饱和食盐水
盐水
精制
过滤、热解
碳酸化
【知识点4】
海水“制碱”
过程:
你能写出有关的化学方程式吗?
( 烟台) 海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱。
①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ;
②反应中生成NaHCO3和NH4Cl的质量比为84∶53.5,NaHCO3和NH4Cl的溶解度曲线如图所示。请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因 。
【知识点4】
海水“制碱”
走近中考
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
同一温度下,氯化铵的溶解度要远远大于碳酸氢钠的溶解度,而反应生成的碳酸氢钠的质量要大于氯化铵的质量,因此在溶液中碳酸氢钠会因先达到饱和而析出。
海水淡化
海水晒盐
物理方法
海水中的化学
方法盘点
石灰乳
氯化镁
镁
氢氧化镁
海水或卤水
通电
盐酸
海水制镁
吸氨
纯碱
碳酸氢钠
饱和氨盐水
饱和食盐水
盐水
精制
过滤、热解
碳酸化
海水制碱
化学方法
海水中的化学
方法盘点
海水中的化学
方法盘点
物理方法
化学方法
纯碱的化学性质:
纯碱
1、酸碱性:
2、与酸反应:
3、与碱反应:
4、与盐反应:
能使酚酞变红,说明显碱性。
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
Na2CO3+Ca(OH)2==2NaOH+ CaCO3↓
Na2CO3+BaCl2==2NaCl+BaCO3 ↓
【知识点5】
问题:如何检验碳酸根离子?
取样,然后加入稀盐酸,如产生能使澄清石灰水变浑浊的气体,则原物质中有碳酸根离子。
(青岛) 构建知识网络是一种重要的学习方法.如图是某同学整理的关于碳酸钠化学性质的知识网络,其中A、B属于不同类别的化合物.(图中“-”表示相连的两种物质能发生反应,图中“→”表示某种物质通过一步反应可转化为另一种物质).
1)若将A物质的溶液滴加到碳酸钠溶液中,观察到有无色气泡冒出,则A物质可能是 (填写一种物质的化学式).
2)不同类别的B物质能够与碳酸钠溶液反应产生白色沉淀,请选取其中一种,写出其与碳酸钠溶液反应的化学方程式 ;除你选取的物质所属类别外,B物质还可能属于 (填写物质类别).
.
服用含有Al(OH)3或NaHCO3的药物治疗胃酸过多
熟石灰中和土壤中的酸
蒸馒头时加入Na2CO3 除去酸味
复分解反应
AB+CD=AD+CB
【知识点6】
复分解反应:
1、定义:
两种化合物相互交换成分,生成另外
两种化合物的反应。
2、发生条件:
两种化合物在溶液中相互交换成分后
有沉淀、气体或水生成。
3、反应实质:
酸碱盐所电离出的离子相互结合,
生成沉淀、气体或水的过程。
【知识点6】
复分解反应的实质探究
反应实质:H+ + OH— H2O
1.请说出NaOH+HCl===NaCl+H2O
这一反应的实质,并用符号表示。
CO32-
H+
H+
Na+
Na2CO3
HCl
HCl
Na+
Na+
Cl-
Cl-
Cl-
Cl-
Na+
H2CO3
H2O
+
CO2
2.结合图示,你能说出
Na2CO3+2HCl===2NaCl+H2O+CO2↑
的实质,并用符号表示。
3.依次类推
AgNO3+NaCl===AgCl↓+NaNO3
反应的实质是什么?用符号表示。
反应实质:H+ + OH— H2O
H+ + CO3 2 - H2O + CO2 ↑
Cl— + Ag + AgCl
复分解反应的实质:
离子相互结合生成气体、沉淀或水, 使离子种类改变,生成新粒子。
↓
复分解反应的应用
(1)判断几种离子在同一溶液中能否共存
例:
H+ + CO3 2 - H2O + CO2 ↑
H+ 、CO3 2 -不能共存
Ba2+ + SO42— BaSO4
Ba2+ 、SO42—不能共存
↓
我们可以把能反应的两种粒子用“-”连接,如“H+- OH- ”,请将下列离子中相互能够反应的用“-”连接。
CO32-、NH4+、Ca2+、 Ag+ 、Mg2+、SO42-、 Cl- Ba2+ Cu2+ Fe3+
小 结
熟练掌握12对常考的不能共存的离子对
H+
CO32-
OH-
NH4+
Mg2+
Cu2+
Fe3+
Ba2+
Ca2+
Ag+
SO42-
Cl-
1、能在水中大量共存的一组离子是( )
A.Na+、C1-、SO42- B.H+、Na+、CO32-
C.Ba2+、OH-、SO42- D.Ag+、NO3-、Cl-
练习:
2、下列各组溶液的溶质能共存的是( )
A. NaCl、Na2SO4 B. AgNO3、HCl
C. Ca(OH)2、HCl D. Na2SO4、Ba(NO3)2
☆方法小结:
解决此类题的关键是离子结合后 判断生成物中是
否有水、气体或沉淀。
(2)物质的鉴别
小明同学在整理化学实验室
时,发现了一瓶NaOH溶液,他
想探究一下该溶液是否已经变质,
请你用尽量多的方法帮助他设计
实验。
☆ 友情提示:鉴别物质,可以采用物理方法和化学方法。化学方法主要原理是加入一种物质,可以产生不同的现象,一种现象鉴别一种物质,目前常用的是形成沉淀或气体。
.检验NaOH是否变质
【原理】
检验是否存在Na2CO3。
【法一】
Na2CO3 +2HCl=2NaCl+H2O+CO2↑
稀盐酸
氢氧化钙
氯化钙
Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 +CaCl2=CaCO3↓+2NaCl
【法二】
白色沉淀
【法三】
白色沉淀
氢氧化钡
氯化钡
稀硫酸
+酸
+碱
+盐
鉴别及方法步骤:
取样
选择试剂并加入
根据现象
得出结论
若小明同学还想除去
上述变质的氢氧化钠溶液
中的杂质,应加入适量的
_____ 溶液除去(填化学
式)。
☆友情提示:除杂时应注意“不增、不减、易分”的原则,其实质就是将杂质离子变成沉淀或气体除去。
(3)物质的除杂
NaOH( Na2CO3 )
适量氢氧化钙
Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH
?
氢氧化钡
(3)物质的除杂
除去杂质及方法:
分析成分
加入试剂
转化成沉淀、气体、
水除去或转化成产品
纯物质
溶解、过滤等
物理方法除去
2、KCl溶液中混有K2CO3
3、KCl溶液中混有KOH
说明除去下列物质中少量杂质的方法和依据的原理
BaCl2溶液 生成沉淀
CaCl2溶液 生成沉淀
稀盐酸 生成气体
稀盐酸 生成水
学以致用
1、白砂糖中混有细沙
溶解性
你还有哪些困惑,请提出来,大家一起来研讨。
活动探究四:如何回馈感恩我们的海洋?
国家层面
社会层面
个人角度
问题再探究
如何从粗盐中获得精盐?请设计操作流程
友情提示:
1、粗盐中含有哪些杂质?
2、如何除去不溶性固体杂质?
3、如何除去杂质离子?加入什么试剂,采用什么样
的顺序?
海水
Cl-
Na+
Ca2+
SO42-
H2O
Mg2+
粗盐
精盐
分析成分
物理方法
BaCl2
过量处理
盐酸
盐酸
Na2CO3
化学方法
Na2CO3
NaOH
Ca2+
SO42-
Mg2+
除杂试剂
分析成分
流程
Na2CO3
NaOH
BaCl2
盐酸
BaCl2
BaCl2
NaOH
NaOH
Na2CO3
Na2CO3
盐酸
盐酸
过滤
过滤
过滤
蒸发
蒸发
蒸发
Cl-
Na+
Ca2+
SO42-
Mg2+
物理方法
化学方法
(烟台)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。
正确的操作顺序是 (填字母)。
加Na2CO3溶液的作用是除去
。
【拓展应用】
走近中考
acdbe
CaCl2和过量的Ba(OH)2
三国演义中有这样一个故事:诸葛亮率领的汉军误饮了哑泉水,不过旬日必死,但饮过了安乐泉水后却又转危为安,哑泉和安乐泉中所含的化学物质可能是( )
A:NaCl CaCl2 B:Na2SO4 KCl C:BaCl2 NaNO3 D:CuSO4 Ca(OH)2
历史小故事
1、
三国时,诸葛亮率军南征至云南西洱河,遇四口毒泉,其中一口为哑泉。时逢天气好生炎热,人马饮用了哑泉水后,一个个说不出话来。后来幸得一智者指教,复饮安乐泉水,“随即吐出恶涎,便能言语”。 为什么饮用哑泉水后会说不出话来呢?其实,哑泉水是一种含铜盐的泉水,即硫酸铜(胆矾)的水溶液,称为胆水。这种胆水饮用后会使人恶心、呕吐、腹泻,言语不清,直至虚脱、痉挛而死。解毒的简单方法是掺进大量石灰水,使与之起化学反应生成不溶于水的氢氧化铜沉淀和硫酸钙。这里的安乐泉,即为碱性水,能使铜盐生成不溶于水的沉淀物。
2、CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl
(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有___________.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有_____________.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______.
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进___________.
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入碳酸钠溶液 _____ 丙同学的猜想正确
_____ 有蓝色沉淀生成 你的猜想正确
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
【作出猜想】甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有___ __.(填化学式) ;乙同学认为甲同学的猜想是错误的,理由是_____.
【实验设计及验证】请你将下列实验报告填写完整:
某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验。
请跟据以上信息计算:(结果保留到小数点后两位)
(1)反应生成沉淀的质量为_____g;
(2)样品中硫酸钠的质量;
(3)求滤液中氯化钠的质量分数。
⑴根据质量守恒定律,沉淀:10g+87g+54.65g-140g=11.65g
⑵解:设样品中硫酸钠的质量为x,反应中生成的氯化钠质量为y.
Na2SO4+BaCl2= BaSO4↓ + 2NaCl
142 233 117
x 11.65 g y
142 x
233 11.65g
x=7.1g
⑶ 233 11.65g
117 y
y=5.85g
滤液中氯化钠的质量=10.00g﹣7.1g+5.85g=8.75g
滤液中氯化钠的质量分数为: ×100%=6.25%.
答:
=
=
某化学兴趣小组同学欲除去固体氯化钠中混有的氯化钙,设计实验方案如图.
(1)写出A物质的化学式 该物质的俗称是 .
(2)操作(2)的名称是 .
(3)写出反应(3)的化学方程式 .
(4)反应(1)中加入过量A物质的目的是 .反应(3)中如果加入盐酸也过量,则对所得到的氯化钠纯度 影响;
(5)分离后所得氯化钠的质量与分离前原混合物中氯化钠的质量相比较,结果 .
说明除去下列物质中少量杂质的方法和依据的原理
1、白砂糖中混有细沙
2、KNO3中晶体混有NaCl
3、酒精中混有水
4、铁粉中混有铜粉
溶解性
磁性
溶解度受温度的影响
资料:
酒精的沸点78℃
水的沸点100℃
沸点
物
理
方
法
学以致用
除杂原则
不增
不 减
易分
不
增加
新杂质
不
减 少
产品
气体
水
沉淀
思路归纳 能力提升
除去杂质,一般遵循什么样的思路?
成分分析
明确
思路
物理方法
化学方法
除杂质
选择
方法
思路归纳 能力提升
提纯某种物质,一般遵循什么样的思路?
成分分析
明确
思路
物理方法
化学方法
除杂质
选择
方法
合适的试剂
合理的用量
顺序要得当
过量的处理
确定
细节
甲、乙两组同学在探究物质的性质实验时,得到的废液中共含有K+、Ba2+、Cu2+、OH-、NO3-、CO32-六种离子。经测试:甲组同学实验所得废液的pH =13;那么,乙组同学实验废液中含有的离子是 。
经合作讨论,甲、乙两组同学将实验产生的废液按适当比例混合后,可将废液中对环境污染较为严重的Ba2+、Cu2+、OH-离子除去。请写出废液混合后发生的任意两个反应的化学方程式:
① ;
② 。
Cu2+、 Ba2+、NO3-
【拓展延伸】
Ba(NO3)2+K2CO3 ===2KNO3+ BaCO3↓
Cu (NO3)2+2KOH=== Cu( OH)2↓+ 2K NO3
海水
一、化学资源
二、海水晒盐
海水中的物质
海水淡化
制镁
海水中最多的盐:
原理:
流程:
方法
锰结核
蒸馏法
常用
粗盐提纯
方法步骤
三、海水制碱
方法
过程
氨碱法制纯碱
过程
精盐水
纯碱性质
碳酸氢钠
纯碱
俗名
用途:
原理
1.
2.
3.
4.
纯碱性质
大多数盐也有类似性质
复分解反应条件
转化
结晶方法
蒸发结晶
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
