8.2.1 常见的酸(1)——酸的物理性质-2021-2022学年九年级化学科粤版下册(共19张PPT)
文档属性
| 名称 | 8.2.1 常见的酸(1)——酸的物理性质-2021-2022学年九年级化学科粤版下册(共19张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-09 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
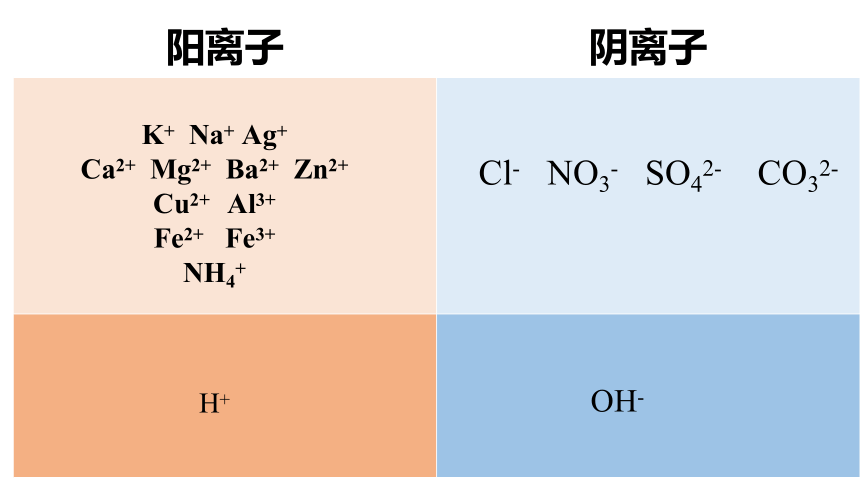
阳离子 阴离子
K+ Na+ Ag+
Ca2+ Mg2+ Ba2+ Zn2+
Cu2+ Al3+
Fe2+ Fe3+
NH4+
H+
OH-
Cl- NO3- SO42- CO32-
8.2.1 常见的酸(1)——酸的物理性质
学习目标
1.了解浓硫酸、浓盐酸、浓硝酸的物理性质。
2.了解浓硫酸的吸水性、脱水性和强腐蚀性
3.学习浓硫酸稀释的实验方法。
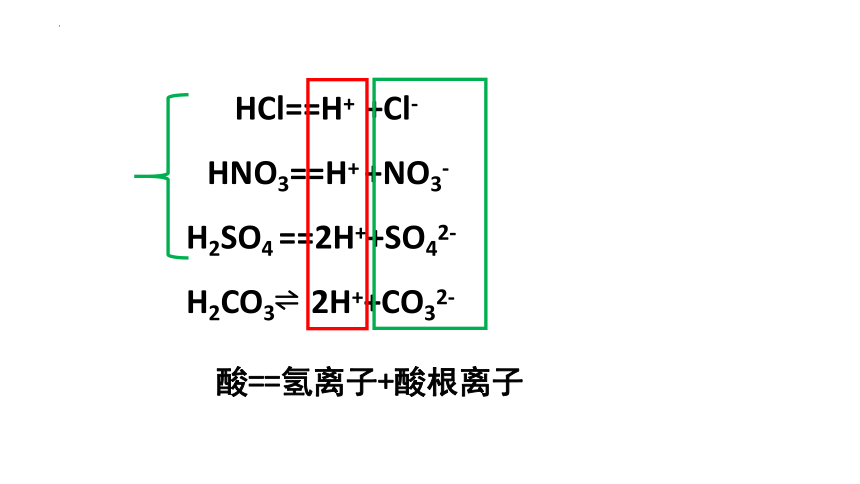
HCl==H+ +Cl-
HNO3==H+ +NO3-
H2SO4 ==2H++SO42-
H2CO3 2H++CO32-
酸==氢离子+酸根离子
在实验室常用的酸有三种:盐酸(_____)、硫酸(_____)和硝酸(______)。
HCl
H2SO4
HNO3
盐酸
硫酸
硝酸
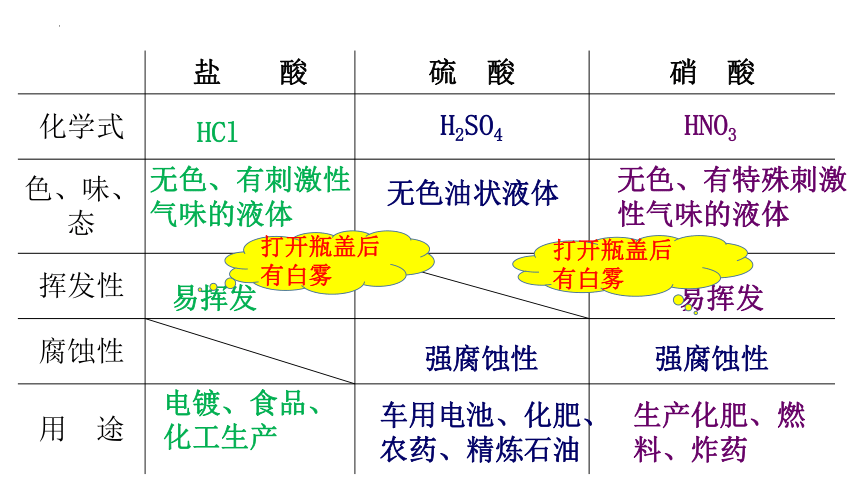
盐 酸 硫 酸 硝 酸
化学式
色、味、态
挥发性
腐蚀性
用 途
HCl
H2SO4
HNO3
无色、有刺激性气味的液体
无色油状液体
无色、有特殊刺激性气味的液体
易挥发
强腐蚀性
电镀、食品、化工生产
车用电池、化肥、农药、精炼石油
生产化肥、燃料、炸药
强腐蚀性
易挥发
打开瓶盖后有白雾
打开瓶盖后有白雾
1.打开浓盐酸瓶塞,看到的现象是: ,
原因是 。
出现“白雾”
浓盐酸挥发出的氯化氢气体与空气中水蒸气结合成盐酸小液滴
2.浓盐酸敞口放置:
HCl溶质质量 ,
H2O溶剂质量 ,
溶液质量 ,
溶质质量分数 .
减小
不变
减小
减小
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
3.打开浓硝酸瓶塞,看到的现象是 ,
原因是 .
出现“白雾”
浓硝酸挥发出的HNO3与空气中水蒸气结合成硝酸小液滴
4.浓硝酸敞口放置:
HNO3溶质质量 ,
H2O溶剂质量 ,
溶液质量 ,
溶质质量分数 .
减小
不变
减小
减小
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
1.浓硫酸具有吸水性——可做某些气体的干燥剂,只能干燥不能与它反应的气体。如O2、H2、CO2等,不能干燥氨气(NH3)
代表需要干燥的气体分子
浓硫酸
需要干燥的混合气体
干燥气体
代表水分子
浓硫酸特性:
1.吸水性(吸收水蒸气),不易挥发
a.浓硫酸敞口放置:
溶剂质量 ,
溶质质量 ,
溶液质量 ,
溶质质量分数 。
增大
增大
减小
不变
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
2.浓硫酸有脱水性
实验操作:
(1)用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
实验现象:
写过字的地方变黑了
实验操作:(2)在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
实验操作:(3)取20g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
肉皮被腐蚀变黑。
实验现象:
实验现象:
蔗糖变黑,体积增加
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。
实验结论:
脱水性指的是物质中没有水,浓硫酸是把化合物中的氢、氧原子按水(2:1)的构成比例脱去,属于化学性质。
浓硫酸对衣物、皮肤都有强腐蚀性,腐蚀性的实质还是浓硫酸具有脱水性,也属于化学性质。
如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。如果是沾到皮肤上,还需涂上3%~5%的碳酸氢钠溶液。浓硫酸是危险品,保管和使用都要格外小心。
浓硫酸的腐蚀性
1.吸水性(物理性质)——干燥
2.脱水性(化学性质)——变黑、碳化
3.腐蚀性(化学性质)——破洞、腐蚀等
总结
4.浓硫酸的稀释
②玻璃棒的作用:
搅拌,散热
①操作:
注意:切不可将水倒进浓硫酸里!
将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
酸入水
当水滴入浓硫
酸里后果是:
酸液四处飞溅
原因:
1.浓硫酸密度比水大,水漂在上面
2.浓硫酸溶于水放热
酸:解离出阳离子全是H+的化合物
HCl==H+ +Cl-
HNO3==H+ +NO3-
H2SO4 ==2H++SO42-
H2CO3 2H++CO32-
酸==氢离子+酸根离子
课堂小结
1.浓盐酸、浓硝酸有挥发性,敞口放置,溶质质量变小,导致溶质质量分数变小。
2.浓硫酸的特性:
①吸水性(物理性质)——干燥——敞口放置,溶剂质量变大,导致溶质质量分数变小。
②脱水性(化学性质)——变黑、碳化
③腐蚀性(化学性质)——破洞、腐蚀等
3.浓硫酸的稀释
酸入水
玻璃棒的作用:搅拌,散热
课堂小结
阳离子 阴离子
K+ Na+ Ag+
Ca2+ Mg2+ Ba2+ Zn2+
Cu2+ Al3+
Fe2+ Fe3+
NH4+
H+
OH-
Cl- NO3- SO42- CO32-
8.2.1 常见的酸(1)——酸的物理性质
学习目标
1.了解浓硫酸、浓盐酸、浓硝酸的物理性质。
2.了解浓硫酸的吸水性、脱水性和强腐蚀性
3.学习浓硫酸稀释的实验方法。
HCl==H+ +Cl-
HNO3==H+ +NO3-
H2SO4 ==2H++SO42-
H2CO3 2H++CO32-
酸==氢离子+酸根离子
在实验室常用的酸有三种:盐酸(_____)、硫酸(_____)和硝酸(______)。
HCl
H2SO4
HNO3
盐酸
硫酸
硝酸
盐 酸 硫 酸 硝 酸
化学式
色、味、态
挥发性
腐蚀性
用 途
HCl
H2SO4
HNO3
无色、有刺激性气味的液体
无色油状液体
无色、有特殊刺激性气味的液体
易挥发
强腐蚀性
电镀、食品、化工生产
车用电池、化肥、农药、精炼石油
生产化肥、燃料、炸药
强腐蚀性
易挥发
打开瓶盖后有白雾
打开瓶盖后有白雾
1.打开浓盐酸瓶塞,看到的现象是: ,
原因是 。
出现“白雾”
浓盐酸挥发出的氯化氢气体与空气中水蒸气结合成盐酸小液滴
2.浓盐酸敞口放置:
HCl溶质质量 ,
H2O溶剂质量 ,
溶液质量 ,
溶质质量分数 .
减小
不变
减小
减小
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
3.打开浓硝酸瓶塞,看到的现象是 ,
原因是 .
出现“白雾”
浓硝酸挥发出的HNO3与空气中水蒸气结合成硝酸小液滴
4.浓硝酸敞口放置:
HNO3溶质质量 ,
H2O溶剂质量 ,
溶液质量 ,
溶质质量分数 .
减小
不变
减小
减小
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
1.浓硫酸具有吸水性——可做某些气体的干燥剂,只能干燥不能与它反应的气体。如O2、H2、CO2等,不能干燥氨气(NH3)
代表需要干燥的气体分子
浓硫酸
需要干燥的混合气体
干燥气体
代表水分子
浓硫酸特性:
1.吸水性(吸收水蒸气),不易挥发
a.浓硫酸敞口放置:
溶剂质量 ,
溶质质量 ,
溶液质量 ,
溶质质量分数 。
增大
增大
减小
不变
物理变化
溶质质量分数= ×100%
溶质质量
溶质质量+溶剂质量
2.浓硫酸有脱水性
实验操作:
(1)用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
实验现象:
写过字的地方变黑了
实验操作:(2)在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
实验操作:(3)取20g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
肉皮被腐蚀变黑。
实验现象:
实验现象:
蔗糖变黑,体积增加
浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。
实验结论:
脱水性指的是物质中没有水,浓硫酸是把化合物中的氢、氧原子按水(2:1)的构成比例脱去,属于化学性质。
浓硫酸对衣物、皮肤都有强腐蚀性,腐蚀性的实质还是浓硫酸具有脱水性,也属于化学性质。
如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。如果是沾到皮肤上,还需涂上3%~5%的碳酸氢钠溶液。浓硫酸是危险品,保管和使用都要格外小心。
浓硫酸的腐蚀性
1.吸水性(物理性质)——干燥
2.脱水性(化学性质)——变黑、碳化
3.腐蚀性(化学性质)——破洞、腐蚀等
总结
4.浓硫酸的稀释
②玻璃棒的作用:
搅拌,散热
①操作:
注意:切不可将水倒进浓硫酸里!
将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
酸入水
当水滴入浓硫
酸里后果是:
酸液四处飞溅
原因:
1.浓硫酸密度比水大,水漂在上面
2.浓硫酸溶于水放热
酸:解离出阳离子全是H+的化合物
HCl==H+ +Cl-
HNO3==H+ +NO3-
H2SO4 ==2H++SO42-
H2CO3 2H++CO32-
酸==氢离子+酸根离子
课堂小结
1.浓盐酸、浓硝酸有挥发性,敞口放置,溶质质量变小,导致溶质质量分数变小。
2.浓硫酸的特性:
①吸水性(物理性质)——干燥——敞口放置,溶剂质量变大,导致溶质质量分数变小。
②脱水性(化学性质)——变黑、碳化
③腐蚀性(化学性质)——破洞、腐蚀等
3.浓硫酸的稀释
酸入水
玻璃棒的作用:搅拌,散热
课堂小结
