(新人教版)6.4实验活动7 化学反应速率的影响因素 高中化学必修二 课后培优练(含解析)
文档属性
| 名称 | (新人教版)6.4实验活动7 化学反应速率的影响因素 高中化学必修二 课后培优练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 467.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-08 17:35:12 | ||
图片预览


文档简介
6.4实验活动7 化学反应速率的影响因素同步练习人教版( 2019)高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
注意:本试卷包含Ⅰ、Ⅱ两卷。第Ⅰ卷为选择题,所有答案必须用2B铅笔涂在答题卡中相应的位置。第Ⅱ卷为非选择题,所有答案必须填在答题卷的相应位置。答案写在试卷上均无效,不予记分。
第I卷(选择题)
一、单选题(本大题共10小题,共30.0分)
为探究铁与稀硫酸的反应速率,向反应混合液中加入某些物质,下列关于变化判断正确的是
A. 加入溶液,减小 B. 加入 固体,不变
C. 加入 固体,不变 D. 加入 固体,减小
探究反应速率的影响因素,有关实验数据如表所示:
实验
编号 温度
催化剂用
量 酸性溶液 溶液 溶液褪色平均时间
体积
浓度
体积
浓度
下列说法不正确的是
A. ,
B. 用表示该反应速率实验实验
C. 用表示溶液褪色时间段反应速率,实验
D. 可通过比较收集相同体积所消耗的时间来判断反应速率快慢
以反应为例探究“外界条件对化学反应速率的影响”。实验时,分别量取溶液和酸性溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。下列说法不正确的是
编号 溶液 酸性溶液 温度
浓度 体积 浓度 体积
A. 实验、、所加的溶液均要过量
B. 实验和起初反应均很慢,过了一会儿速率突然增大,可能是生成的对反应起催化作用
C. 实验和实验是探究浓度对化学反应速率的影响,实验和是探究温度对化学反应速率的影响
D. 实验测得溶液的褪色时间为,则这段时间内的平均反应速率
某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是
A. 向甲烧杯中加入适量 B. 向甲中试管内滴加适量浓硫酸
C. 向乙烧杯中加入适量冰块 D. 增大甲装置所在环境的压强
下列叙述不正确的是
A. 用稀硫酸和锌粒制取时,加几滴溶液以加快反应速率
B. 向支盛有不同浓度溶液的试管中同时加入溶液,观察实验现象,不能达到探究浓度对反应速率的影响的目的
C. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
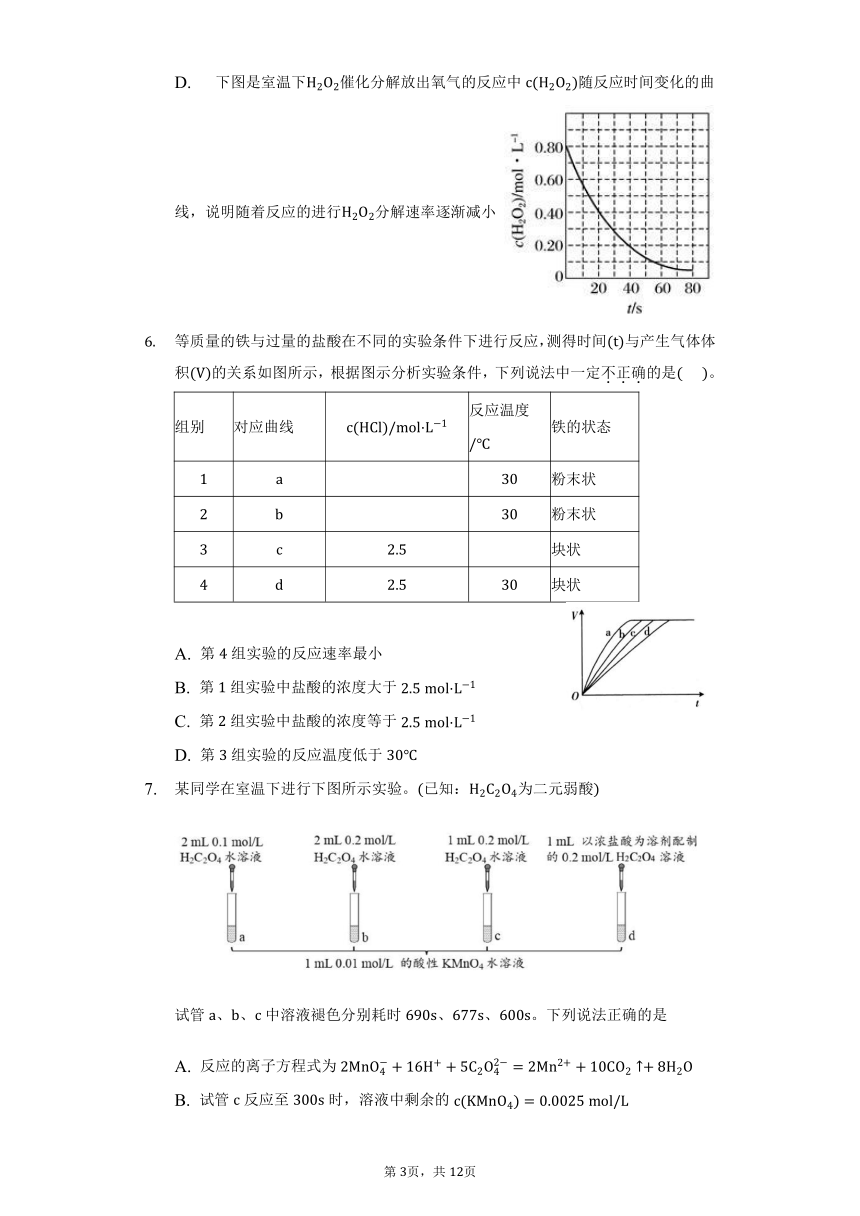
D. 下图是室温下催化分解放出氧气的反应中随反应时间变化的曲线,说明随着反应的进行分解速率逐渐减小
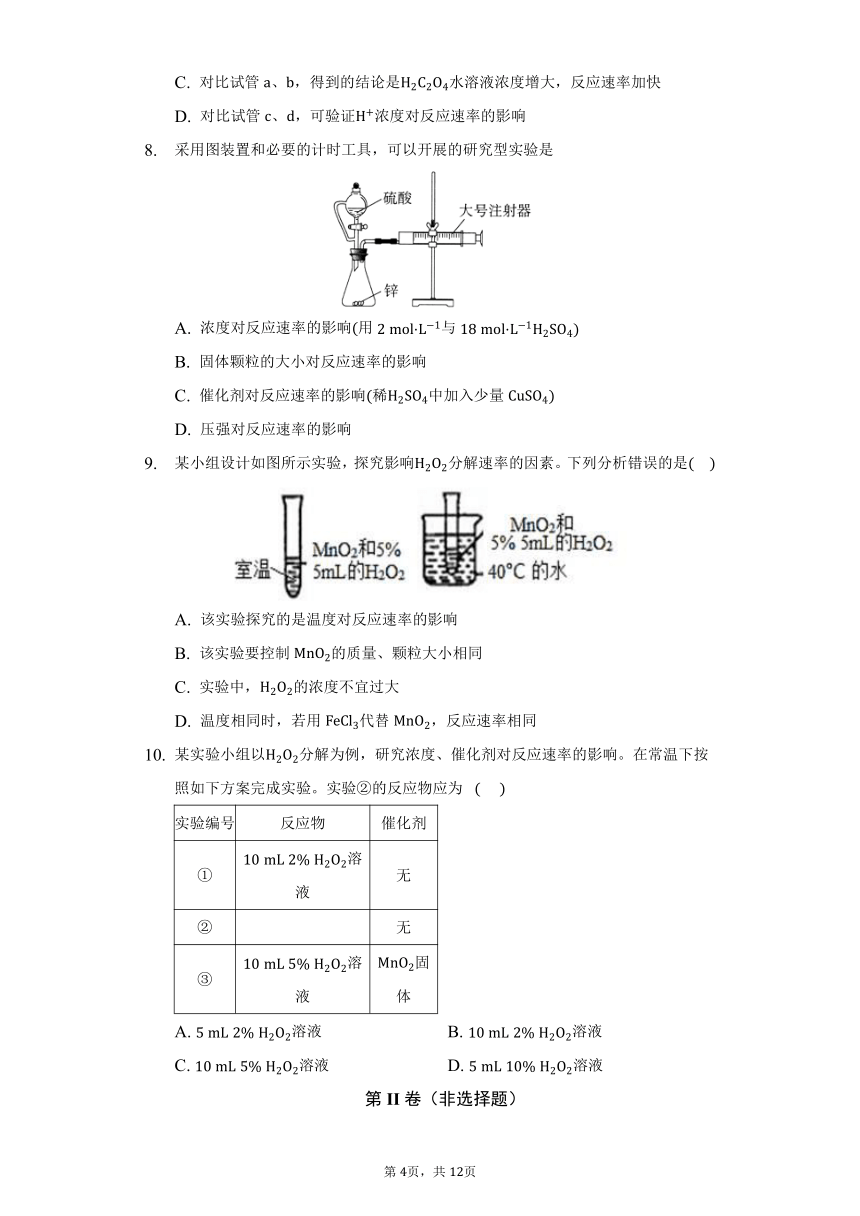
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得时间与产生气体体积的关系如图所示,根据图示分析实验条件,下列说法中一定不正确的是 。
组别 对应曲线 反应温度 铁的状态
粉末状
粉末状
块状
块状
A. 第组实验的反应速率最小
B. 第组实验中盐酸的浓度大于
C. 第组实验中盐酸的浓度等于
D. 第组实验的反应温度低于
某同学在室温下进行下图所示实验。已知:为二元弱酸
试管、、中溶液褪色分别耗时、、。下列说法正确的是
A. 反应的离子方程式为
B. 试管反应至时,溶液中剩余的
C. 对比试管、,得到的结论是水溶液浓度增大,反应速率加快
D. 对比试管、,可验证浓度对反应速率的影响
采用图装置和必要的计时工具,可以开展的研究型实验是
A. 浓度对反应速率的影响用与
B. 固体颗粒的大小对反应速率的影响
C. 催化剂对反应速率的影响稀中加入少量
D. 压强对反应速率的影响
某小组设计如图所示实验,探究影响分解速率的因素。下列分析错误的是
A. 该实验探究的是温度对反应速率的影响
B. 该实验要控制的质量、颗粒大小相同
C. 实验中,的浓度不宜过大
D. 温度相同时,若用代替,反应速率相同
某实验小组以分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验的反应物应为
实验编号 反应物 催化剂
溶液 无
无
溶液 固体
A. 溶液 B. 溶液
C. 溶液 D. 溶液
第II卷(非选择题)
二、填空题(本大题共1小题,共8.0分)
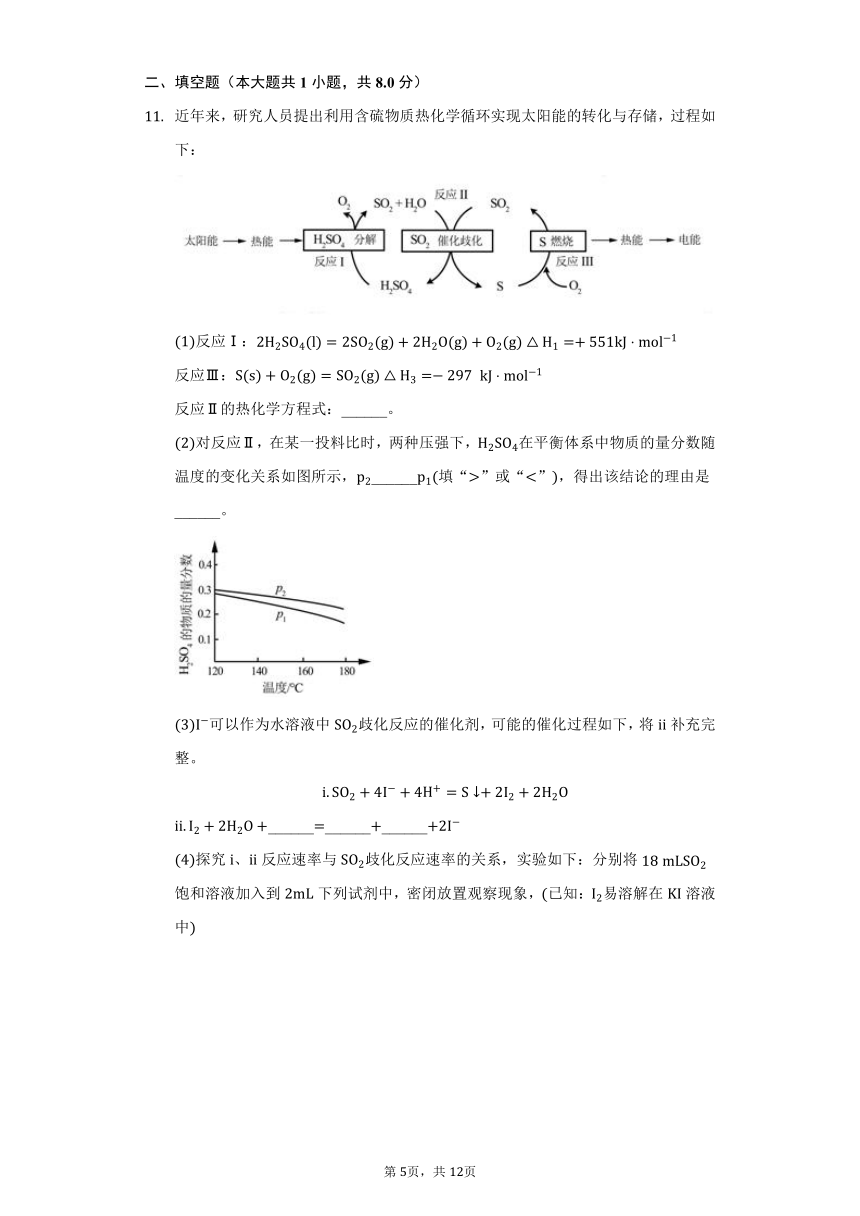
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:______。
对反应Ⅱ,在某一投料比时,两种压强下,在平衡体系中物质的量分数随温度的变化关系如图所示,______填“”或“”,得出该结论的理由是______。
可以作为水溶液中歧化反应的催化剂,可能的催化过程如下,将补充完整。
__________________
探究、反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到下列试剂中,密闭放置观察现象,已知:易溶解在溶液中
序号
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较快 无明显现象象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较快
是的对比实验,则______。
比较、、,可得出的结论是______。
实验表明,的歧化反应速率结合,反应速率解释原因:______。
三、实验题(本大题共1小题,共10.0分)
某同学用相同质量的锌粉先后与盐酸及相同体积未知浓度的盐酸反应,记录相关数据,并作出两个反应过程中放出气体的体积随反应时间的变化图如图所示。
如果请你做这一实验,你如何测量反应放出气体的体积?
请根据图示判断并解释,该同学所用未知浓度的盐酸,其浓度是高于还是低于。
如果用硫酸代替上述实验中的盐酸,二者的反应速率是否相同?请说明原因。
答案和解析
1.【答案】
【解析】
【分析】
本题考查影响化学反应速率的因素,明确氢离子的浓度及其物质的量的变化是解答本题的关键,注意选项D为解答的难点和易错点,题目难度不大。
【解答】
A.加入溶液,体积增大,氢离子浓度减小,所以减小,故A正确;
B.硫酸氢钠在溶液中电离产生氢离子,导致氢离子的浓度变大,增大,故B错误;
C.硝酸钠电离产生的硝酸根离子与氢离子构成强氧化性体系,产生氮的氧化物,而不产生氢气,故C错误;
D.置换产生的铜与铁构成原电池,加快化学反应速率,增大,故D错误。
故选A。
2.【答案】
【解析】A.对比实验、可知,实验、中只有温度不同,温度越高反应速率越快,溶液褪色时间越短,即;实验使用催化剂,实验没有使用催化剂,催化剂可加快反应速率,实验中溶液先褪色,则,故A正确;
B.对比实验、可知,实验、中只有的浓度不同,浓度越大反应速率越快,则用表示该反应速率实验实验,故B错误;
C.反应为,实验中::::,则过量,实验中溶液总体积为,用表示溶液褪色时间段反应速率,故C正确;
D.判断反应速率快慢的方法:单位时间内产物的物质的量的变化量的多少或比较收集相同气体体积所消耗的时间长短或单位时间内物质浓度的变化量等,该实验中的溶解性较小,通过比较收集相同体积所消耗的时间,也可判断反应速率快慢,故D正确;
故选:。
本题考查化学反应速率的计算及其影响因素,为高频考点,把握反应速率的影响因素、控制变量法、速率计算为解答的关键,侧重考查学生的分析能力、计算能力和化学实验能力,注意选项C为易错点,题目难度中等。
3.【答案】
【解析】实验、、均需要通过高锰酸钾溶液褪色的时间来判断,需要保证高锰酸钾完全反应,因此所加的溶液均要过量,A正确;
实验和起初反应均很慢,过了一会儿,反应生成的对反应起到了催化作用,使反应速率突然增大,B正确;
依据变量唯一可知,探究反应物浓度对化学反应速率的影响,除了浓度不同,其他条件完全相同的实验编号是和,探究温度对化学反应速率的影响,除了温度不同,其他条件完全相同,则满足此条件的实验编号是和,C正确;
高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为 ,这段时间内的平均反应速率 ,D错误。
4.【答案】
【解析】氧化钙与水反应生成氢氧化钙放出大量的热,向甲烧杯中加入适量氧化钙会使甲中反应温度高于乙,反应速率大于乙,甲中试管先出现浑浊,能达到目的;
向甲中试管内滴加适量浓硫酸,浓硫酸稀释时放出大量的热,且溶液中氢离子浓度增大,会使反应速率加快,甲中试管先出现浑浊,能达到目的;
向乙烧杯中加入适量冰块,反应温度会低于甲,反应速率小于甲,甲中试管先出现浑浊,能达到目的;
硫代硫酸钠和硫酸都不是气体,增大甲装置所在环境的压强,不能改变反应速率,不能使甲中试管先出现浑浊,不能达到目的。
5.【答案】
【解析】
【分析】
本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、反应速率、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
【解答】
A.加硫酸铜可置换出,构成原电池,可加快反应速率,故A正确;
B.二者发生氧化还原反应,现象不明显,不能探究浓度对反应速率的影响,故B正确;
C.酶在一定温度下,催化活性比较高,但是在此温度之上,温度越高,酶的活性越低,催化效果越低,则使得反应速率降低,故C错误;
D.随着反应的进行,越来越低,分解速率也越来越低,故D正确。
故选C。
6.【答案】
【解析】由图像可知,、、、组实验产生的氢气一样多,只是反应速率有快慢之分。第组实验,反应所用时间最长,故反应速率最小,项正确;第组实验,反应所用时间最短,故反应速率最大,根据控制变量法原则知盐酸浓度应大于,项正确;第组实验,铁是粉末状,与、组块状铁相区别,根据控制变量法原则知盐酸的浓度应等于,项正确;由、组实验并结合图像知,第组实验中反应温度应高于,项错误。
7.【答案】
【解析】
【分析】
本题主要考查化学反应速率影响因素的探究,意在考查学生的分析能力、探究能力和知识应用能力,理解影响化学反应速率的因素和控制变量法的应用是解题关键,注意反应速率是一段时间内的平均速率、盐酸能与高锰酸钾反应而不能用于酸化溶液,题目难度不大。
【解答】
A.为二元弱酸,书写离子方程式时不能拆开,正确的离子方程式为,故A错误;
B.试管溶液混合瞬间,时反应完全,但前和后内反应速率不相等,所以反应至时,溶液中剩余的,故B错误;
C.试管、实验中,只有草酸浓度不同,其它条件均相同,则对比试管、,得到的结论是水溶液浓度增大,反应速率加快,故C正确;
D.盐酸能与高锰酸钾反应而使高锰酸钾溶液褪色,所以不能验证浓度对反应速率的影响,故D错误;
故选C。
8.【答案】
【解析】
【分析】
本题考查化学反应速率影响因素的探究实验方案的设计与评价,掌握浓度、颗粒大小、催化剂、压强对化学反应速率的影响是解题关键,题目难度不大。
【解答】
A.浓硫酸与锌反应生成二氧化硫,但随着浓硫酸的不断消耗,浓度变稀就与锌反应生成氢气了,所以最后得到氢气与二氧化硫混合气体,这和锌与稀硫酸反应不同,不能研究氢离子浓度对反应速率的影响,故A错误;
B.使用不同颗粒大小的锌与等量的稀硫酸反应,可研究固体颗粒的大小对反应速率的影响,故B正确;
C.稀中加入少量,不仅置换出铜单质消耗更多的锌,减少锌与稀硫酸反应的物质的量,同时形成了原电池加快反应速率,不属于催化剂作用原理,故C错误;
D.压强对固液反应速率无影响,不能使用图装置和必要的计时工具,来开展研究,故D错误。
9.【答案】
【解析】
【分析】
本题考查了外界因素对化学反应速率的影响,注意控制变量法的应用,本题难度不大。
【解答】
A.只有温度不同,故该实验探究的是温度对反应速率的影响,故A正确;
B.研究外界因素对化学反应速率的影响,故该实验要控制的质量、颗粒大小相同,故B正确;
C.浓度越大反应速率越快,现象不明显,故实验中,的浓度不宜过大,故C正确;
D.不同的催化剂,催化效果不同,故温度相同时,用代替,反应速率不一定相同,故D错误。
故选D。
10.【答案】
【解析】略
11.【答案】 ;
;当温度相同时,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大;
;
;
是歧化反应的催化剂,单独存在时不具有催化作用,但可以加快歧化反应速率;
反应速率大于反应,快速发生反应,使迅速增大,从而使反应加快。
【解析】根据图知,反应为,
将方程式即得,
故答案为:;
相同温度下,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大,根据图知,相同温度下,达到平衡状态时硫酸含量:,说明压强,
故答案为:;当温度相同时,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大;
化学反应中的催化剂在第一个反应中作反应物、第二个反应中作生成物,总方程式得,催化过程中,说明、在中作反应物,在中作生成物,同时中还生成,根据元素守恒知,反应物还有,所以中方程式应该为:
,
答案为:;;;
是的对比实验,所用应该相等,否则无法得出正确结论,所以,
故答案为:;
比较、、,中只含、中含有和硫酸、中只含硫酸,反应快慢顺序是,且中没有明显现象,说明不反应,中含有酸导致其反应速率加快,所以得出的结论是:在酸性条件下,与反应速率更快,且与稀硫酸不发生反应,
故答案为:在酸性条件下,与反应速率更快,且与稀硫酸不发生反应;
反应速率大于反应,快速发生反应使迅速增大,从而使反应加快,所以看到的现象是:中出现浑浊较快,
故答案为:反应速率大于反应,快速发生反应使迅速增大,从而使反应加快。
12.【答案】氢气体积的测量可以用带有刻度的注射器:;或者用排水量气装置:。
高于;
不相同;等浓度的硫酸和盐酸溶液,硫酸中的氢离子浓度更高。
【解析】反应生成氢气,氢气体积的测量可以用带有刻度的注射器:,或者用排水量气装置:。
锌和盐酸反应时,盐酸的浓度越高,则反应速率越快,根据图象可知,未知浓度的盐酸和锌反应更快,故未知浓度的盐酸的浓度高于。
硫酸是二元强酸,而是一元强酸,故均为的硫酸和盐酸溶液中硫酸中氢离子浓度更高,故和锌反应速率更快。
第2页,共2页
第1页,共1页
学校:___________姓名:___________班级:___________考号:___________
注意:本试卷包含Ⅰ、Ⅱ两卷。第Ⅰ卷为选择题,所有答案必须用2B铅笔涂在答题卡中相应的位置。第Ⅱ卷为非选择题,所有答案必须填在答题卷的相应位置。答案写在试卷上均无效,不予记分。
第I卷(选择题)
一、单选题(本大题共10小题,共30.0分)
为探究铁与稀硫酸的反应速率,向反应混合液中加入某些物质,下列关于变化判断正确的是
A. 加入溶液,减小 B. 加入 固体,不变
C. 加入 固体,不变 D. 加入 固体,减小
探究反应速率的影响因素,有关实验数据如表所示:
实验
编号 温度
催化剂用
量 酸性溶液 溶液 溶液褪色平均时间
体积
浓度
体积
浓度
下列说法不正确的是
A. ,
B. 用表示该反应速率实验实验
C. 用表示溶液褪色时间段反应速率,实验
D. 可通过比较收集相同体积所消耗的时间来判断反应速率快慢
以反应为例探究“外界条件对化学反应速率的影响”。实验时,分别量取溶液和酸性溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。下列说法不正确的是
编号 溶液 酸性溶液 温度
浓度 体积 浓度 体积
A. 实验、、所加的溶液均要过量
B. 实验和起初反应均很慢,过了一会儿速率突然增大,可能是生成的对反应起催化作用
C. 实验和实验是探究浓度对化学反应速率的影响,实验和是探究温度对化学反应速率的影响
D. 实验测得溶液的褪色时间为,则这段时间内的平均反应速率
某小组设计如图实验,欲使甲中试管先出现浑浊,下列操作一定达不到目的的是
A. 向甲烧杯中加入适量 B. 向甲中试管内滴加适量浓硫酸
C. 向乙烧杯中加入适量冰块 D. 增大甲装置所在环境的压强
下列叙述不正确的是
A. 用稀硫酸和锌粒制取时,加几滴溶液以加快反应速率
B. 向支盛有不同浓度溶液的试管中同时加入溶液,观察实验现象,不能达到探究浓度对反应速率的影响的目的
C. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D. 下图是室温下催化分解放出氧气的反应中随反应时间变化的曲线,说明随着反应的进行分解速率逐渐减小
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得时间与产生气体体积的关系如图所示,根据图示分析实验条件,下列说法中一定不正确的是 。
组别 对应曲线 反应温度 铁的状态
粉末状
粉末状
块状
块状
A. 第组实验的反应速率最小
B. 第组实验中盐酸的浓度大于
C. 第组实验中盐酸的浓度等于
D. 第组实验的反应温度低于
某同学在室温下进行下图所示实验。已知:为二元弱酸
试管、、中溶液褪色分别耗时、、。下列说法正确的是
A. 反应的离子方程式为
B. 试管反应至时,溶液中剩余的
C. 对比试管、,得到的结论是水溶液浓度增大,反应速率加快
D. 对比试管、,可验证浓度对反应速率的影响
采用图装置和必要的计时工具,可以开展的研究型实验是
A. 浓度对反应速率的影响用与
B. 固体颗粒的大小对反应速率的影响
C. 催化剂对反应速率的影响稀中加入少量
D. 压强对反应速率的影响
某小组设计如图所示实验,探究影响分解速率的因素。下列分析错误的是
A. 该实验探究的是温度对反应速率的影响
B. 该实验要控制的质量、颗粒大小相同
C. 实验中,的浓度不宜过大
D. 温度相同时,若用代替,反应速率相同
某实验小组以分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验的反应物应为
实验编号 反应物 催化剂
溶液 无
无
溶液 固体
A. 溶液 B. 溶液
C. 溶液 D. 溶液
第II卷(非选择题)
二、填空题(本大题共1小题,共8.0分)
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:______。
对反应Ⅱ,在某一投料比时,两种压强下,在平衡体系中物质的量分数随温度的变化关系如图所示,______填“”或“”,得出该结论的理由是______。
可以作为水溶液中歧化反应的催化剂,可能的催化过程如下,将补充完整。
__________________
探究、反应速率与歧化反应速率的关系,实验如下:分别将饱和溶液加入到下列试剂中,密闭放置观察现象,已知:易溶解在溶液中
序号
试剂组成
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较快 无明显现象象 溶液由棕褐色很快褪色,变成黄色,出现浑浊较快
是的对比实验,则______。
比较、、,可得出的结论是______。
实验表明,的歧化反应速率结合,反应速率解释原因:______。
三、实验题(本大题共1小题,共10.0分)
某同学用相同质量的锌粉先后与盐酸及相同体积未知浓度的盐酸反应,记录相关数据,并作出两个反应过程中放出气体的体积随反应时间的变化图如图所示。
如果请你做这一实验,你如何测量反应放出气体的体积?
请根据图示判断并解释,该同学所用未知浓度的盐酸,其浓度是高于还是低于。
如果用硫酸代替上述实验中的盐酸,二者的反应速率是否相同?请说明原因。
答案和解析
1.【答案】
【解析】
【分析】
本题考查影响化学反应速率的因素,明确氢离子的浓度及其物质的量的变化是解答本题的关键,注意选项D为解答的难点和易错点,题目难度不大。
【解答】
A.加入溶液,体积增大,氢离子浓度减小,所以减小,故A正确;
B.硫酸氢钠在溶液中电离产生氢离子,导致氢离子的浓度变大,增大,故B错误;
C.硝酸钠电离产生的硝酸根离子与氢离子构成强氧化性体系,产生氮的氧化物,而不产生氢气,故C错误;
D.置换产生的铜与铁构成原电池,加快化学反应速率,增大,故D错误。
故选A。
2.【答案】
【解析】A.对比实验、可知,实验、中只有温度不同,温度越高反应速率越快,溶液褪色时间越短,即;实验使用催化剂,实验没有使用催化剂,催化剂可加快反应速率,实验中溶液先褪色,则,故A正确;
B.对比实验、可知,实验、中只有的浓度不同,浓度越大反应速率越快,则用表示该反应速率实验实验,故B错误;
C.反应为,实验中::::,则过量,实验中溶液总体积为,用表示溶液褪色时间段反应速率,故C正确;
D.判断反应速率快慢的方法:单位时间内产物的物质的量的变化量的多少或比较收集相同气体体积所消耗的时间长短或单位时间内物质浓度的变化量等,该实验中的溶解性较小,通过比较收集相同体积所消耗的时间,也可判断反应速率快慢,故D正确;
故选:。
本题考查化学反应速率的计算及其影响因素,为高频考点,把握反应速率的影响因素、控制变量法、速率计算为解答的关键,侧重考查学生的分析能力、计算能力和化学实验能力,注意选项C为易错点,题目难度中等。
3.【答案】
【解析】实验、、均需要通过高锰酸钾溶液褪色的时间来判断,需要保证高锰酸钾完全反应,因此所加的溶液均要过量,A正确;
实验和起初反应均很慢,过了一会儿,反应生成的对反应起到了催化作用,使反应速率突然增大,B正确;
依据变量唯一可知,探究反应物浓度对化学反应速率的影响,除了浓度不同,其他条件完全相同的实验编号是和,探究温度对化学反应速率的影响,除了温度不同,其他条件完全相同,则满足此条件的实验编号是和,C正确;
高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为 ,这段时间内的平均反应速率 ,D错误。
4.【答案】
【解析】氧化钙与水反应生成氢氧化钙放出大量的热,向甲烧杯中加入适量氧化钙会使甲中反应温度高于乙,反应速率大于乙,甲中试管先出现浑浊,能达到目的;
向甲中试管内滴加适量浓硫酸,浓硫酸稀释时放出大量的热,且溶液中氢离子浓度增大,会使反应速率加快,甲中试管先出现浑浊,能达到目的;
向乙烧杯中加入适量冰块,反应温度会低于甲,反应速率小于甲,甲中试管先出现浑浊,能达到目的;
硫代硫酸钠和硫酸都不是气体,增大甲装置所在环境的压强,不能改变反应速率,不能使甲中试管先出现浑浊,不能达到目的。
5.【答案】
【解析】
【分析】
本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、反应速率、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
【解答】
A.加硫酸铜可置换出,构成原电池,可加快反应速率,故A正确;
B.二者发生氧化还原反应,现象不明显,不能探究浓度对反应速率的影响,故B正确;
C.酶在一定温度下,催化活性比较高,但是在此温度之上,温度越高,酶的活性越低,催化效果越低,则使得反应速率降低,故C错误;
D.随着反应的进行,越来越低,分解速率也越来越低,故D正确。
故选C。
6.【答案】
【解析】由图像可知,、、、组实验产生的氢气一样多,只是反应速率有快慢之分。第组实验,反应所用时间最长,故反应速率最小,项正确;第组实验,反应所用时间最短,故反应速率最大,根据控制变量法原则知盐酸浓度应大于,项正确;第组实验,铁是粉末状,与、组块状铁相区别,根据控制变量法原则知盐酸的浓度应等于,项正确;由、组实验并结合图像知,第组实验中反应温度应高于,项错误。
7.【答案】
【解析】
【分析】
本题主要考查化学反应速率影响因素的探究,意在考查学生的分析能力、探究能力和知识应用能力,理解影响化学反应速率的因素和控制变量法的应用是解题关键,注意反应速率是一段时间内的平均速率、盐酸能与高锰酸钾反应而不能用于酸化溶液,题目难度不大。
【解答】
A.为二元弱酸,书写离子方程式时不能拆开,正确的离子方程式为,故A错误;
B.试管溶液混合瞬间,时反应完全,但前和后内反应速率不相等,所以反应至时,溶液中剩余的,故B错误;
C.试管、实验中,只有草酸浓度不同,其它条件均相同,则对比试管、,得到的结论是水溶液浓度增大,反应速率加快,故C正确;
D.盐酸能与高锰酸钾反应而使高锰酸钾溶液褪色,所以不能验证浓度对反应速率的影响,故D错误;
故选C。
8.【答案】
【解析】
【分析】
本题考查化学反应速率影响因素的探究实验方案的设计与评价,掌握浓度、颗粒大小、催化剂、压强对化学反应速率的影响是解题关键,题目难度不大。
【解答】
A.浓硫酸与锌反应生成二氧化硫,但随着浓硫酸的不断消耗,浓度变稀就与锌反应生成氢气了,所以最后得到氢气与二氧化硫混合气体,这和锌与稀硫酸反应不同,不能研究氢离子浓度对反应速率的影响,故A错误;
B.使用不同颗粒大小的锌与等量的稀硫酸反应,可研究固体颗粒的大小对反应速率的影响,故B正确;
C.稀中加入少量,不仅置换出铜单质消耗更多的锌,减少锌与稀硫酸反应的物质的量,同时形成了原电池加快反应速率,不属于催化剂作用原理,故C错误;
D.压强对固液反应速率无影响,不能使用图装置和必要的计时工具,来开展研究,故D错误。
9.【答案】
【解析】
【分析】
本题考查了外界因素对化学反应速率的影响,注意控制变量法的应用,本题难度不大。
【解答】
A.只有温度不同,故该实验探究的是温度对反应速率的影响,故A正确;
B.研究外界因素对化学反应速率的影响,故该实验要控制的质量、颗粒大小相同,故B正确;
C.浓度越大反应速率越快,现象不明显,故实验中,的浓度不宜过大,故C正确;
D.不同的催化剂,催化效果不同,故温度相同时,用代替,反应速率不一定相同,故D错误。
故选D。
10.【答案】
【解析】略
11.【答案】 ;
;当温度相同时,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大;
;
;
是歧化反应的催化剂,单独存在时不具有催化作用,但可以加快歧化反应速率;
反应速率大于反应,快速发生反应,使迅速增大,从而使反应加快。
【解析】根据图知,反应为,
将方程式即得,
故答案为:;
相同温度下,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大,根据图知,相同温度下,达到平衡状态时硫酸含量:,说明压强,
故答案为:;当温度相同时,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大;
化学反应中的催化剂在第一个反应中作反应物、第二个反应中作生成物,总方程式得,催化过程中,说明、在中作反应物,在中作生成物,同时中还生成,根据元素守恒知,反应物还有,所以中方程式应该为:
,
答案为:;;;
是的对比实验,所用应该相等,否则无法得出正确结论,所以,
故答案为:;
比较、、,中只含、中含有和硫酸、中只含硫酸,反应快慢顺序是,且中没有明显现象,说明不反应,中含有酸导致其反应速率加快,所以得出的结论是:在酸性条件下,与反应速率更快,且与稀硫酸不发生反应,
故答案为:在酸性条件下,与反应速率更快,且与稀硫酸不发生反应;
反应速率大于反应,快速发生反应使迅速增大,从而使反应加快,所以看到的现象是:中出现浑浊较快,
故答案为:反应速率大于反应,快速发生反应使迅速增大,从而使反应加快。
12.【答案】氢气体积的测量可以用带有刻度的注射器:;或者用排水量气装置:。
高于;
不相同;等浓度的硫酸和盐酸溶液,硫酸中的氢离子浓度更高。
【解析】反应生成氢气,氢气体积的测量可以用带有刻度的注射器:,或者用排水量气装置:。
锌和盐酸反应时,盐酸的浓度越高,则反应速率越快,根据图象可知,未知浓度的盐酸和锌反应更快,故未知浓度的盐酸的浓度高于。
硫酸是二元强酸,而是一元强酸,故均为的硫酸和盐酸溶液中硫酸中氢离子浓度更高,故和锌反应速率更快。
第2页,共2页
第1页,共1页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
