2021-2022学年高一化学人教版(2019)必修第二册5.2氮及其化合物 课件(51张ppt)
文档属性
| 名称 | 2021-2022学年高一化学人教版(2019)必修第二册5.2氮及其化合物 课件(51张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-04-09 09:11:07 | ||
图片预览










文档简介
(共51张PPT)
2019新教材必修二
第二节 氮及其化合物
引入
在国民经济和日常生活中,氮气有广泛的用途。首先,利用它“性格孤独”的特点,我们将它充灌在电灯泡里,可防止钨丝的氧化延长灯泡的使用寿命。还可用它来代替惰性气体作焊接金属时的保护气。氮气为什么可以作保护气 有什么特点呢?
一、氮气
1、氮的结构特点:P11
氮在周期表中的原子序数是7,最外层 5 个电子,可能得到 3 个电子,也可能失去 5 个电子,但是得失电子都不容易,因此只能与其他原子共用电子。N2中两个氮原子间形成N≡N,断开该化学键需要较高的能量,因此氮气很稳定,不容易和其他物质反应。
2. N2的物理性质
气体
小
无毒
3. N2的化学性质
一般不反应,特殊情况下发生下列反应:
3Mg+N2 Mg3N2
N2+3H2 2NH3
N2+O2 2NO
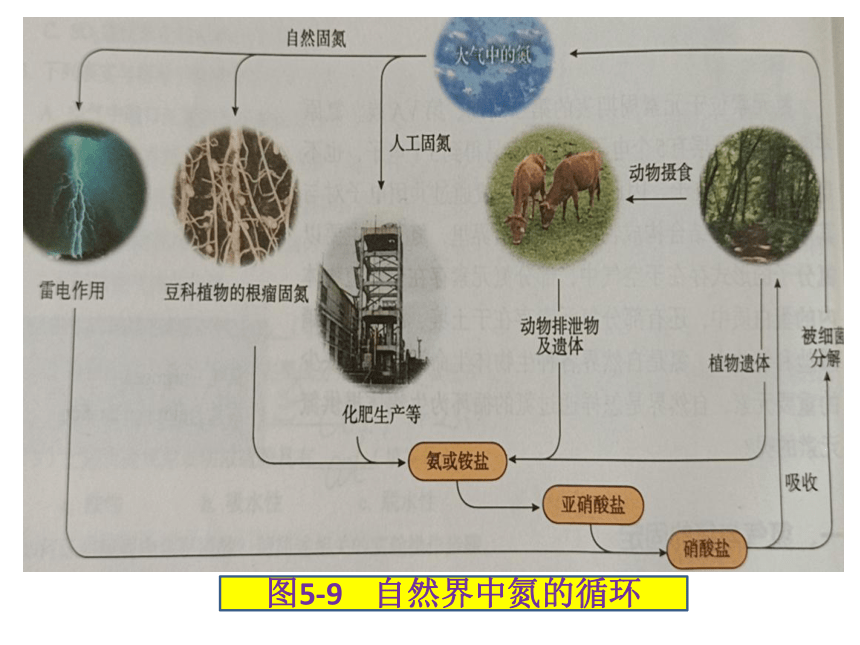
人工固氮
自然固氮,豆科植物的根瘤菌将N2转化为氨也是自然固氮
图5-9 自然界中氮的循环
随堂测:判断
1)氮的固定中氮元素一定被氧化
2)N2即可做氧化剂,又可做还原剂
3)汽车尾气NO是N2和O2在雷电条件下反应产生的
4)1molN2和3molH2完全反应生成2molNH3
5) 医生利用液氮给手术刀降温(称为“冷刀”),利用的是液氮沸点低,变成气体时吸收热量造成周围温度降低。
1. X 2.√ 3.X 4.X 5.√
二、一氧化氮和二氧化氮
1.物理性质(P13)
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气态 _____ 有毒 ___溶于水
NO2 _______ 气态 _______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激姓
易
2.化学性质:
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
分析氧化剂/还原剂
氮的氧化物是汽车尾气、造成光化学烟雾的主要污染物质
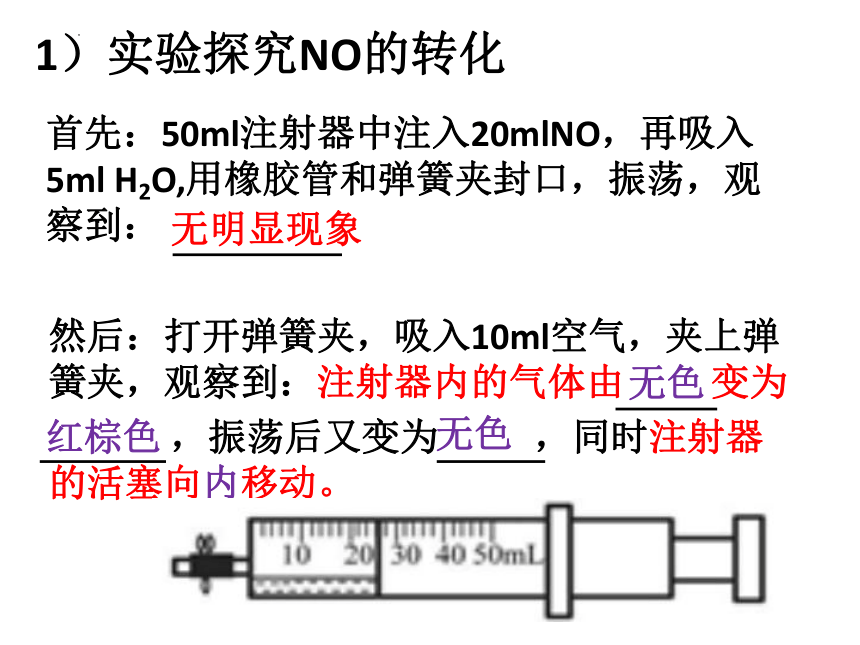
1)实验探究NO的转化
首先:50ml注射器中注入20mlNO,再吸入5ml H2O,用橡胶管和弹簧夹封口,振荡,观察到:
无明显现象
然后:打开弹簧夹,吸入10ml空气,夹上弹簧夹,观察到:注射器内的气体由 变为
,振荡后又变为 ,同时注射器的活塞向内移动。
无色
红棕色
无色
2)实验分析
NO___溶于水,因此遇水无现象;气体变为红棕色,是因为NO与O2反应生成___, 振荡后NO2溶于水生成_____和___,气体又变为无色,同时气体的总体积有所_____。
不
NO2
硝酸
NO
减小
3)拓展
①若要将上题20mlNO完全转化成硝酸,可采取什么措施?
总反应方程式:4NO + 3O2 + 2H2O = 4HNO3
②NO2也能一步完全转化为硝酸,总反应方程式:
4NO2 + 2H2O + O2 = 4HNO3
吸入过量的空气
课堂小结
1 .氮的原子结构、物理性质、化学性质——氮的固定
2.NO、NO2的物理性质、化学性质——NO、NO2之间的相互转化
3.含氮物质连续氧化
(1)N2→NO→NO2 HNO3
(2)NH3→NO→NO2 HNO3
1.下列对NO、NO述,不正确的是( )
A.NO2是红棕色气体,易溶于水,不是酸性氧化物
B.NO可以用排水法收集,但不能由N2和O2直接化合而得到
C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物
D.NO、NO2都有毒,且NO是汽车尾气的有害成分之一
随堂测:
B
2.病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可以由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
C
3. 在NO2与水的反应中,( )
氮元素的化合价不发生变化
NO2只是氧化剂
NO2只是还原剂
NO2既是氧化剂,又是还原剂
D
4.在新疆与青海交界处有一山谷, 每当牧民与牧畜进入后,风和日丽的 晴天顷刻间电闪雷鸣,狂风暴雨,把 人畜击毙。人称“魔鬼谷”。然而谷内确是牧草茂盛,四季常青。 老话即雷雨发庄稼
你能写出雷雨天气促进植物生长所涉及的三条方程式吗?
N2+O2=2NO
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
放电
5.中国汽车销量增长幅度很大,同时也带来了空气污染。汽车尾气转化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。
(1)汽车尾气的主要污染成分包括哪些?
CO、NO2、NO等
(2)由图分析写出汽车尾气转化装置里发生的反应?在反应中氮的氧化物分别表现什么性质?
2NO + O2====2NO2,NO表现还原性;
2NO2 + 4CO ==== 4CO2+N2,NO2表现氧化性
催化剂
2 氨和铵盐
农民种植庄稼需要施肥,铵态氮肥包括碳酸氢铵(NH4HCO3)、硫酸铵(NH4)2SO4、氯化铵(NH4Cl)等,打开肥料袋就能闻到一股刺鼻的气味,夏天厕所里也经常会闻到这种刺激性气味(尿液中有尿素CO(NH2)2 ),这种气体是什么?是怎么产生的?
思考
一、氨气
物理性质:无色有_____ 性气味的气体,密度比空气___,沸点低, 易_____ ,液化时吸收大量的热,使周围温度降低,因此液氨可用作 ,_____溶于水(1∶700),可由_____ 实验证 明。
刺激
小
液化
制冷剂
易
喷泉
喷泉实验
实验成功的关键:
(1)密:装置气密性良好。
(2)干:圆底烧瓶要干燥。
(3)纯:装置内气体的纯度要高。
形成喷泉的前提:圆底烧瓶中的气体能迅速减少(如极易溶于水、或者与胶头滴管中的溶液反应)
如 NH3——H2O
HCl——H2O
NH3——盐酸
氯化氢——NaOH溶液
Cl2——NaOH溶液
2.化学性质:
①氨水:氨气溶于水得氨水。
NH3+H2O NH3 H2O NH4++OH-
②氨水中含有的微粒有:________、___、___、____、___、__。
③NH3·H2O为可溶性一元弱碱,能使_________试
纸变蓝或使酚酞溶液 。
④氨水不稳定,易分解,化学方程式为___
_________________。
NH3·H2O
NH3
H2O
NH4+
OH-
H+
红色石蕊
变红
NH3·H2O====NH3↑+H2O
△
1)氨气与水反应
在高中范围,NH3是唯一的碱性气体
NH3+HCl====NH4Cl
NH3+HNO3==NH4NO3
2NH3+H2SO4==(NH4)2SO4
2)氨气与酸反应
产生白烟,因为氨气、浓盐酸、浓硝酸都会挥发,生成的铵盐为白色固体小颗粒(白烟)
没有白烟:浓硫酸不挥发性酸
应用:管道工人用浓氨水检验氯气管道是否漏气, 原理:
2NH3+3Cl2====N2+6HCl
NH3+HCl====NH4Cl
3) 还原性
NH3中的氮元素的价态为-3,因此NH3不仅能被催化氧化生成NO,在纯氧中燃烧能
生成N2。在一定条件下,NH3还能被Cl2、CuO等氧化。
①催化氧化:______________________。
②在纯氧中燃烧:___________________。
催化剂
=======
△
点燃
4NH3+5O2 4NO+6H2O
4NH3+3O2====2N2+6H2O
氨气知识小结:
一、
二、检验氨气的试剂及现象
1、酚酞溶液——变红
2、紫色石蕊试纸——变蓝
3、浓盐酸或浓硝酸——白烟
随堂测
1.氨气可以做喷泉实验,这是利用氨气( )
A.很易液化 B.比空气轻
C.极易溶于水 D.能跟水起反应
2.氨水显弱碱性的主要原因是( )
A.通常情况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
4.下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+====NH4+中,氨失去电子被氧化
3.关于氨的下列叙述中,错误的是( )
A.氨易液化,因此可用来作制冷剂
B.氨易溶解于水,因此可用来作喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
5.下列四个图中,采取正确的操作,哪个不可以产生喷泉现象( )
二、制备氨气
工业上制备氨气:
实验室制备氨气:用铵盐来制备
N2+3H2 2NH3
1.铵盐的概念:由铵根离子和酸根离子构成的化合物。
2.物理性质
都是无色或白色晶体,_易溶于_水。
3.化学性质
(1)不稳定性
a.NH4Cl受热分解:____________________,
现象:白色固体消失,在试管上方___________________。
b.NH4HCO3受热分解:_________________________,
现象:______________________________________。
△
△
NH4Cl====NH3↑+HCl↑
重新凝结成白色固体
NH4HCO3====NH3↑+CO2↑+H2O
白色固体消失,在试管口部有无色液体凝结
(2)与碱反应
NH4Cl溶液与NaOH溶液共热反应的化学方程式:
____________________________。
铵盐与碱溶液反应的离子方程式
a.在稀溶液中不加热:___________________。
b.加热时或浓溶液:______________________。
△
NH4Cl+NaOH====NaCl+NH3↑+H2O
NH4++OH-====NH3·H2O
NH4+ +OH-====NH3↑+H2O
3. NH4+的检验及NH3的实验室制法
实验室中,用铵盐与强碱反应产生 这一性质,来检验铵根离子的存在和制取氨。
(1)铵根的检验:
原理: NH4++ OH-====NH3↑+H2O
操作:
△
氨气
4.氨气的实验室制法
干燥氨气的试剂:碱石灰(固体CaO和NaOH的混合物),不可用浓硫酸和无水氯化钙
补充:怎么干燥氨气?
【问题探究】
1.实验室能否用加热氯化铵的方法制取氨气
2. 能用NaOH固体、KOH固体和NH4Cl固体混和加热制备氨气吗?
不能。氯化铵受热分解生成的氨气和氯化氢遇冷会重新结合生成氯化铵。
不能。因为NaOH固体、KOH固体具有吸湿性,易结块,不利于产生氨气,同时它们碱性太强,会腐蚀试管。
3.能用NH4HCO3代替NH4Cl制取氨气吗?
不能。受热分解会产生杂质气体。
【探究总结】
1.氨气的实验室制法
(2)液体 NH3(如图装置②)
加热浓氨水:NH3·H2O====NH3↑+H2O
(3)固+液→NH3(下图装置③)
原理:浓氨水与氧化钙固体(或NaOH固体)
CaO+NH3·H2O====Ca(OH)2+NH3↑
NaOH溶于水放热,促使氨水分解,且c(OH-)增大,有利于NH3逸出。
(1)固+固 NH3
知识补充:
常见尾气处理的三种方法
(1)对于极易溶于水的尾气,如NH3、HCl等,需采用防倒吸装置。常见的防倒吸装置:
(2)对于溶解度不大的尾气,如Cl2等,可直接将出气管插入吸收剂液面下吸收。
(3)对于有毒且易燃或易燃的气体,如CO、H2等,可采取在尾气出口处放置一点燃的酒精灯,使CO、H2燃烧转变为CO2、水蒸气。
任务二小结:
一、铵盐
1.物理性质
2.化学性质
受热易分解
与碱反应,生成氨气
二、铵根离子检验
三、氨气的制备
1.工业制备:
2.实验室制备
N2+3H2 2NH3
3 硝酸 酸雨及防治
课前自主学习
1.硝酸是一种强酸,活泼的金属如铁、锌与之反应确不会生成氢气 ,你知道为什么吗?
2.工业上,常用铝槽车或铁槽车装运浓硝酸,难道不反应吗?为什么?
思考
一、硝酸
1.物理性质P15
4HN3 2H2O+4NO2↑+O2↑
2.化学性质
1)不稳定性(见光易或受热易分解,浓度越大,分解速度越快):
2)强氧化性(体现在氮原子上)
A.与某些不活泼金属反应,如和铜
浓硝酸和铜反应的离子方程式:
稀硝酸与铜反应的离子方程式:
B.钝化:浓硫酸和浓硝酸在常温下,都会使铝或铁表面生成致密的氧化物薄膜。
4H++2NO3-+Cu=Cu2++2NO2↑2H2O
8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O
随堂测
1.判断下列说法是否正确
(1)硝酸的浓度越大,其氧化性越强。( )
(2)铜与浓硝酸反应只能生成二氧化氮气体。( )
(3)在铜与硝酸的反应中硝酸只表现氧化性。( )
2.工业上用废铜屑作原料制备硝酸铜。为节约原料和防止污染,宜采取的方法是( )
3.下列反应中硝酸既表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与硫单质混合共热时生成H2SO4和NO2
二、酸雨及其防治
四川乐山有个大佛高达71米,曾四次出现闭眼流泪现象,有些人以为是大佛显灵。事实是怎样的呢?实际上,佛像闭眼的罪魁祸首是酸雨
2.酸雨的的形成
1.正常雨水的PH值大约 ,怎么形成的:
。
酸雨的PH值 5.6
小于
5.6
雨水溶解了空气中的CO2形成了碳酸
3.常见的酸雨类型有哪些 写出有关化学方程式。
②硝酸型酸雨:
3NO2+H2O====2HNO3+NO 或
4NO2+O2+2H2O====4HNO3。
①硫酸型酸雨:
SO2+H2O H2SO3, 2H2SO3+O2====2H2SO4
减少矿物燃烧
开发新能源如太阳能、风能、核能、可燃冰
使用脱硫煤
减少汽车尾气的排放
4.酸雨的防治
随堂测
1.下列有关环境污染的说法正确的是( )
A.煤燃烧时加入适量石灰石,可减少SO2的排放
B.光化学烟雾的形成主要与碳氢化合物有关
C.pH为5.6~7的降水通常称为酸雨
D.含磷洗涤剂易于被细菌分解,故不会导致水体污染
2.(双选)下列说法正确的是( AC )
A.浓硝酸见光易分解,所以要保存在棕色试剂瓶中
B.浓硝酸具有强氧化性,所以能和浓氨水反应产生白烟
C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
课堂素养达标
3.建材厂家常常在铝质材料的表面镀铜,提高材料的美观程度。
某兴趣小组为除去镀在铝表面的铜镀层,可选用的试剂是( )
A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓盐酸
4.向Fe(NO3)2溶液中滴加稀盐酸,观察到的现象是( )
A.溶液由浅绿色变为黄色 B.溶液中产生红棕色气体
C.溶液中产生红褐色气体 D.无任何现象
5.Cu粉放入稀硫酸中,加热无现象,当加入一种盐后,Cu粉质量减小,溶液变蓝,同时有气体生成,此盐是( )
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
谢谢聆听
2019新教材必修二
第二节 氮及其化合物
引入
在国民经济和日常生活中,氮气有广泛的用途。首先,利用它“性格孤独”的特点,我们将它充灌在电灯泡里,可防止钨丝的氧化延长灯泡的使用寿命。还可用它来代替惰性气体作焊接金属时的保护气。氮气为什么可以作保护气 有什么特点呢?
一、氮气
1、氮的结构特点:P11
氮在周期表中的原子序数是7,最外层 5 个电子,可能得到 3 个电子,也可能失去 5 个电子,但是得失电子都不容易,因此只能与其他原子共用电子。N2中两个氮原子间形成N≡N,断开该化学键需要较高的能量,因此氮气很稳定,不容易和其他物质反应。
2. N2的物理性质
气体
小
无毒
3. N2的化学性质
一般不反应,特殊情况下发生下列反应:
3Mg+N2 Mg3N2
N2+3H2 2NH3
N2+O2 2NO
人工固氮
自然固氮,豆科植物的根瘤菌将N2转化为氨也是自然固氮
图5-9 自然界中氮的循环
随堂测:判断
1)氮的固定中氮元素一定被氧化
2)N2即可做氧化剂,又可做还原剂
3)汽车尾气NO是N2和O2在雷电条件下反应产生的
4)1molN2和3molH2完全反应生成2molNH3
5) 医生利用液氮给手术刀降温(称为“冷刀”),利用的是液氮沸点低,变成气体时吸收热量造成周围温度降低。
1. X 2.√ 3.X 4.X 5.√
二、一氧化氮和二氧化氮
1.物理性质(P13)
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气态 _____ 有毒 ___溶于水
NO2 _______ 气态 _______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激姓
易
2.化学性质:
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
分析氧化剂/还原剂
氮的氧化物是汽车尾气、造成光化学烟雾的主要污染物质
1)实验探究NO的转化
首先:50ml注射器中注入20mlNO,再吸入5ml H2O,用橡胶管和弹簧夹封口,振荡,观察到:
无明显现象
然后:打开弹簧夹,吸入10ml空气,夹上弹簧夹,观察到:注射器内的气体由 变为
,振荡后又变为 ,同时注射器的活塞向内移动。
无色
红棕色
无色
2)实验分析
NO___溶于水,因此遇水无现象;气体变为红棕色,是因为NO与O2反应生成___, 振荡后NO2溶于水生成_____和___,气体又变为无色,同时气体的总体积有所_____。
不
NO2
硝酸
NO
减小
3)拓展
①若要将上题20mlNO完全转化成硝酸,可采取什么措施?
总反应方程式:4NO + 3O2 + 2H2O = 4HNO3
②NO2也能一步完全转化为硝酸,总反应方程式:
4NO2 + 2H2O + O2 = 4HNO3
吸入过量的空气
课堂小结
1 .氮的原子结构、物理性质、化学性质——氮的固定
2.NO、NO2的物理性质、化学性质——NO、NO2之间的相互转化
3.含氮物质连续氧化
(1)N2→NO→NO2 HNO3
(2)NH3→NO→NO2 HNO3
1.下列对NO、NO述,不正确的是( )
A.NO2是红棕色气体,易溶于水,不是酸性氧化物
B.NO可以用排水法收集,但不能由N2和O2直接化合而得到
C.NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物
D.NO、NO2都有毒,且NO是汽车尾气的有害成分之一
随堂测:
B
2.病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可以由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
C
3. 在NO2与水的反应中,( )
氮元素的化合价不发生变化
NO2只是氧化剂
NO2只是还原剂
NO2既是氧化剂,又是还原剂
D
4.在新疆与青海交界处有一山谷, 每当牧民与牧畜进入后,风和日丽的 晴天顷刻间电闪雷鸣,狂风暴雨,把 人畜击毙。人称“魔鬼谷”。然而谷内确是牧草茂盛,四季常青。 老话即雷雨发庄稼
你能写出雷雨天气促进植物生长所涉及的三条方程式吗?
N2+O2=2NO
2NO + O2=2NO2
3NO2+H2O=2HNO3+NO
放电
5.中国汽车销量增长幅度很大,同时也带来了空气污染。汽车尾气转化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。
(1)汽车尾气的主要污染成分包括哪些?
CO、NO2、NO等
(2)由图分析写出汽车尾气转化装置里发生的反应?在反应中氮的氧化物分别表现什么性质?
2NO + O2====2NO2,NO表现还原性;
2NO2 + 4CO ==== 4CO2+N2,NO2表现氧化性
催化剂
2 氨和铵盐
农民种植庄稼需要施肥,铵态氮肥包括碳酸氢铵(NH4HCO3)、硫酸铵(NH4)2SO4、氯化铵(NH4Cl)等,打开肥料袋就能闻到一股刺鼻的气味,夏天厕所里也经常会闻到这种刺激性气味(尿液中有尿素CO(NH2)2 ),这种气体是什么?是怎么产生的?
思考
一、氨气
物理性质:无色有_____ 性气味的气体,密度比空气___,沸点低, 易_____ ,液化时吸收大量的热,使周围温度降低,因此液氨可用作 ,_____溶于水(1∶700),可由_____ 实验证 明。
刺激
小
液化
制冷剂
易
喷泉
喷泉实验
实验成功的关键:
(1)密:装置气密性良好。
(2)干:圆底烧瓶要干燥。
(3)纯:装置内气体的纯度要高。
形成喷泉的前提:圆底烧瓶中的气体能迅速减少(如极易溶于水、或者与胶头滴管中的溶液反应)
如 NH3——H2O
HCl——H2O
NH3——盐酸
氯化氢——NaOH溶液
Cl2——NaOH溶液
2.化学性质:
①氨水:氨气溶于水得氨水。
NH3+H2O NH3 H2O NH4++OH-
②氨水中含有的微粒有:________、___、___、____、___、__。
③NH3·H2O为可溶性一元弱碱,能使_________试
纸变蓝或使酚酞溶液 。
④氨水不稳定,易分解,化学方程式为___
_________________。
NH3·H2O
NH3
H2O
NH4+
OH-
H+
红色石蕊
变红
NH3·H2O====NH3↑+H2O
△
1)氨气与水反应
在高中范围,NH3是唯一的碱性气体
NH3+HCl====NH4Cl
NH3+HNO3==NH4NO3
2NH3+H2SO4==(NH4)2SO4
2)氨气与酸反应
产生白烟,因为氨气、浓盐酸、浓硝酸都会挥发,生成的铵盐为白色固体小颗粒(白烟)
没有白烟:浓硫酸不挥发性酸
应用:管道工人用浓氨水检验氯气管道是否漏气, 原理:
2NH3+3Cl2====N2+6HCl
NH3+HCl====NH4Cl
3) 还原性
NH3中的氮元素的价态为-3,因此NH3不仅能被催化氧化生成NO,在纯氧中燃烧能
生成N2。在一定条件下,NH3还能被Cl2、CuO等氧化。
①催化氧化:______________________。
②在纯氧中燃烧:___________________。
催化剂
=======
△
点燃
4NH3+5O2 4NO+6H2O
4NH3+3O2====2N2+6H2O
氨气知识小结:
一、
二、检验氨气的试剂及现象
1、酚酞溶液——变红
2、紫色石蕊试纸——变蓝
3、浓盐酸或浓硝酸——白烟
随堂测
1.氨气可以做喷泉实验,这是利用氨气( )
A.很易液化 B.比空气轻
C.极易溶于水 D.能跟水起反应
2.氨水显弱碱性的主要原因是( )
A.通常情况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
4.下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+====NH4+中,氨失去电子被氧化
3.关于氨的下列叙述中,错误的是( )
A.氨易液化,因此可用来作制冷剂
B.氨易溶解于水,因此可用来作喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
5.下列四个图中,采取正确的操作,哪个不可以产生喷泉现象( )
二、制备氨气
工业上制备氨气:
实验室制备氨气:用铵盐来制备
N2+3H2 2NH3
1.铵盐的概念:由铵根离子和酸根离子构成的化合物。
2.物理性质
都是无色或白色晶体,_易溶于_水。
3.化学性质
(1)不稳定性
a.NH4Cl受热分解:____________________,
现象:白色固体消失,在试管上方___________________。
b.NH4HCO3受热分解:_________________________,
现象:______________________________________。
△
△
NH4Cl====NH3↑+HCl↑
重新凝结成白色固体
NH4HCO3====NH3↑+CO2↑+H2O
白色固体消失,在试管口部有无色液体凝结
(2)与碱反应
NH4Cl溶液与NaOH溶液共热反应的化学方程式:
____________________________。
铵盐与碱溶液反应的离子方程式
a.在稀溶液中不加热:___________________。
b.加热时或浓溶液:______________________。
△
NH4Cl+NaOH====NaCl+NH3↑+H2O
NH4++OH-====NH3·H2O
NH4+ +OH-====NH3↑+H2O
3. NH4+的检验及NH3的实验室制法
实验室中,用铵盐与强碱反应产生 这一性质,来检验铵根离子的存在和制取氨。
(1)铵根的检验:
原理: NH4++ OH-====NH3↑+H2O
操作:
△
氨气
4.氨气的实验室制法
干燥氨气的试剂:碱石灰(固体CaO和NaOH的混合物),不可用浓硫酸和无水氯化钙
补充:怎么干燥氨气?
【问题探究】
1.实验室能否用加热氯化铵的方法制取氨气
2. 能用NaOH固体、KOH固体和NH4Cl固体混和加热制备氨气吗?
不能。氯化铵受热分解生成的氨气和氯化氢遇冷会重新结合生成氯化铵。
不能。因为NaOH固体、KOH固体具有吸湿性,易结块,不利于产生氨气,同时它们碱性太强,会腐蚀试管。
3.能用NH4HCO3代替NH4Cl制取氨气吗?
不能。受热分解会产生杂质气体。
【探究总结】
1.氨气的实验室制法
(2)液体 NH3(如图装置②)
加热浓氨水:NH3·H2O====NH3↑+H2O
(3)固+液→NH3(下图装置③)
原理:浓氨水与氧化钙固体(或NaOH固体)
CaO+NH3·H2O====Ca(OH)2+NH3↑
NaOH溶于水放热,促使氨水分解,且c(OH-)增大,有利于NH3逸出。
(1)固+固 NH3
知识补充:
常见尾气处理的三种方法
(1)对于极易溶于水的尾气,如NH3、HCl等,需采用防倒吸装置。常见的防倒吸装置:
(2)对于溶解度不大的尾气,如Cl2等,可直接将出气管插入吸收剂液面下吸收。
(3)对于有毒且易燃或易燃的气体,如CO、H2等,可采取在尾气出口处放置一点燃的酒精灯,使CO、H2燃烧转变为CO2、水蒸气。
任务二小结:
一、铵盐
1.物理性质
2.化学性质
受热易分解
与碱反应,生成氨气
二、铵根离子检验
三、氨气的制备
1.工业制备:
2.实验室制备
N2+3H2 2NH3
3 硝酸 酸雨及防治
课前自主学习
1.硝酸是一种强酸,活泼的金属如铁、锌与之反应确不会生成氢气 ,你知道为什么吗?
2.工业上,常用铝槽车或铁槽车装运浓硝酸,难道不反应吗?为什么?
思考
一、硝酸
1.物理性质P15
4HN3 2H2O+4NO2↑+O2↑
2.化学性质
1)不稳定性(见光易或受热易分解,浓度越大,分解速度越快):
2)强氧化性(体现在氮原子上)
A.与某些不活泼金属反应,如和铜
浓硝酸和铜反应的离子方程式:
稀硝酸与铜反应的离子方程式:
B.钝化:浓硫酸和浓硝酸在常温下,都会使铝或铁表面生成致密的氧化物薄膜。
4H++2NO3-+Cu=Cu2++2NO2↑2H2O
8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O
随堂测
1.判断下列说法是否正确
(1)硝酸的浓度越大,其氧化性越强。( )
(2)铜与浓硝酸反应只能生成二氧化氮气体。( )
(3)在铜与硝酸的反应中硝酸只表现氧化性。( )
2.工业上用废铜屑作原料制备硝酸铜。为节约原料和防止污染,宜采取的方法是( )
3.下列反应中硝酸既表现出酸性又表现出氧化性的是( )
A.使石蕊溶液变红
B.与铜反应放出NO气体,生成Cu(NO3)2
C.与Na2CO3反应放出CO2气体,生成NaNO3
D.与硫单质混合共热时生成H2SO4和NO2
二、酸雨及其防治
四川乐山有个大佛高达71米,曾四次出现闭眼流泪现象,有些人以为是大佛显灵。事实是怎样的呢?实际上,佛像闭眼的罪魁祸首是酸雨
2.酸雨的的形成
1.正常雨水的PH值大约 ,怎么形成的:
。
酸雨的PH值 5.6
小于
5.6
雨水溶解了空气中的CO2形成了碳酸
3.常见的酸雨类型有哪些 写出有关化学方程式。
②硝酸型酸雨:
3NO2+H2O====2HNO3+NO 或
4NO2+O2+2H2O====4HNO3。
①硫酸型酸雨:
SO2+H2O H2SO3, 2H2SO3+O2====2H2SO4
减少矿物燃烧
开发新能源如太阳能、风能、核能、可燃冰
使用脱硫煤
减少汽车尾气的排放
4.酸雨的防治
随堂测
1.下列有关环境污染的说法正确的是( )
A.煤燃烧时加入适量石灰石,可减少SO2的排放
B.光化学烟雾的形成主要与碳氢化合物有关
C.pH为5.6~7的降水通常称为酸雨
D.含磷洗涤剂易于被细菌分解,故不会导致水体污染
2.(双选)下列说法正确的是( AC )
A.浓硝酸见光易分解,所以要保存在棕色试剂瓶中
B.浓硝酸具有强氧化性,所以能和浓氨水反应产生白烟
C.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
课堂素养达标
3.建材厂家常常在铝质材料的表面镀铜,提高材料的美观程度。
某兴趣小组为除去镀在铝表面的铜镀层,可选用的试剂是( )
A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓盐酸
4.向Fe(NO3)2溶液中滴加稀盐酸,观察到的现象是( )
A.溶液由浅绿色变为黄色 B.溶液中产生红棕色气体
C.溶液中产生红褐色气体 D.无任何现象
5.Cu粉放入稀硫酸中,加热无现象,当加入一种盐后,Cu粉质量减小,溶液变蓝,同时有气体生成,此盐是( )
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
谢谢聆听
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
